1 Introduction
Actuellement, l'une des principales sources d'obtention du soufre élémentaire est le gaz naturel contenant des composés sulfurés. Le dihydrogène sulfuré (H2S) se trouve également dans les gaz de raffinage du pétrole, le gaz contenant du SO2, le gaz de métallurgie et dans le gaz de différentes centrales électriques à production simultanée d'énergie électrique et thermique, où la concentration de SO2 peut atteindre 15 %. Les principales méthodes utilisées pour l'épuration du gaz contenant H2S et SO2 sont la sorption et le moyen catalytique. Dans le cas de l'utilisation du catalyseur, surtout le catalyseur solide, l'adsorption de H2S et SO2 constitue l'une des étapes importantes du processus.
L'adsorption de H2S et SO2 est réalisée avec un catalyseur d'oxydes d'aluminium. L'étude de l'influence d'additifs tels que les ions sodium et les ions sulfate a été abordée.
Les premiers catalyseurs du procédé de Claus étaient d'abord les bauxites naturelles [1–3]. Leur faible stabilité mécanique et leur composition variable ont favorisé la mise en place de catalyseurs à base d'oxydes d'aluminium. Le catalyseur d'oxydes d'aluminium existe sous plusieurs variétés. En France, il y a les marques DR, CR, CRS-21 (firme Rhône-Poulenc), aux USA : SP et S (firme Alcoa), au Japon : CRS-2 et CRS-7 (firme CCI), en Russie : A-1 (Académie du pétrole et du gaz de Moscou). Ces catalyseurs donnent un taux de conversion de H2S élevé [4–6]. La baisse de l'activité des catalyseurs d'oxyde d'aluminium a favorisé l'apparition d'un autre catalyseur de troisième génération, composé d'oxydes de titane [7]. Il est préparé par la firme Rhône-Poulenc et existe sous la marque CRS-31. Ce catalyseur est très actif dans la réaction de Claus, mais il perd facilement son activité dans les réactions d'hydrolyse de COS et CS2 et il n'a pas une longue expérience comme catalyseur d'oxydes d'aluminium [8,9]. Durant dix mois d'exploitation dans un appareil industriel, son activité devient plus mauvaise que celle d'oxydes d'aluminium après 35 mois d'exploitation [10]. Le catalyseur CRS-31 a un coût très élevé. En attendant l'avènement d'autres catalyseurs plus actifs et plus stables en présence d'oxygène, le catalyseur d'oxydes d'aluminium continuera à être utilisé dans la plupart des procédés de Claus. Malgré sa popularité, les informations concernant les propriétés et les particularités de ce catalyseur restent limitées [11–14]. Pour cette raison, nous avons essayé d'étudier les propriétés adsorbantes et l'activité catalytique dudit catalyseur, afin de donner un intérêt précis à l'étude de l'adsorption de H2S et SO2.
2 Matériels et méthodes
H2S est obtenu à l'aide de la réaction : . L'adsorption catalytique de H2S et SO2 est étudiée au laboratoire avec un réacteur en verre (5 mm de diamètre et 180 mm de long). Le réacteur est chargé de 0,1 à 0,2 cm3 de catalyseur. La dimension des granules varie entre 0,5 et 1,0 mm. L'analyse de la matière et des produits des réactions est faite avec un chromatographe de marque CHROM-5, muni d'un détecteur de conductibilité calorifique. L'intensité du courant dans le détecteur est de 80 mA. Deux colonnes chromatographiques ont été utilisées pour l'analyse. La première (2 m de long et 3 mm de diamètre), servant à l'analyse de H2S et SO2, est remplie de silicagel de marque ASKG (fraction 0,25–0,50 mm). La deuxième colonne (1 m de long et 3 mm de diamètre), utilisée pour l'analyse de l'oxygène, est en revanche remplie de zéolites CaX (fraction 0,25–0,50 mm). Le gaz vecteur est l'hélium. Les colonnes thermostatées à 60 °C ont chacune un débit de 1 l/h. La température du catarhomètre est de 100 °C. La sensibilité de l'analyse en composés sulfurés est de 0,01 mol %.
3 Résultats
L'étude est réalisée à l'aide d'un catalyseur d'oxyde d'aluminium dont la composition en % massique est : Al2O3 = 48,5; Na2O = 0,05 ; Fe2O3 = 0,2 et SO42- = 1,1. Le catalyseur obtenu présente une surface spécifique de 200 m2.g-1 et un volume poreux de 0,6 cm3.g-1. Il est préparé sous forme de granules de 4 à 5 mm de diamètre et de 6 à 7 mm de hauteur. Ce catalyseur est synthétisé selon la méthode décrite par Adjamov et al. [15 ].
L'adsorption de H2S et SO2 a été réalisée sous un régime d'impulsion à une température de 220 °C et a été appréciée par la quantité de H2S et SO2 obtenue à la sortie de mailles du catalyseur. Les résultats obtenus sont consignés dans le Tableau 1.
Quantité de H2S et SO2 (mol/m2) adsorbée par le catalyseur Al2O3 sans additif (pur). Vitesse volumique=12000 h–1 ;concentrations initiales, moles % :H2S = 4 ;SO2 = 2 et N = 94. Température = 220 °C
| Numéro de l'impulsion | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| H2S | 0,092 | 0,081 | 0,075 | 0,075 | 0,075 | 0,075 | 0,075 |
| SO2 | 0,22 | 0,22 | 0,22 | 0,14 | 0,076 | 0,076 | 0,076 |
Ce tableau montre que la plus grande quantité de H2S adsorbée l'est au cours des deux premières impulsions et se compose de 0,092 et 0,081 mol/m2. À partir de la troisième impulsion, la quantité de H2S adsorbée est constante et égale à 0,075 mol/m2. Dans les trois premières impulsions, la quantité de SO2 adsorbée est importante et se compose de 0,22 mol/m2. Dans la quatrième impulsion, la quantité de SO2 adsorbée diminue jusqu'à atteindre 0,14 mol/m2. Dès la cinquième impulsion, la quantité de SO2 adsorbée est constante et est de 0,076 mol/m2. La valeur constante de la quantité de H2S adsorbée est due au fait que, pendant l'intervalle de temps entre les impulsions, H2S se désorbe et libère la place où il était adsorbé. À l'impulsion suivante, à la place libérée, H2S est de nouveau adsorbé. Au vu des résultats obtenus, on peut dire que, dans les deux premières impulsions, il y a l'adsorption stable (irréversible) de H2S et que dans les impulsions suivantes il y a l'adsorption instable (réversible) de H2S. L'adsorption de SO2varie d'impulsion en impulsion, mais la quantité de SO2 adsorbée dans les premières impulsions est plus élevée que la quantité de H2S. Ainsi, au cours des trois premières impulsions, toute la quantité de SO2 introduite dans le flux d'hélium est adsorbée. À la quatrième impulsion, l'adsorption de SO2 est partielle. Dès la cinquième impulsion, la quantité de SO2 adsorbée est pratiquement constante. L'adsorption réversible de SO2 débute à la cinquième impulsion ; en même temps les quantités instables de H2S et SO2 adsorbées sont pratiquement identiques.
Le Tableau 2 donne les résultats de l'adsorption de H2S et SO2 par le catalyseur d'oxydes d'aluminium après une sulfatation préliminaire de 4 h. La sulfatation est réalisée en faisant passer à travers le catalyseur un mélange gazeux composé de 2 % SO2 + 10 % H2O + air. Comme dans le cas du catalyseur d'oxydes d'aluminium pur, l'adsorption stable de H2S intervient lors des deux premières impulsions. Dès la troisième impulsion, l'adsorption de H2S devient instable. Mais les quantités de H2S absorbées sur les catalyseurs Al2O3 pur et sulfaté sont voisines. En revanche, le caractère de l'adsorption de SO2 varie fortement, surtout dans les quatre premières impulsions. Pendant ce temps, la quantité de SO2 est de 0,049 mol/m2.
Quantité de H2S et SO2 (mol/m2) adsorbée par le catalyseur d'oxyde d'aluminium sulfaté. Vitesse volumique = 12000 h–1 ; concentrations initiales, mol % : H2S = 4, SO2 = 2 et N = 94. Température = 220 °C
| Numéro de l'impulsion | 1 | 2 | 3 | 4 | 5 | 6 |
| H2S | 0,11 | 0,11 | 0,083 | 0,083 | 0,083 | 0,083 |
| SO2 | 0,073 | 0,064 | 0,049 | 0,049 | 0,034 | 0,034 |
La quantité de l'adsorption instable de SO2 diminue. Avec le catalyseur d'oxyde d'aluminium sans additif, elle est de 0,076 mol/m2, mais avec le catalyseur sulfaté, cette quantité est égale à 0,034 mol/m2. Les données obtenues montrent que la sulfatation artificielle du catalyseur d'oxyde d'aluminium affaiblit l'adsorption de SO2. Les Tableaux 3 et 4 donnent les résultats de l'adsorption de H2S et de SO2 par le catalyseur d'oxydes d'aluminium additionné de différentes quantités d'ions sodium. L'introduction dans l'oxyde d'aluminium de 5 % d'ions sodium (5 % Na+) entraîne quelques variations, tant pour l'adsorption stable que pour l'adsorption instable. La quantité de l'adsorption instable de H2S à la quatrième impulsion varie de 0,075 à 0,04 mol/m2 (Tableau 3). En introduisant 1 % Na+ dans le catalyseur, la quantité de SO2 adsorbée à la quatrième impulsion diminue de 0,14 à 0,12 mol/m2 (Tableau 4).
Quantité de H2S (mol/m2) adsorbée par le catalyseur d'oxyde d'aluminium additionné d'ions sodium. Vitesse volumique = 12 000 h–1 ; Température = 220 °C
| Catalyseurs | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| Al2O3 (pur) | 0,092 | 0,081 | 0,075 | 0,075 | 0,075 | 0,075 | 0,075 |
| Al2O3 + 1 % Na+ | 0,059 | 0,043 | 0,043 | 0,04 | 0,04 | 0,04 | 0,04 |
| Al2O3 + 5 % Na+ | 0,066 | 0,053 | 0,04 | 0,04 | 0,04 | 0,04 | 0,04 |
Quantité de SO2 (mol/m2) adsorbée avec le catalyseur d'oxyde d'aluminium additionné d'ions sodium. Vitesse volumique = 12 000 h–1 ; Température = 220 °C
| Catalyseur | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| Al2O3 (pur) | 0,22 | 0,22 | 0,22 | 0,14 | 0,076 | 0,076 | 0,076 |
| Al2O3 + 1 % Na+ | 0,15 | 0,15 | 0,15 | 0,12 | 0,76 | 0,046 | 0,046 |
| Al2O3 + 5 % Na+ | 0,18 | 0,084 | 0,084 | 0,084 | 0,073 | 0,073 | 0,073 |
L'augmentation de 5 % de la concentration des ions sodium dans le catalyseur modifie complètement le résultat. À la quatrième impulsion, la quantité de l'adsorption stable de SO2 diminue de 0,14 à 0,084 mol/m2. En revanche, dès la cinquième impulsion, la quantité d'adsorption instable de SO2 passe de 0,076 à 0,073 mol/m2. La sulfatation du catalyseur d'oxydes d'aluminium additionné de sodium entraîne une variation non significative de l'adsorption stable et instable de H2S (Tableau 5).
Quantité de H2S et SO2 adsorbée par le catalyseur d'oxyde d'aluminium additionné de 1 % Na+ après sulfatation artificielle. Vitesse volumique = 12 000 h–1 ; concentrations initiales, mol % : H2S = 4, SO2 = 2 et N = 94. Température = 220 °C
| Numéro de l'impulsion | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| H2S | 0,072 | 0,054 | 0,054 | 0,049 | 0,049 | 0,049 | 0,049 |
| SO2 | 0,083 | 0,059 | 0,036 | 0,036 | 0,036 | 0,036 | 0,036 |
Avec le catalyseur d'oxyde d'aluminium pur, l'adsorption stable (irréversible) survient au cours des quatre premières impulsions, alors qu'avec le catalyseur sulfaté, elle se passe dans les deux premières impulsions et la quantité de SO2 dans la deuxième impulsion diminue de 0,22 à 0,059 mol/m2. L'adsorption instable (réversible) de SO2 diminue également de 0,076 à 0,036 mol/m2. Les échantillons contenant une grande quantité d'ions sodium sont sulfatés rapidement et perdent facilement leur activité, bien qu'au début, le catalyseur sans additif et celui contenant le sodium sont pratiquement identiques. La sulfatation artificielle influence très fortement l'adsorption de H2S par le catalyseur d'oxydes d'aluminium additionné du sulfate d'aluminium (Tableau 6).
Quantité de H2S (mol/m2) adsorbée par les échantillons de catalyseurs d'oxyde d'aluminium sulfaté. Vitesse volumique = 12 000 h–1 ; Température = 220 °C
| Échantillons de catalyseurs | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| Al2O3 (pur) | 0,092 | 0,081 | 0,075 | 0,075 | 0,075 | 0,075 | 0,075 |
| Al2O3 + 1 % SO42– | 0,14 | 0,10 | 0,083 | 0,081 | 0,081 | 0,081 | 0,081 |
| 0,044 | 0,044 | 0,031 | 0,017 | 0,017 | 0,017 | 0,017 |
| Al2O3 + 10 SO42– | 0,049 | 0,037 | 0,024 | 0,022 | 0,020 | 0,020 | 0,020 |
La capacité d'adsorption de l'oxyde d'aluminium dépend fortement de la quantité d'ions sulfate dans le catalyseur. En introduisant 1 % Al2(SO4)3, les adsorptions stable et instable augmentent. À la deuxième impulsion, la quantité de l'adsorption stable de H2S augmente de 0,081 à 0,10 mol/m2 et celle de la quantité instable de 0,075 à 0,081 mol/m2 (quatrième impulsion). La sulfatation artificielle de l'oxyde d'aluminium contenant 1 % SO42– provoque une grande influence sur l'adsorption de H2S. Avec la première impulsion, la quantité de l'adsorption stable de H2S diminue de 0,092 à 0,044 mol/m2 et celle de l'adsorption instable de 0,075 à 0,017 mol/m2 (quatrième impulsion). La diminution du taux d'adsorption de H2S est observée, non seulement avec l'échantillon fraîchement sulfaté, mais aussi avec le catalyseur Al2O3 pur. L'introduction de 10 % de SO42– dans l'oxyde d'aluminium diminue brusquement sa capacité d'adsorption par rapport à H2S. Les quantités d'adsorption stable et instable de H2S diminuent presque à environ deux à trois fois.
Un résultat intéressant est obtenu en étudiant l'influence de la sulfatation du catalyseur en fonction de son caractère d'adsorption (Tableau 7).
Quantité de SO2 (mol/m2) adsorbée par les échantillons de catalyseurs d'oxydes d'aluminium sulfatés. Vitesse volumique = 12 000 h–1 ; Température = 220 °C
| Échantillons de catalyseurs | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| Al2O3 | 0,22 | 0,22 | 0,22 | 0,14 | 0,075 | 0,076 | 0,076 |
| Al2O3 + 1 % SO42– | 0,22 | 0,22 | 0,22 | 0,14 | 0,12 | 0,10 | 0,10 |
| 0,06 | 0,052 | 0,045 | 0,045 | 0,045 | 0,045 | 0,045 |
| Al2O3 +10 % SO42– | 0,013 | 0,009 | 0,007 | 0,007 | 0,007 | 0,007 | 0,007 |
L'introduction de 1 % de SO42– n'influence pas l'adsorption stable de SO2, mais en revanche augmente quelque peu la quantité de l'adsorption instable de SO2. Après sulfatation artificielle de cet échantillon, les adsorptions stable et instable de SO2 diminuent de 0,22 à 0,06 mol/m2 pour l'adsorption stable (première impulsion) et de 0,076 à 0,045 mol/m2 pour l'adsorption instable (sixième impulsion). L'augmentation de 1 à 10 % de la concentration d'ions sulfate dans le catalyseur entraîne une diminution brusque de la capacité d'adsorption de l'oxyde d'aluminium. Dès la troisième impulsion, où existe l'adsorption instable de SO2, la quantité de SO2 adsorbée diminue de 0,22 à 0,007 mol/m2 avec Al2O3 pur et additionné de 1 % de SO42–.
La comparaison de la capacité d'adsorption des échantillons de catalyseurs frais (purs) avec les échantillons sulfatés artificiellement montre que l'adsorption stable de H2S par l'échantillon d'oxyde d'aluminium sulfaté est supérieure à celle de l'oxyde d'aluminium pur. En revanche, l'adsorption stable de SO2 par l'échantillon sulfaté diminue (Fig. 1).
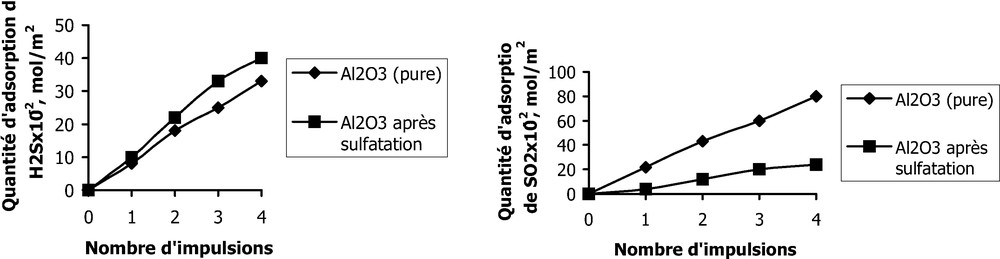
Adsorption de H2S et SO2 par Al2O3 sans additif (pur) et après sulfatation à T = 220 °C.
Les Figs. 2 et 3 montrent l'adsorption de H2S et SO2 par les échantillons de catalyseurs d'oxydes d'aluminium purs et additionnés d'ions sodium et d'ions sulfate après sulfatation artificielle.
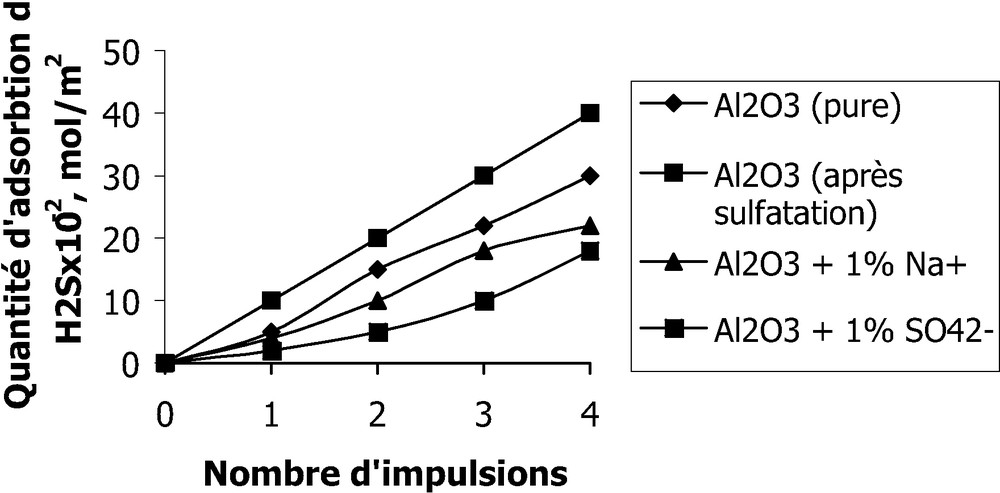
Adsorption de H2S par les échantillons de catalyseurs d'oxyde d'aluminium purs et additionnés d'ions sodium et sulfate après sulfatation artificielle.

Adsorption de SO2 par les échantillons de catalyseurs d'oxyde d'aluminium purs et additionnés d'ions sodium et sulfate après sulfatation artificielle.
Comme on peut le constater, l'adsorption de H2S par ces catalyseurs, après sulfatation, diminue. Mais tous les échantillons d'oxydes d'aluminium, après sulfatation artificielle, possèdent la même capacité d'adsorption pour le dioxyde de soufre. La vitesse de la réaction d'adsorption est définie principalement par l'adsorption de SO2, bien que, dans le processus, les deux éléments H2S et SO2 se trouvent en même temps à la surface du catalyseur.
4 Discussion et conclusion
Bien que le procédé Claus soit largement utilisé dans les industries et décrit dans plusieurs publications scientifiques, la cinétique et le mécanisme de ce procédé restent encore faiblement étudiés et beaucoup de questions concernant la nature et le caractère de l'interaction de H2S avec SO2 demeurent partiellement résolues.
Les résultats de la présente étude montrent que la surface du catalyseur d'oxyde d'aluminium n'est pas homogène. La non-homogénéité de la surface du catalyseur en SO2 est supérieure à la non-homogénéité en H2S. La quantité de l'adsorption stable (irréversible) de H2S dans les deux premières impulsions est de 0,081 mol/m2 alors que la quantité de l'adsorption instable (réversible) de H2S dans les dernières impulsions est de 0,075 mol/m2.
La quantité de H2S absorbée réversiblement est désorbée rapidement de la surface du catalyseur. La désorption se passe à la même température que l'adsorption. On peut supposer que la forme de H2S adsorbée représente l'adsorption molaire de H2S. Le résultat obtenu pour l'adsorption de H2S est compatible avec les résultats de la littérature [16–18] correspondant à la chaleur d'adsorption de H2S, qui varie de 160 à 100 kJ/mol. La quantité d'adsorption stable de SO2 est plus grande que celle de H2S. La quantité d'adsorption stable de SO2 de la troisième impulsion est de 0,22 mol/m2, alors que celle de l'adsorption stable de H2S est de 0,075 mol/m2 lors de la même impulsion. Les valeurs de l'adsorption instable de H2S et SO2 sont sensiblement identiques et sont en accord avec la chaleur d'adsorption de H2S et SO2 par le catalyseur d'oxyde d'aluminium. Le résultat obtenu pour l'adsorption de SO2 est en parfait accord avec les résultats de la littérature [19–21] correspondant à la chaleur d'adsorption de SO2, qui varie de 350 à 65 kJ/mol lorsque celle-ci est saturée. Les différentes valeurs de la chaleur d'adsorption sont dues sans doute aux différentes formes d'adsorption de SO2 à la surface du catalyseur. La différence entre les valeurs concernant les adsorptions stable et instable de H2S et SO2 est en accord avec les différentes chaleurs d'adsorption. Pour le cas présent, la quantité de l'adsorption stable de SO2 est plus grande que la quantité de l'adsorption stable de H2S, car la surface du catalyseur d'oxyde d'aluminium adsorbe une grande quantité de SO2. L'adsorption instable de SO2 est un dioxyde de soufre adsorbé sous forme moléculaire. L'élimination du SO2 adsorbé de manière instable survient à 100 °C par désorption rapide de la surface du catalyseur.
En comparant les propriétés d'adsorption catalytique du catalyseur d'oxyde d'aluminium (Al2O3) pur avec celles du catalyseur d'oxyde d'aluminium (Al2O3) augmenté de différents additifs, on peut dire que l'activité catalytique de Al2O3 ne varie pas. Il en résulte que toutes les formes de H2S et SO2 adsorbées ne prennent pas part à la catalyse. Une partie de ces formes adsorbées n'est pas active. Ceci témoigne de la non-homogénéité de la surface du catalyseur par rapport aux différentes formes d'adsorption de H2S et SO2.
En considérant les données de la littérature et les résultats obtenus au terme de la présente étude, on peut dire qu'après la sulfatation artificielle l'activité catalytique du catalyseur d'oxyde d'aluminium diminue.
Les résultats obtenus permettent de conclure que la vitesse de la réaction d'adsorption est définie principalement par l'adsorption de SO2, bien que, dans le processus, H2S et SO2 se trouvent en même temps à la surface du catalyseur.
Les quantités de l'adsorption instable de H2S et SO2 sont pratiquement identiques. En revanche, la quantité de l'adsorption stable de SO2 dépasse celle de H2S. L'introduction de 1 % Na+ dans le catalyseur diminue l'adsorption de H2S et SO2, mais n'influe pas sur le début de l'activité du catalyseur dans la réaction de Claus.
L'addition de 1 % d'ions sulfate sous forme de Al2(SO4)3 et H2SO4 dans le catalyseur n'influence, ni sur l'adsorption de H2S et SO2, ni sur l'activité catalytique du catalyseur d'oxyde d'aluminium. L'introduction de 10 % d'ions sulfate entraîne la diminution de l'adsorption de H2S et de SO2 ainsi que de l'activité catalytique de Al2O3 dans la réaction de Claus.


