1 Introduction
Les dix dernières années ont vu la découverte [1] et le développement d'un nouveau type de matériau à base de silice, dont la porosité est contrôlée à une échelle mésoscopique. L'exploitation des ressources de la chimie sol–gel et des propriétés d'autoassemblage des tensioactifs en solution aqueuse permettent, selon la nature cationique, anionique ou non ionique des agents structurants employés, la structuration d'une charpente minérale autour d'une phase micellaire de tensioactifs. Ce sujet a fait l'objet de plusieurs revues récentes [2].
L'intérêt croissant envers les matériaux mésoporeux trouve ses motivations dans la possibilité de contrôler un certain nombre de leurs caractéristiques nanométriques (taille des pores, géométrie de la phase micellaire, taille des particules, etc.) à partir de paramètres expérimentaux tels que le choix du précurseur inorganique, la nature du tensioactif, le pH de la solution, la température, la nature des co-solvants, etc. La propriété essentielle de ces matériaux, une fois le tensioactif éliminé, est sa grande surface spécifique (~ 1000 m2/g) permettant d'envisager des applications par exemple, en catalyse [3–5], chromatographie [6], relargage contrôlé de médicaments [7]. Le matériau final peut se présenter sous différentes formes : des poudres [8] peuvent être obtenues par précipitation en milieu aqueux, alors que des couches minces [9] peuvent être préparées par des procédés de dip ou de spin coating [10].
L'équipe de recherche de Mobil a réalisé la synthèse de la première série de matériaux nommée MCM [1] (Mobil Composition of Matter), dont le protocole implique l'utilisation d'un tensioactif cationique, le bromure de cétyltriméthylammonium (CTAB), en milieu basique et en présence d'un alcoxyde de silicium (TEOS : Si(OEt)4 ou TMOS : Si(OMe)4). L'arrangement des micelles dans l'espace varie en fonction de la concentration de CTAB en solution : une phase lamellaire (MCM-50), hexagonale bidimensionnelle P6m (MCM-41) ou cubique bicontinue Ia3d (MCM-48) ont été mises en évidence à l'aide de la technique de diffraction des rayons X aux petits angles (1,5° < 2 θ < 10°).
En 1994, Huo et al. [11] ont montré la faisabilité d'une synthèse en milieu acide avec le même tensioactif : la mésophase obtenue, appelée SBA-3, est encore une fois de symétrie hexagonale bidimensionnelle. Ensuite, un nombre croissant de tensioactifs cationiques avec des caractéristiques géométriques différentes ont été utilisés afin d'obtenir des empilements micellaires plus complexes. Les matériaux SBA-1 (cubique, groupe d'espace Pm3n) [12,13] et SBA-2 (hexagonale tridimensionnelle, groupe d'espace P63/mmc) [12,14] ont été alors obtenus.
De façon assez surprenante pour ce type de synthèse, le tensioactif semble conduire au même type d'autoassemblage en solution, sans ou en présence du précurseur inorganique : les mésophases existantes en milieu aqueux sont identiques aux phases trouvées pour la série des matériaux de type MCM [15–17]. Pourtant, si l'on considère le cas des matériaux MCM-41 et SBA-3, même si la mesophase finale est la même (hexagonale ; P6m), les voies de synthèse diffèrent, et laissent penser que les interactions de nature électrostatique entre le tensioactif et les oligomères siliciques générés en solution par hydrolyse–condensation du précurseur ne sont pas les mêmes. En milieu basique [1], on considère une interaction directe S+I– entre le tensioactif positivement chargé (S+) et la silice négativement chargée (I–). En milieu acide, l'interaction semble se faire par le biais du contre-ion (X–) provenant de l'acide employé et dont la présence a été démontrée par analyse élémentaire. L'interaction serait du type S0X–I+, où la compensation de charge la plus importante se fait entre le contre-ion et le tensioactif, la charge de la charpente ne jouant qu'un rôle marginal [11,18]. Des modèles, qui n'ont pas vraiment été validés par des données expérimentales, ont été proposés pour refléter les différences d'interaction pour les deux modes de synthèse et sont représentés sur la Fig. 1.
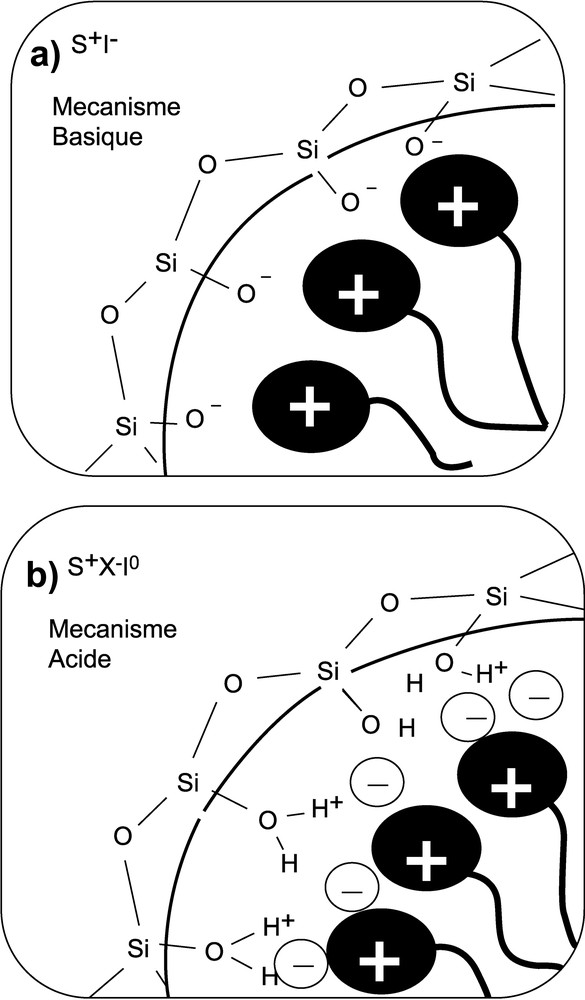
Modèle des interactions à l'interface tensioactif/silice proposé pour une synthèse en milieu basique (haut) et en milieu acide (bas) [11].
Le but de cette étude est de voir si la RMN à l'état solide peut nous permettre d'avancer dans la description des interfaces tensioactif/charpente silicique de ces matériaux mésostructurés. Pour ce faire, des expériences bidimensionnelles de corrélation hétéronucléaire (HETCOR) 29Si–1H ont été réalisées [19]. Elles sont fondées sur la séquence de polarisation croisée et mettent donc en jeu l'interaction dipolaire hétéronucléaire 29Si–1H à travers l'espace. Elles sont donc particulièrement bien adaptées au problème posé. L'équipe de B. Chmelka [10,20–22] a d'ailleurs déjà utilisé cette technique pour caractériser des aluminosilicates structurés en présence de CTAB, et en particulier des expériences HETCOR 27Al-1H pour localiser les atomes d'aluminium par rapport aux molécules de tensioactif. L'exemple traité ici est la comparaison entre les silices de type MCM-41 et SBA-3 préparées respectivement en milieu basique et acide.
2 Méthodes expérimentales
2.1 Synthèse des matériaux
Le matériau MCM-41 est préparé en suivant un protocole standard qui consiste à dissoudre 0,15 g de CTAB (C16H33N+(CH3)3 Br– ; Aldrich) dans une solution aqueuse à pH = 13,3 en utilisant NaOH comme base. La solution est laissée sous agitation le temps nécessaire pour la dissolution du tensioactif. 0,72 g de TEOS (tétraéthoxysilane ; Fluka) sont ajoutés au mélange précédent sous agitation. Le rapport molaire final est TEOS1:CTAB 0,12:NaOH 0,5:H2O 120. La solution est laissée sous agitation (~ 500 tpm) pendant trois heures, puis filtrée et séchée pendant une journée à l'air. Elle est ensuite mise à l'étuve à 100 °C pendant une nuit.
La synthèse du SBA-3 suit les mêmes étapes. Typiquement, 0,10 g de CTAB est dissous dans une solution aqueuse acide composée de 0,12 g d'eau et 6,27 g d'une solution de HCl à 12,63 % en masse (4 mol l−1). Le mélange est laissé sous agitation quelques minutes avant l'ajout de 0,50 g de TEOS. Le rapport molaire final en solution est TEOS 1:CTAB 0,12:HCl 9,2 : H2O 130. Le procédé de filtrage et la double étape de séchage sont les mêmes que dans le cas de la MCM-41.
2.2 Spectroscopie RMN
Les spectres RMN MAS 1H ont été enregistrés sur un spectromètre BRUKER AVANCE 300 (7,05 T). Une sonde Bruker CP-MAS a été utilisée avec des rotors en zircone de 4 mm tournant à 14 kHz. Seize acquisitions ont été réalisées avec une impulsion de 4,40 μs (θ = 90°) et un délai de recyclage de 2s. Les spectres RMN MAS 29Si ont été enregistrés sur un spectromètre BRUKER AVANCE 400 (9,40 T). Des rotors en zircone de 7 mm tournant à 5 kHz ont été utilisés. Trois cent vingt-quatre acquisitions ont été effectuées avec une impulsion de 6,5 μs (θ = 90°) et des délais de recyclage de 200 s (SBA-3) et 500 s (MCM-41). Ces dernières valeurs ont été choisies compte tenu des données de la littérature [18,23]. La simulation des spectres a été réalisé avec le logiciel DMFIT2004 [24]. La référence de déplacement chimique pour les expériences RMN 1H et 29Si est le tétraméthylsilane (TMS ; δ = 0 ppm)
Les expériences de corrélation hétéronucléaire 2D HETCOR 29Si{1H} ont été enregistrées sur un spectromètre BRUKER AVANCE 300 (7,05 T) en utilisant des rotors en zircone de 4 mm tournant à 14 kHz. La séquence utilisée est une version à deux dimensions de la séquence de polarisation croisée (CP). La condition de Hartmann–Hahn entre le 1H et le 29Si a été obtenue en utilisant pendant le transfert une impulsion d'amplitude constante sur la voie proton et une impulsion d'amplitude variable sur la voie 29Si. L'acquisition a été réalisée selon la méthode STATES. Le délai de recyclage est de 3 s et la durée d'impulsion de 4 μs (θ = 90°). Toutes les expériences ont été réalisées avec découplage 1H durant l'acquisition. Le nombre d'acquisitions, NS, le nombre de tranches acquises dans la deuxième dimension, TD1, et le temps de contact sont indiqués dans la légende des figures.
3 Résultats expérimentaux
Tous les spectres ont été réalisés sur des poudres mises à l'étuve à 100 °C pendant plusieurs heures, cela afin de minimiser la teneur en eau dans les matériaux. Les spectres RMN-MAS 1H (Fig. 2b) montrent trois pics principaux à δiso = 0,9 ppm, 1,3 ppm et 3,3 ppm, respectivement attribués, d'après la littérature, aux protons CH3 du bout de chaîne, CH2 de la chaîne (sauf CH2 en position α) et CH3 de la tête polaire (avec CH2 en position α) [25–27]. Deux pics supplémentaires, de faible intensité, sont visibles autour de 4,5 ppm pour SBA-3 et 6,0 ppm pour MCM-41, dont nous discuterons l'attribution plus tard.
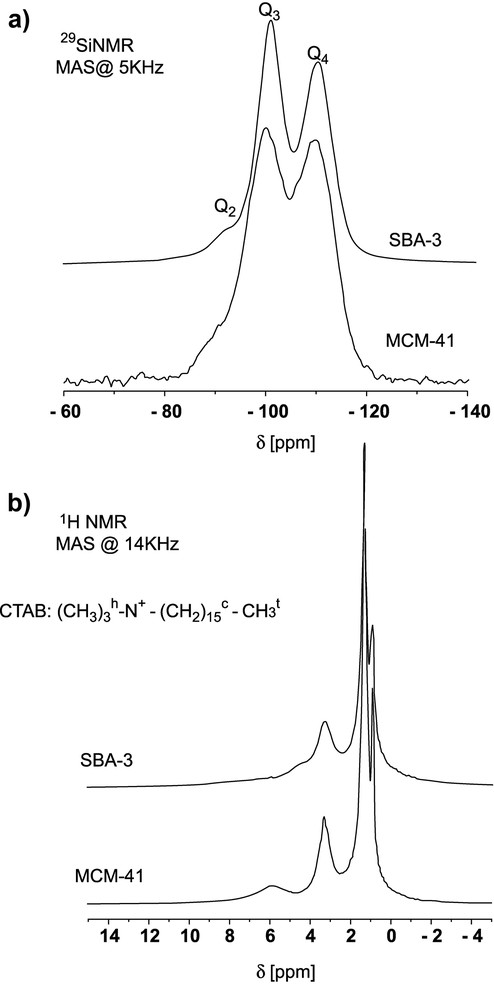
Spectres RMN-MAS 29Si (a) et 1H (b) de SBA-3 et MCM-41.
Les spectres RMN-MAS 29Si sont présentés sur la Fig. 2a et les valeurs de déplacement chimique correspondants sont résumés dans le Tableau 1. Les valeurs de δ sont caractéristiques [23,28,29] des trois espèces de Si présents dans une matrice de silice : Q4 = SiO2, Q3 = SiO1,5Ot, Q2 = SiO(Ot)2 (Ot : oxygène non pontant); les pourcentages de chaque espèce montrent qu'en milieu basique (MCM-41), le réseau est plus condensé (SBA-3) qu'en milieu acide, résultat bien connu en synthèse sol–gel [30]. Les spectres RMN-MAS 1H et 29Si à une dimension permettent donc d'identifier, sans problème de résolution, les sites présents dans le système hybride matrice silicique/tensioactif. Des expériences de corrélation hétéronucléaire ont alors été réalisées afin de mettre en évidence les proximités spatiales entre sites 1H et 29Si.
Déplacements chimiques et pourcentage des espèces Qx pour les deux matériaux SBA-3 et MCM-41 extraits des simulations des spectres RMN-MAS 29Si
| SBA-3 | MCM-41 | |
| Q4 [ppm] | –110,4 | –109,3 |
| %Q4 | 41 | 46 |
| Q3 [ppm] | –100,9 | –99,1 |
| %Q3 | 56 | 46 |
| Q2 [ppm] | –91,6 | –89,83 |
| %Q2 | 3 | 8 |
La Fig. 3 présente les cartes bidimensionnelles correspondant aux expériences d'HETCOR enregistrées pour des temps de contact (tCP) de 500 μs et 5 ms. Un temps de contact de 5 ms est classique dans les expériences de CP 29Si{1H}, mais il n'est pas sélectif vis-à-vis des premiers voisins du site observé ; un temps de contact de 500 μs est préférable pour sonder des proximités spatiales directes, mais cela se fera au détriment du rapport signal/bruit.
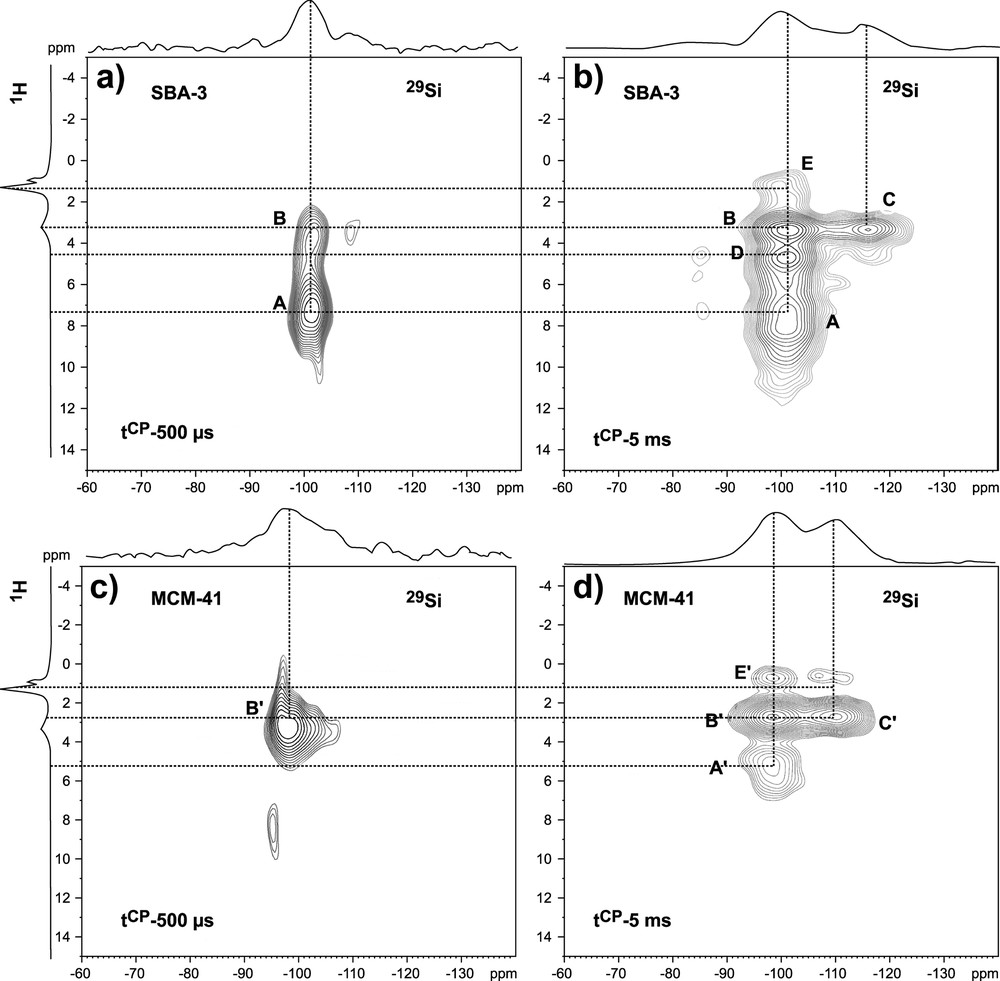
Cartes bidimensionnelles d'hétérocorrélation 29Si{1H}. Les paramètres expérimentaux employés sont : (a) SBA-3 : NS = 800, TD1 = 94, tCP = 500 μs ; (b) SBA-3 : NS = 904, TD1 = 32, tCP = 5 ms ; (c) MCM-41 : NS = 2144, TD1 = 32, tCP = 500 μs ; (d) MCM-41 : NS = 904, TD1 = 64, tCP = 5 ms. Les spectres projetés en haut et à gauche des cartes sont, respectivement, la somme des tranches sur la voie 29Si et les spectres RMN-MAS 1H acquis en simple impulsion. La base des niveaux de coupe a été choisie, pour les cartes (b) et (d), à 15% de l'intensité maximale, pour la carte (a), à 35% et pour la (c), à 50%. Le choix a été fait en fonction d'un rapport signal sur bruit optimal et comparable dans les deux dimensions.
3.1 Échantillon SBA-3
L'expérience réalisée avec tCP = 500 μs est présentée sur la Fig. 3a. Le spectre RMN 29Si obtenu par projection sur la dimension F2 montre bien qu'à ce court temps de contact seuls les sites Q3 sont détectés. De manière très intéressante, la principale tache A correspond à une corrélation entre ces sites Q3 (δ = –100,9 ppm) et des protons dont le déplacement chimique est à 7,2 ppm, et attribué aux protons de type Si–OH. Il est à remarquer que ce pic n'est pas clairement visible dans le spectre RMN 1H de la Fig. 2b, montrant l'extrême pouvoir de sélectivité de la séquence de CP à faible tCP. Une tache (B) corrèle aussi les sites Q3 avec les protons des groupes CH3 de la tête polaire. Sa plus faible intensité s'explique par une plus grande distance Si–H, ainsi que par une mobilité plus grande des groupes méthyles, deux facteurs amoindrissant le couplage dipolaire hétéronucléaire.
L'expérience a été renouvelée avec tCP = 5 ms. Dans ce cas, le spectre RMN 29Si obtenu par projection montre, non seulement le pic dû aux sites Q3, mais également le pic dû aux sites Q4, et avec une plus faible intensité, le pic dû aux sites Q2, qui sont très minoritaires dans l'échantillon (Tableau 1). L'analyse de la carte (Fig. 3b) montre maintenant la présence de quatre taches de corrélation principales. On retrouve les deux taches précédentes A et B, mais maintenant les protons de la tête polaire présentent également une corrélation avec les sites Q4 (Tache C). En revanche, nous n'observons pas de corrélation entre groupe Si–OH et sites Q4. Une nouvelle tache est présente (tache D) et corrèle les sites Q3 à des protons de déplacement chimique, δ = 4,6 ppm. Cette valeur pourrait correspondre à la présence de molécules d'eau, adsorbées sur des groupes Si–OH, mais dont la grande mobilité n'a pas permis la détection à faible tCP. Finalement, il existe une tache (E) correspondant à une interaction entre les groupes CH2 de la chaîne et les sites Q3, mais de très faible intensité. Il existe donc un transfert d'aimantation sélectif entre les sites Q3 et Q4 des parois siliciques et les protons de la tête polaire du tensioactif.
3.2 Échantillon MCM-41
L'expérience réalisée avec tCP = 500 μs est présentée sur la Fig. 3c. Le faible rapport signal/bruit du spectre RMN 29Si obtenu par projection, comparé au cas de l'échantillon précédent, suggère que le nombre de protons actifs dans le transfert d'aimantation est moins important. En fait, la carte présente essentiellement une tache (B) qui corrèle les sites Q3 (δ = –99,1 ppm) et les protons des groupes méthyles de la tête polaire (δ = 3,3 ppm). Contrairement au cas précédent, il n'apparaît donc pas de manière nette de tache pouvant correspondre à la corrélation de sites Q3 avec des protons de type Si–OH. Cela suggère que le site terminal des sites Q3 n'est pas de type silanol, mais sans doute plutôt de type silicate Si–O–, en accord avec le pH de synthèse du matériau.
Pour tCP = 5 ms (Fig. 3d), la tache B est toujours la plus intense, mais apparaît maintenant une tache A qui corrèle les sites Q3 à des protons dont le déplacement chimique est à 5,7 ppm. La non-détection de cette tache de corrélation à faible tCP suggère que l'on est en présence de protons présentant une certaine mobilité, comme par exemple des protons en échange rapide entre des groupes OH et de l'eau de surface. Des résultats similaires concernant ce type de comportement ont été déjà montrés dans la littérature [31]. Les protons de la tête polaire corrèlent également avec les sites Q4 (δ = –109,3 ppm) (Tache C). De plus, tout comme dans le cas de l'échantillon SBA-3, existe une faible tache de corrélation E entre les sites Q3 et des protons de la chaîne du tensioactif (δ = 1,3 ppm).
La Fig. 4 montre la comparaison entre le spectre RMN-MAS 1H, enregistré en simple impulsion, des matériaux SBA-3 et MCM-41 et les spectres RMN 1H obtenus à partir des cartes HETCOR, par projection selon la dimension F1. On met clairement en évidence l'effet de filtre qui résulte de l'expérience de polarisation croisée 1H → 29Si : le pic très intense dû aux protons de la chaîne du tensioactif n'est que très faiblement apparent, ce qui permet de mettre clairement en évidence les protons liés à la tête polaire (N–CH3 et N–CH2), et surtout les protons de type OH. Ceux-ci, en faible quantité, sont difficilement visibles dans le spectre enregistré en simple impulsion.

Spectres RMN-MAS 1H (@14kHz) et projections 1H extraites des cartes HETCOR pour SBA-3 (a) et MCM-41 (b).
4 Discussion
Les expériences d'HETCOR 1H → 29Si montrent clairement des réponses différentes pour les échantillons SBA-3 et MCM-41 :
- • à faible temps de contact (tCP = 500 μs), l'expérience est sensible aux premiers voisins des sites Q3. Dans le cas de SBA-3 sont détectés majoritairement des sites Si–OH. La valeur de déplacement chimique élevée (δ = 7,2 ppm) suggère une forte acidité de ces protons [32] que l'on pourrait écrire Si–OH2+. L'existence de tels groupes est en parfait accord avec les conditions de synthèse fortement acides utilisées dans la synthèse de SBA-3. Une corrélation existe également entre ces sites Q3 et les protons de la tête polaire, démontrant l'existence d'une proximité entre ces groupes, via l'intermédiaire d'un anion, dont la présence est démontrée par analyse élémentaire. Ces observations sont cohérentes avec le modèle de la Fig. 1b. Au contraire, dans le cas de MCM-41, comme il a déjà été mentionné, l'absence de corrélation entre sites Q3 et protons de type OH suggère que la majorité des sites Q3 sont de type Si–O–, en accord avec les conditions très basiques de la synthèse. Ces sites Q3 sont donc en interaction forte avec les protons de la tête polaire, comme l'atteste la seule corrélation mise en évidence clairement dans la carte HETCOR. On ne peut néanmoins pas exclure totalement la présence d'une minorité de sites Si–OH [33] qui apparaissent à tCP plus élevé à un déplacement chimique moins élevé que précédemment (δ = 5,7 ppm) ;
- • à plus fort temps de contact (tCP = 5 ms), les réponses des deux systèmes ne sont pas très différentes. Les protons de la tête polaire se corrèlent, non seulement avec les sites Q3, mais également avec les sites Q4 surtout dans le cas de MCM-41. Cette différence entre les deux échantillons est encore en accord avec une distance plus courte entre la tête polaire chargée du tensioactif et la paroi silicique. Une tache de corrélation supplémentaire existe aussi dans l'échantillon SBA-3, qui semble être due à la présence de molécules d'eau.
5 Conclusion
Cette étude met en évidence toute la pertinence des expériences bidimensionnelles de corrélation hétéronucléaire 1H → 29Si pour décrire de manière fine les interactions existant entre molécules de tensioactif et réseau silicique dans les matériaux mésostructurés. Tout d'abord, l'expérience de polarisation croisée agit comme un filtre vis-à-vis des protons fortement couplés via l'interaction dipolaire à travers l'espace, aux différents sites 29Si. On s'affranchit ainsi du signal intense dû aux protons de la chaîne de tensioactif, et on met clairement en évidence les protons présents à l'interface tensioactif/réseau silicique.
Cela nous a permis de valider les modèles d'interaction proposés. Dans le cas d'une silice MCM-41 synthétisée en milieu basique, existe une interaction forte entre la tête polaire chargée et les sites Q3, porteurs de groupes Si–O–, alors que dans le cas d'une silice SBA-3 synthétisée en milieu acide, les protons de la tête polaire sont voisins des sites Q3 porteurs de groupe Si–OH, voire Si–OH2+, et interagissent via un anion.


