1 Introduction
Quelle chimie organique demain ? Quel futur pour la chimie organique en tant que science ? Où sont les prochaines révolutions ? Existe-t-il un « Graal » pour les chimistes organiciens ?
L'acte fondateur qui a donné naissance à la première édition des entretiens de synthèse organique et de prospective (ESYOP) a été la volonté de rechercher une réponse collective à ces interrogations fondamentales. La question du futur est à la fois fascinante, paradoxale et stratégique. Fascinante, car elle correspond à un besoin essentiel de la pensée qui cherche en permanence à définir un futur [1]. Paradoxale, car quelle que soit la qualité de la réflexion et des efforts mis en jeu, cette recherche est vaine, le futur n'étant pas discernable. Pourtant, chercher à déterminer le futur est une démarche stratégique vitale. Car prédire, c'est agir et se définir. Dans le cas de la chimie organique, la question du futur est d'autant plus stratégique que cette discipline occupe une situation centrale à l'interface de la physique, de la biologie et de la médecine. Identifier des rêves ou des buts à atteindre est essentiel si l'on cherche à définir l'identité de la chimie organique, discipline caméléon par excellence, à la fois science, art et industrie [2]. Cette démarche prospective présente donc un intérêt scientifique majeur, mais peut également contribuer à mieux communiquer sur la chimie et ses enjeux auprès des étudiants et du grand public. L'objectif de la première édition d'ESYOP était de rassembler sur trois jours une trentaine de jeunes chimistes organiciens dans un cadre favorisant les échanges afin de générer un regard multiple sur le futur. Les éléments de réponse présentés dans cet article ont été élaborés en cherchant à se projeter à l'horizon 2035, soit un saut de 30 ans dans le futur, l'équivalent d'une génération. Les défis qui ont émergé constituent l'instantané d'une réflexion conduite sur la base d'échanges d'opinions et d'expertises diverses par un groupe de chimistes rassemblés par une même envie d'imaginer le futur de leur discipline. Ces défis sont évidemment critiquables, en aucun cas exhaustifs, et ont pour objectif de susciter le débat. Comme le souligne l'historien G. Minois : « Ce n'est pas la réalisation de la prédiction qui compte, mais l'action qu'elle va provoquer » [3].
2 Matériel et méthodes
2.1 Réactifs
La première édition d'ESYOP était centrée sur les chercheurs de la génération 30–39 ans qui présentent à la fois l'avantage d'avoir acquis une expérience solide de la recherche tout en étant au début de leur carrière, compromis intéressant entre expérience et jeunesse. L'objectif était que les réponses apportées à la question initiale « Quelle chimie organique demain ? » portent l'empreinte des spécificités d'une génération de chercheurs.
Le nombre de participants au colloque (environ 35) avait été choisi pour couvrir un large champ de thématiques et d'horizons, tout en facilitant le travail par petits groupes. Au final, 34 jeunes chimistes organiciens se sont inscrits et 32 (âge moyen : 33,6 ans) étaient présents lors du colloque. Ce panel était constitué de 15 chargés de recherche CNRS, de 12 enseignants-chercheurs et de cinq chercheurs industriels issus d'une vingtaine de centres de recherche, dont trois hors de France. Les thématiques les plus représentées étaient la synthèse de molécules biologiquement actives et/ou naturelles (hétérocycles, sucres, peptides…) et le développement de méthodologies de synthèse. Les thématiques suivantes étaient représentées par au moins un participant : catalyse, chimie supramoléculaire, chimie verte, développement durable, chimie théorique, synthèse de molécules comme outils pour l'optique non linéaire.
2.2 Méthodes
La réflexion s'est articulée suivant trois phases :
- • une phase d'écoute, au cours de cinq conférences, pour initier et provoquer la réflexion :
- ○ deux conférences présentées par des chimistes ayant profondément influencé leur discipline : le Pr. J.-M. Lehn (Collège de France–ISIS) et le Pr. D. Seebach (ETH Zürich) ;
- ○ une conférence d'information sur la prospective par M. T. Gaudin (Prospective 2100) afin de définir cette notion et de donner des outils méthodologiques aux participants ;
- ○ une conférence présentant une vision critique de l'histoire de la chimie par une spécialiste de la philosophie des sciences (Pr. B. Bensaude-Vincent, université Paris-10) ;
- ○ une conférence exposant la vision d'un industriel (M. G. Ricci, Sanofi-Aventis).
- • une phase d'expression individuelle, dans laquelle chacun des participants (à l'exception des cinq organisateurs) présentait, à partir de son expérience, des éléments de réponse à la question centrale du colloque lors d'une communication orale de 15 minutes ;
- • une phase de réflexion collective, à travers des ateliers en petits groupes et des débats sous l'égide de deux animatrices professionnelles. La technique suivie a été celle du brainstorming (ou remue-méninges), qui s'est faite en deux temps : une phase de réflexion en sous-groupes de 10 à 11 personnes, s'appuyant sur des pensées divergentes, et une seconde phase par sous-groupes de trois à quatre personnes, faisant appel à la pensée convergente. La première phase a eu pour objectif de faire émerger le plus grand nombre d'idées possibles sans aucun jugement (aspect quantitatif). Elle a permis de définir de nombreuses pistes, qui ont été classées après débat en quatre rubriques très générales (« utopie », « connaître », « créer du nouveau » et « demande sociétale »). Chacun des participants a pu ensuite choisir parmi l'un de ces quatre thèmes lors de la seconde phase. Celle-ci avait pour objectif de focaliser la réflexion sur des défis précis (aspect qualitatif). À l'issue du second atelier, chacun des dix sous-groupes a présenté son défi à l'ensemble des participants en respectant une grille de présentation fondée sur les questions suivantes : « pourquoi ce défi ? » ; « comment le relever ? » ; « quels sont les freins–leviers susceptibles d'être rencontrés ? ». Après le congrès, ces défis ont été mis en forme par écrit par chaque atelier puis fusionnés en une synthèse commune.
3 Résultats
À la question impossible « Quelle chimie organique demain ? », il a été répondu par six nouvelles questions, représentant chacune un défi général. Ces défis ne sont pas nécessairement indépendants les uns des autres et de nombreux recouvrements sont perceptibles. Ils présentent néanmoins des caractères très différents en terme d'innovation, allant de l'utopie au réalisable, du fondamental à une technologie assumée. Les six questions posées sont :
- • Est-on capable de relever le défi du simple ?
- • La physique, outil absolu pour une sélectivité totale ?
- • Le chimiste peut-il créer une cellule artificielle ?
- • Vers une photosynthèse artificielle (le CO2 comme source de matière première) ?
- • Peut-on concevoir un médicament parfait ?
- • Le chimiste moteur de la conception de ses outils ?
3.1 Est-on capable de relever le défi du simple ?
La conquête du simple est un thème à la fois émergeant et transversal en chimie organique. Chercher à rendre simple le complexe, c'est maîtriser la sélectivité, la réactivité et l'organisation de systèmes moléculaires. La conquête du simple s'accompagnant toujours d'une économie de moyens, l'intérêt premier de cette approche est d'être un point de convergence fort entre recherche fondamentale, industrie et développement durable. Rendre simple le complexe est un défi scientifique majeur qui répond automatiquement aux enjeux de la société. Faire simple, c'est faire mieux avec moins d'étapes, de réactifs, de solvants et donc moins de déchets [4]. Simplifier, c'est arriver à contrôler un phénomène complexe à travers un nombre limité de paramètres [5]. Ainsi, le franchissement des différentes barrières d'échelle est optimisé, ce qui facilite le passage du laboratoire à l'usine (scale-up). Comment relever le défi du simple ? Au-delà d'un programme de recherche, c'est d'abord une nouvelle façon de penser la chimie organique en s'affranchissant des habitudes acquises. C'est placer, comme premier critère de sélection des « comment » et des « quoi », le critère de simplicité (simplicity-oriented synthesis) [6]. Ainsi, pour relever le défi de la sélectivité, il est possible d'imaginer des programmes de recherche volontaristes, dans lesquels l'utilisation de groupements protecteurs serait strictement bannie [7] ou exceptionnellement tolérée si ceux-ci cumulent d'autres fonctions (groupements partants, éléments de construction ou inducteurs chiraux). De nouvelles façons d'appréhender la réactivité d'une molécule pourraient permettre de relever le défi de l'efficacité. En cherchant à fonctionnaliser de façon générale des liaisons C–H non activées, le chimiste s'affranchirait des étapes d'activation, via des nucléofuges par exemple [8]. Ainsi, chaque méthylène d'une molécule pourrait être considéré comme potentiellement réactif ou fonctionnalisable, quelle que soit sa position (allylique, benzylique ou non). Cette démarche nécessite et par conséquent favorise une compréhension accrue de la réactivité. La première étape vers cet objectif passe probablement par l'utilisation de stratégies d'activation intramoléculaire [9]. Relever le défi de l'efficacité, c'est aussi s'imposer des contraintes en cherchant à limiter au maximum le nombre d'étapes de synthèse [10]. Ainsi, à la question : est-il possible d'effectuer la synthèse totale de novo d'un sucre naturel en deux étapes, la réponse n'est pas forcément non [11] ! Le défi de l'efficacité et de la sélectivité pourrait être également relevé grâce à l'utilisation nouvelle d'outils issus de la physique (voir section 3.2.). Relever le défi du simple c'est aussi parvenir à domestiquer des systèmes moléculaires pour ne plus « faire » mais « faire faire ». Il est ainsi possible d'utiliser une enzyme pour lui « faire faire » son inhibiteur [12]. L'objectif à long terme serait également de concevoir des systèmes moléculaires adaptatifs et interactifs, produisant une réponse donnée sous l'action de divers stimuli extérieurs [13] (voir sections 3.3. et 3.5.).
Défi transversal et émergent, la quête du simple est un puissant moteur de progrès, qui concilie recherche fondamentale et demande sociétale.
3.2 La physique, outil absolu pour une sélectivité totale ?
Le contrôle total de la sélectivité est l'un des défis majeurs de la synthèse organique. Le chimiste a tenté jusqu'ici de résoudre cette problématique en utilisant ses propres outils et stratagèmes (groupements protecteurs, copule chirale, catalyseurs…). Cependant, la réponse définitive à ce défi crucial pourrait venir d'outils issus non pas de la chimie, mais de la physique. Les physiciens ont fourni aux chimistes des outils d'analyse extraordinaires (RMN, diffraction des rayons X…), qui leur ont permis de faire face à la complexité croissante des objets de leur création. Il est probable qu'un jour le chimiste sera capable d'utiliser la physique pour manipuler sélectivement certaines parties d'une molécule, une fonction donnée, et favoriser la formation d'un état de transition plutôt que d'un autre. Pourquoi ne pas imaginer alors pouvoir synthétiser en un seul pot un produit à partir d'un mélange de substrats et de réactifs, sans aucune protection des fonctions mises en jeu, en créant pas à pas et de façon totalement régio-, chimio-, et stéréosélective, les différentes liaisons souhaitées par un choix judicieux des méthodes physiques d'activation (Fig. 1) ?
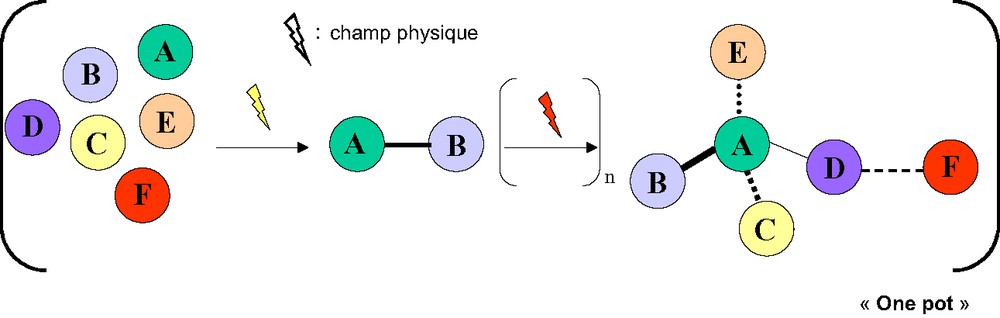
Synthèse organique absolue ?
Comment, grâce à la physique, exalter plus spécifiquement la réactivité d'une fonction au sein d'une molécule polyfonctionnalisée, tout en s'affranchissant de la réactivité de toutes les autres ? La RMN démontre que chacun des groupements fonctionnels d'une molécule placée sous l'influence d'un champ magnétique fournit un signal distinct et caractéristique. Des techniques photochimiques permettent déjà de rompre sélectivement certaines liaisons bien définies d'une molécule [14]. Il est par exemple possible de dissocier l'acide lactique pour conduire à la formation d'éthanol en utilisant des pulses laser femtoseconde de forme optimisée (contrôle quantique adaptatif) [14a], ou de rompre la liaison N–OH de l'acide nitrique en utilisant des processus à deux photons (IR–UV) [14b]. Ces techniques, pour l'instant limitées à la phase gazeuse, devront encore se développer et se généraliser avant de permettre une utilisation pour la synthèse en solution. En outre, il est déjà possible d'influencer le mouvement intramoléculaire de rotaxanes, en solution dans le dioxane, par l'intermédiaire d'un champ électrique alternatif [15]. Quelques exemples dans la littérature montrent que le rendement et la cinétique de certaines réactions radicalaires en solution sont influencés par un champ magnétique [16]. Ces différences de comportement de la matière sous l'influence de champs physiques devraient à terme pouvoir se traduire en synthèse organique par un contrôle de la chimiosélectivité.
Orienter la stéréosélectivité d'une réaction en utilisant une influence physique externe comme source unique de chiralité constitue sans aucun doute l'ultime défi de la synthèse asymétrique (Absolute Asymmetric Synthesis) [17]. Compte tenu de l'état des connaissances actuelles, il est possible aujourd'hui d'imaginer pouvoir relever un tel défi. Par exemple, le contrôle quantique adaptatif devrait en théorie permettre la synthèse sélective d'un énantiomère ou son inversion grâce à l'utilisation de pulses polarisés [14a,c]. On peut également envisager d'accéder à une synthèse asymétrique absolue en suivant deux étapes clés [17b,[18] : dans un premier temps, une influence physique chirale [19], telle que la lumière polarisée circulaire [20], pourrait permettre de générer un excès énantiomérique initial, qui serait, dans un second temps, amplifié par un effet non linéaire positif [21]. Une meilleure compréhension de phénomènes, tels que l'autocatalyse asymétrique, ainsi que l'étude d'autres influences physiques chirales (comme l'utilisation d'un faisceau laser dans un champ magnétique [22]), devraient permettre au chimiste organicien de demain de créer une méthode générale de synthèse asymétrique sans inducteurs moléculaires de chiralité. Jusqu'à présent, le contrôle de la réactivité et de la chimiosélectivité a fait appel à des méthodes physiques classiques inhérentes aux pratiques connues de la synthèse. Le défi consiste ici à aller beaucoup plus loin, en explorant de façon systématique l'action de diverses forces ou champs physiques pour atteindre un contrôle total de la sélectivité. Débarrassé (libéré) des auxiliaires chiraux, groupements protecteurs et autres prothèses chimiques, le chimiste parviendrait ainsi à relever le double défi du simple et de l'efficacité.
3.3 Le chimiste peut-il créer une cellule artificielle ?
La philosophie qui guide ce défi repose sur cette pensée du prix Nobel de physique R. P. Feynman : « What I cannot create, I do not understand ». La chimie organique est la science qui permet, qui donne la possibilité de faire (the enabling science) [23]. Pourquoi ne pas essayer de fabriquer des modèles cellulaires simplifiés pour mieux comprendre comment fonctionnent les cellules vivantes ? Le but ambitieux de ce défi est de construire des systèmes moléculaires artificiels doués de deux caractéristiques principales : la capacité de répondre à des stimuli, en s'adaptant d'une façon « évolutive » au milieu externe, et celle de se multiplier. Tout en étant conscients de ne pas pouvoir reproduire la totalité des processus cellulaires, nous tenterons de doter la cellule artificielle (Cell-Art) de la capacité d'évoluer en fonction du milieu externe. Des exemples de molécules d'ARN capables de se répliquer et d'évoluer d'une façon darwinienne ont déjà été rapportés et démontrent la faisabilité d'une telle approche [24]. Pour atteindre les buts décrits, la complexité du système artificiel devra être progressivement accrue afin d'étudier en détail la fonction de chaque élément introduit.
Une première approche vers une cellule artificielle simplifiée est proposée en quatre étapes. Dans une première étape, la membrane est formée par une bicouche lipidique, qui contient des transporteurs spécifiques (Tr) [25]. Ces transporteurs devront être des molécules qui présentent une surface hydrophobe et une cavité polaire permettant de former des complexes d'inclusion réversibles avec une molécule guest donnée (voir Fig. 2). Les molécules A et B seront ainsi transportées de l'extérieur vers l'intérieur de la cellule grâce à l'interaction avec des transporteurs spécifiques (TrA et TrB). Un système de transport actif devra permettre d'établir un gradient de concentration pour que, à concentration élevée à l'intérieur de la cellule, A et B réagissent en formant C à travers des réactions en milieu aqueux de type click-chemistry par exemple [26,27]. L'environnement interne spécifique de la Cell-Art pourra mettre en évidence des réactivités chimiques intéressantes ou inattendues. Lors de la deuxième étape, le produit C sera transporté à l'extérieur de la cellule par TrC. La molécule C aura une propriété donnée (fluorescence, etc.). À ce stade, le chimiste obtiendra un outil de synthèse particulièrement intéressant, lui permettant de fabriquer une molécule sans étape de purification autre que la séparation des cellules (idéalement seule la molécule C est présente à l'extérieur de la Cell-Art à la fin du processus). Dans une troisième étape, il sera possible d'étudier comment ce premier module cellulaire va réagir à des modifications externes (en changeant, par exemple, la concentration de A et B, le pH ou la température). Ensuite, des systèmes plus complexes pourront être formés avec de nombreux monomères (A, B, C, D, etc.), qui formeront des oligomères capables de catalyser leur propre duplication [28]. Si les trois premières étapes sont réalisables, un degré élevé de complexité aura été atteint. Il sera alors possible de créer une cellule qui transporte des monomères qui servent de briques pour la construction de molécules, pouvant se dupliquer spontanément de façon autocatalytique et servant par exemple à la construction de la membrane d'une cellule fille. S'approche-t-on de la possibilité d'induire la formation d'une nouvelle cellule dans une quatrième étape [29] ? Pour construire la Cell-Art, il faudra s'appuyer également sur des méthodes théoriques qui permettront de mieux choisir les transporteurs ou de mieux appréhender la diffusion ou le transport des produits de départ A et B. En retour, chacun des résultats expérimentaux pourra être exploité pour développer une « cellule » virtuelle in silico.
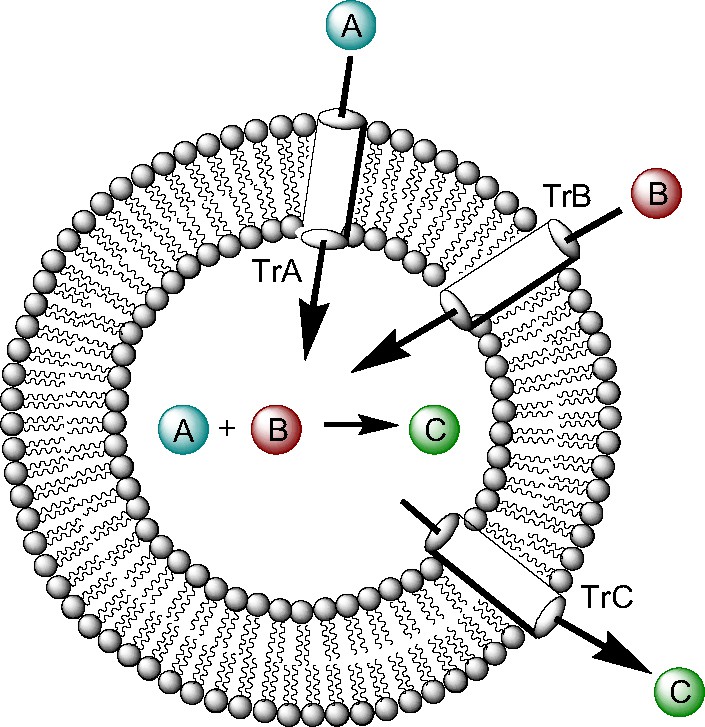
Premier prototype de Cell-Art.
Si les outils disponibles pour le chimiste organicien permettent de réaliser une version avancée de la Cell-Art, nous pourrons enfin tenter de répondre aux questions clés de ce défi : comment se comporte ce système ? Arrive-t-il à s'adapter d'une façon « intelligente » aux conditions externes ? Est-il capable de se multiplier en utilisant les molécules présentes dans son environnement ?
3.4 Vers une photosynthèse artificielle (le CO2 comme source de matière première) ?
« Tous les 200 ans, chaque atome de carbone […] entre et rentre dans le cycle de la vie par la porte étroite de la photosynthèse. […] Consciemment ou non, l'homme n'a pas tenté jusqu'ici de rivaliser sur ce terrain avec la nature, il ne s'est pas efforcé de puiser dans l'anhydride carbonique de l'air le carbone qui lui est nécessaire […]. Il ne l'a pas fait car il n'en a pas eu besoin : il a trouvé de gigantesques réserves […] constituées de gisements de charbon fossile et de pétrole… » [30]. Cette citation de Primo Levi, issue du chapitre Carbone de son livre Le Système périodique, résume parfaitement l'un des grands enjeux scientifiques et technologiques du XXIe siècle. Depuis près d'un siècle, nous puisons dans les sources de carbone fossile (pétrole, gaz naturel et charbon), l'essentiel des matières premières organiques indispensables à notre développement. Cependant, l'épuisement inéluctable des réserves pétrolières va bouleverser le visage de nos sociétés et de l'industrie chimique. La chimie organique sera touchée au cœur de sa pratique. La structure des produits de départ disponibles, dont un grand nombre sont actuellement dérivés du pétrole, sera sans doute profondément modifiée. Dans ce contexte, où trouver de nouvelles sources renouvelables de carbone capables de remplacer le carbone d'origine fossile ? L'utilisation du dioxyde de carbone atmosphérique comme source de matière première organique présente de nombreux atouts, mais soulève également de nombreux défis. En effet, le CO2, gaz non inflammable et non toxique, est l'une des sources de carbone les moins chères et les plus disponibles et sa transformation contribuerait à limiter l'effet de serre [31]. Cependant, le dioxyde de carbone, stade ultime de la dégradation de toute molécule organique, est une entité chimique extrêmement stable.
Depuis une dizaine d'années, de nombreux efforts ont été réalisés dans le domaine de la capture du CO2 atmosphérique, de sa réduction électrochimique et/ou photochimique et dans le développement de réactions utilisant le CO2 [31,32]. L'objectif de ce défi serait de combiner ces trois approches pour développer des outils capables de mimer le processus de la photosynthèse, afin de transformer le CO2 atmosphérique en une nouvelle source de matière première. Idéalement, une forme d'énergie renouvelable et non polluante, telle que la lumière solaire, serait employée. Concernant l'amont, il semble aujourd'hui tout à fait concevable de capturer le dioxyde de carbone en sortie des centrales et industries les plus « polluantes » (en terme d'émission de CO2) [33]. L'idéal serait de proposer une plus grande variété de systèmes de capture allant jusqu'à de petites unités de fixation utilisables localement par les « petits producteurs » de CO2 (par exemple les unités d'incinération). Notre objectif, en tant que chimistes organiciens, serait de développer des procédés synthétiques utilisant le CO2 directement en sortie des unités de capture, en s'affranchissant ainsi des problèmes de transport et de stockage.
Le dioxyde de carbone est une entité chimique peu réactive et son utilisation comme source de carbone nécessite de vaincre des barrières énergétiques élevées. Un aspect primordial du projet sera donc de valoriser le CO2 en chimie organique en explorant systématiquement sa réactivité afin de développer de nouvelles méthodologies de synthèse. De nombreuses pistes sont à explorer, comme le remplacement du phosgène par le CO2 ou la découverte de méthodes permettant de former efficacement des liaisons C–C [31] ou des liaisons C–O [32c]. La chimie combinatoire et la mise au point de tests de criblage à haut débit pour la découverte de nouveaux catalyseurs pourraient permettre également d'accélérer la mise en évidence de nouvelles réactivités [34]. Il est aussi important d'aller plus loin dans l'utilisation du CO2 pour l'obtention de polymères. Serait-il envisageable d'utiliser le CO2 pour fabriquer par exemple des matériaux à base de polyesters dans lesquels la majorité des atomes de carbones seraient issus de ce monomère simple ? L'objectif ultime serait de pouvoir réaliser ces transformations chimiques en utilisant comme source d'énergie la lumière solaire à l'aide, par exemple, de catalyseurs photosensibles [35].
Une photosynthèse artificielle transformant, à l'aide d'énergies renouvelables, le CO2 en produits stables utilisables comme synthons par l'industrie chimique, permettrait de poursuivre le développement industriel, tout en respectant l'environnement. Dans un élan qui va à l'opposé de la perception majoritairement répandue dans le grand public, la chimie ne serait plus une industrie polluante, mais deviendrait une industrie de dépollution2.
3.5 Peut-on concevoir un médicament parfait ?
Le rêve d'un médicament parfait capable de soigner toutes les affections est aussi ancien que la figure mythologique de Panacée, fille d'Asclepios, dieu de la médecine chez les Grecs. Divers textes alchimiques du Moyen Âge suggèrent déjà la conception d'un remède unique et universel à base d'or. Ce médicament avait pour objectif de rectifier et de rendre plus puissants les fluides organiques tels que le sang ou le spiritus vital. Au XIXe siècle, l'aspirine connaît un succès exceptionnel auprès du public, tout comme plus tard la cortisone, qui sera qualifiée de « molécule merveilleuse ». En 1900, Paul Erlich introduit le concept de magic bullet, composé qui aurait une attirance particulière vis-à-vis d'un micro-organisme à l'origine d'une maladie [36]. Ces mythes qui traversent les siècles s'imposent à nous et aux générations à venir comme un défi permanent à relever. Le principe actif d'un médicament parfait pourrait être doué d'une forme d'intelligence moléculaire liée aux qualités suivantes : adaptabilité, autonomie et multicompétence.
Différentes pistes peuvent être envisagées pour aboutir à un composé capable de s'adapter en fonction de la cible à atteindre et de la maladie à traiter. Une possibilité serait d'élaborer une structure centrale universelle, sur laquelle seraient accrochées différentes fonctions masquées qui, en fonction des perturbations et des médiateurs biochimiques produits lors d'un dérèglement, seraient déprotégées in vivo [37]. Le médicament pourrait alors être activé, et s'adapter automatiquement en utilisant les propres outils de la cible qu'il vise. Dans ce cadre, c'est l'« in vivo » qui déciderait de la structure de la molécule active et non plus l'« in vitro ». Il est également possible d'envisager des composés qui pourraient, comme une protéine, adopter des conformations différentes pour cibler spécifiquement une altération biologique. Par ailleurs, la participation des complexes organométalliques à de nombreux processus biochimiques montre leur rôle majeur dans la chimie du vivant [38]. Les propriétés à la fois complexantes et rédox des métaux pourraient être exploitées, en envisageant la préparation de nouvelles substances organométalliques à visées thérapeutiques. Les complexes du platine forment actuellement la classe d'agents anticancéreux la plus active. Jusqu'à présent, seuls les complexes à géométrie plan carré ou octaédrique avec une variété de ligands inorganiques, ou même organiques dans certains cas (cas du carboplatine et de l'oxaliplatine [39]), se sont révélés suffisamment actifs. Toutefois, leur utilité est limitée par l'apparition de cellules tumorales résistantes et par leur toxicité trop importante. Un effort conséquent doit donc être apporté au développement de nouvelles substances alliant à la fois les propriétés thérapeutiques des complexes métalliques et celles des petites molécules organiques bioactives comme ligands [38b]. L'idéal serait également de pouvoir concevoir des systèmes qui évoluent en fonction des mutations d'un micro-organisme pathogène afin de surpasser les phénomènes de résistance.
Le médicament parfait devra également posséder une certaine autonomie. Il devra être capable de se déclencher sélectivement sur sa cible pour limiter les effets secondaires. Des blocs (organiques ou organométalliques) parfaitement tolérés par l'organisme pourraient ainsi être activés, puis s'auto-assembler au niveau de leur cible pour donner la molécule active, par extension du concept de chimie combinatoire dynamique [12]. Le médicament du futur devra être capable de tout faire et de posséder à la fois des vertus diagnostiques, curatives et préventives. Ces « soldats moléculaires » seconderaient notre propre système immunitaire. Ils pourraient être composés d'unités distinctes, assurant chacune une fonction particulière (chercher, détecter, signaler, détruire), articulées autour d'un « cerveau » central chargé d'ordonner les actions à réaliser en fonction des différentes pathologies détectées. Dans le cadre de la lutte contre le cancer, le développement de pro-drogues ou d'ante-drogues [40] non toxiques, activées de façon sélective au niveau des tumeurs, annonce déjà les prémices de ces futurs médicaments « intelligents » [37]. Constituées de trois parties (trigger–linker–effector) [41] programmées pour jouer un rôle déterminé, de telles molécules sont potentiellement inoffensives vis-à-vis des tissus sains et sont capables de déclencher l'activation de l'agent antitumoral uniquement lorsque la tumeur est détectée. Des travaux publiés récemment montrent qu'il est possible d'activer consécutivement plusieurs substances différentes sous l'action d'un seul stimulus [42]. Ainsi, après chaque activation, l'unité centrale se régénère de façon autonome pour acquérir la capacité de libérer à nouveau un agent anticancéreux. Dans le même domaine, une étude récente a été initiée dans le but d'engendrer le recrutement d'une « armée » de pro-drogues au voisinage de la tumeur, en ajoutant un marqueur de reconnaissance cellulaire aux trois unités citées précédemment [43].
« Plus jamais malade » : telle pourrait être la devise des chimistes en charge de l'élaboration du médicament de demain. Celui-ci sera, peut-être à l'image d'une ruche, constitué d'éléments possédant chacun des propriétés particulières en accord avec leurs missions, créant ainsi un ensemble autonome, susceptible de se défendre contre toute attaque extérieure.
3.6 Le chimiste moteur de la conception de ses outils ?
De par sa position centrale dans l'organigramme des sciences, la chimie organique a le pouvoir de répondre à des questions fondamentales ou de résoudre des problématiques spécifiques à d'autres disciplines comme la biologie ou la physique. La synthèse et l'utilisation judicieuse de sondes moléculaires permettent, par exemple, de mettre en évidence des mécanismes biologiques complexes. De façon plus appliquée, la médecine et la pharmacologie se nourrissent de l'expertise des chimistes pour relever les défis liés à la santé. Le risque est parfois grand pour le chimiste d'être absorbé par des problématiques et des enjeux extérieurs et d'oublier les défis qui constituent le cœur de sa discipline. Synthétiser le plus rapidement possible, quels que soient le rendement ou la méthode, une molécule pour tester au plus vite ses propriétés ne doit pas devenir l'unique préoccupation de la chimie organique. Les présents défis renversent ce processus en plaçant le chimiste au cœur de la conception d'outils stratégiques pour ses recherches. Pour construire de telles machines, le chimiste devra être capable d'être la force motrice d'équipes pluridisciplinaires, composées notamment d'informaticiens, de mathématiciens et de physiciens.
3.6.1 VIsualiser des processus réactionnels en Temps REel (technologie VITRE) ?
Et si le chimiste pouvait d'un seul coup d'œil « voir ce qui se passe dans son réacteur » ? Cette technologie fantastique lui permettrait de démultiplier sa créativité et d'accélérer la découverte de nouvelles méthodologies. Un des facteurs limitant le progrès en synthèse organique est le manque de compréhension du déroulement intime des réactions, et en particulier la difficulté d'observer les intermédiaires réactionnels en temps réel ainsi que les états de transition mis en jeu au cours de chaque réaction. En effet, à l'heure actuelle, la plupart des méthodes de suivi de réactions sont des méthodes impliquant un prélèvement d'échantillon préalable à son analyse. Bien souvent, ces analyses nécessitent un traitement (hydrolyse par exemple) du milieu réactionnel qui rend impossible une analyse instantanée de la composition des mélanges réactionnels. Quelques techniques d'analyse en temps réel ont déjà commencé à voir le jour, telles que l'analyse IR ou la combinaison de techniques spectroscopiques (IR/UV–visible, UV–visible/Raman/XAFS, etc.) [44]. Cependant, ces méthodes ne permettent pas d'observer l'ensemble des processus réactionnels. Depuis peu, le développement de la femtochimie [45] a permis d'observer des espèces moléculaires transitoires (intermédiaires réactionnels) pendant une réaction, ou des changements de phase en temps réel, grâce à la diffraction électronique ultrarapide [46]. Un article récent rapporte même la possibilité d'observer (par tomographie) le nuage électronique d'une molécule d'azote isolée [47]. Cependant, ces observations requièrent à l'heure actuelle des appareillages spécifiques et des montages lourds, difficilement utilisables pour le suivi de réactions en routine.
Un système permettant la visualisation en temps réel des réactions (VITRE) ne pourra voir le jour qu'en regroupant des équipes largement pluridisciplinaires (chimistes, physiciens, métrologues, analyticiens, ingénieurs en miniaturisation). Le rôle du chimiste organicien sera de faire un diagnostic rigoureux des contraintes liées à l'utilisation d'un tel dispositif dans un milieu réactionnel (nécessité de pouvoir travailler à basses ou hautes températures, résistance à la pression ou au vide, possibilité de travail en milieu inerte, etc.). Il devra clairement définir le type d'informations qu'il attend d'un tel dispositif (informations structurales, qualitatives, quantitatives, etc.), puis tester la viabilité des premiers prototypes (allers retours avec les physiciens, informaticiens).
Bien que naïve, la question initiale : « Et si le chimiste pouvait d'un seul coup d'œil voir ce qui se passe dans son réacteur ? » doit être posée. Les grandes découvertes scientifiques ont souvent pour origine une avancée technologique et traduisent toujours la remise en cause de ce qui était considéré jusqu'alors comme impossible.
3.6.2 Vers une RMN intelligente ?
Le nombre de molécules organiques référencées dans les Chemical Abstracts croît de façon exponentielle3. L'accélération des progrès en chimie organique est liée à l'efficacité avec laquelle ces nouvelles molécules synthétisées seront caractérisées. L'objectif de ce défi est de concevoir une RMN « intelligente » qui, de façon autonome, donnerait directement la structure du composé analysé à partir d'un échantillon avec un pourcentage d'erreur calculé. La plupart des technologies nécessaires pour réaliser un tel outil existent déjà, mais elles ne sont pas encore mises en œuvre de façon concertée et autonome. Un appareil de RMN peut, une fois programmé et de manière totalement automatisé, acquérir des données en 1D et 2D sur de multiples noyaux. Des logiciels tels que LSD (Logic for Structure Determination) [48] ou TopSpin [49] ont été développés pour l'analyse structurale, c'est-à-dire pour pouvoir identifier des fragments de molécules en fonction d'analyses 1D et 2D. Une autre approche pour l'identification de composés consiste à simuler des spectres à partir de données de produits connus. Des algorithmes de prédiction de structure utilisant des petites bases de données commencent à être utilisés pour le criblage à haut débit [50]. Il est également possible depuis peu, grâce à la chimie théorique et à la DFT (Density Functional Theory) en particulier, de simuler le spectre RMN d'un produit en fonction de sa structure, en prenant même en compte les différentes conformations possibles [51]. Serait-il possible de faire cohabiter toutes ces techniques et qu'un logiciel soit capable de tout piloter de façon autonome ?
Cette RMN « intelligente » pourrait être construite autour d'un ordinateur central, qui commanderait au spectromètre RMN les analyses dont il a besoin pour déterminer la structure, et qui serait capable de reconstruire les fragments de la molécule en fonction des analyses RMN 1D et 2D. Une fois la structure hypothétique reconstruite, ou dans le cas de solutions multiples, ce système pourrait demander une simulation de spectre RMN à un calculateur annexe travaillant en DFT afin de confirmer ou d'infirmer les hypothèses. Ce processus itératif pourrait ainsi proposer une (ou des) structure(s) avec un pourcentage d'erreur calculé. L'utilisateur pourrait également indiquer au préalable la structure possible du composé attendu, qui serait ainsi confirmée ou infirmée plus rapidement. Mais la réelle innovation serait de créer un réseau mondial (le « NMR-net ») dans lequel les données de RMN seraient emmagasinées, par exemple sous un format standardisé de FID, en corrélation avec leur structure. Cela permettrait, d'une part, de déterminer si le produit a déjà été synthétisé par comparaison directe des FID (fréquences, couplages, multiplicités identiques) ; d'autre part, en important dans sa mémoire les structures des spectres ressemblants, l'ordinateur serait capable de reconstruire des fragments de molécule, qu'il pourrait comparer à ceux déduits de ses propres analyses structurales. Le spectre de la structure, ainsi affinée, serait simulé et comparé à l'original. Un processus itératif (acquisition de données, comparaison avec la base, analyse structurale, simulation) serait mis en place jusqu'à ce qu'une structure finale soit proposée avec un certain degré de fiabilité fixé par l'utilisateur. Pour cela, les algorithmes de l'ordinateur devraient être conçus afin qu'ils puissent décider des nouvelles expériences à mener en fonction des résultats de la simulation. Un mélange de composés devrait aussi pouvoir être identifié par des séquences de type DOSY 2D, permettant de séparer les signaux propres à chaque composé présent [52].
Une RMN « intelligente » pourrait faire gagner un temps précieux aux chimistes de synthèse, et permettre à l'industrie chimique de disposer d'un outil d'analyse et d'identification utilisable en chimie combinatoire. Couplé à une méthode de séparation efficace, un tel système automatisé pourrait également accélérer la caractérisation des millions de produits naturels qui nous sont encore inconnus.
3.6.3 Exploiter toute la puissance de l'outil informatique en synthèse totale ?
Les avancées réalisées en informatique au cours de ces 20 dernières années ont eu un impact très fort sur le développement de la chimie organique. L'accès en quelques clics à tout un ensemble de connaissances et d'informations a permis de libérer la créativité du chimiste. Mais a-t-on exploité toute la puissance de l'outil informatique, notamment pour réaliser un acte clé en synthèse organique, l'analyse rétrosynthétique ? La réussite et l'efficacité d'une synthèse multi-étapes reposent essentiellement sur la qualité de cette analyse. Posséder un outil puissant d'aide à l'analyse rétrosynthétique permettrait de réduire le coût global d'une synthèse en temps, argent et moyens humains. Une recherche rapide des programmes disponibles aujourd'hui a permis de sélectionner cinq logiciels principaux ; qui proposent une approche rétrosynthétique selon une liste de critères choisis par l'utilisateur : LHASA [53], PROTECT [54], SystematiChem [55], SynGen [56] et Chiron [57]. Les principaux critères de sélection pris en compte dans ces logiciels sont les suivants : structure de la molécule cible, choix des réactifs et des précurseurs (commerciaux ou facilement accessibles), nombre d'étapes, fiabilité des résultats en fonction de la validité scientifique des réactions proposées, choix d'une réaction spécifique, enrichissement de la base de données en fonction des résultats (logiciel intelligent), orthogonalité de groupes fonctionnels, rendement des réactions, sélectivité (régio-, stéréo-, chimio-), références bibliographiques pour les synthèses proposées. Aucun des logiciels présentés ci-dessus n'utilise l'ensemble de ces critères d'analyse rétrosynthétique. Pour obtenir un logiciel performant, il faudrait prendre en compte tous les critères cités de manière exhaustive et les compléter par d'autres. L'échec d'une analyse rétrosynthétique est dû, avant tout, à la difficulté de prévoir le résultat d'une réaction chimique pour un substrat donné [58]. Il faudrait développer des logiciels de prédiction de réactivité adaptés afin de les coupler à l'analyse rétrosynthétique. De plus, il sera nécessaire d'établir des interactions avec les bases de données existantes (Beilstein, CAS, SciFinder, IsisBase, Medline) ou à venir, pour mieux évaluer la fiabilité des résultats, mais également élargir le nombre de publications disponibles pour le logiciel. Une série de critères supplémentaires permettrait d'obtenir un outil plus performant, comme par exemple : biomimétisme, approche convergente ou linéaire, choix d'un réactif ou d'un synthon propre à l'utilisateur, possibilité d'enrichir la base de données par les utilisateurs et sous le contrôle de leurs pairs. Un autre outil pouvant être rattaché à ce logiciel est ChemBank [59], une banque de données gratuite de petites molécules et de leurs propriétés notamment biologiques.
Un logiciel4 optimisant la puissance de l'outil informatique au service de la synthèse totale permettrait au chimiste d'aller plus vite et plus loin.
4 Conclusion
Le déroulement et le résultat de cette première expérience ESYOP ont réservé de nombreuses surprises. La première a sans doute été l'enthousiasme avec lequel les 32 acteurs ont mis spontanément leur expertise de côté pour s'intégrer à une réponse collective, et explorer des domaines inconnus. Le point de départ des différentes réflexions a rarement été un défi purement scientifique mais a souvent été lié à la demande sociétale sur des notions d'environnement ou de santé par exemple. Le mythe du chercheur dans sa tour d'ivoire semble avoir laissé la place à un chercheur influencé par les attentes de la société. Une position d'équilibre est sans doute à chercher entre ces deux attitudes opposées. Une autre surprise est venue du caractère technologique de près d'un tiers des défis et de cette envie de participer à la création d'outils indispensables à de futurs développements en chimie organique. À l'opposé, cette tendance a côtoyé des propositions presque utopiques, mais dont les tentatives de réalisation pourraient avoir des applications concrètes enthousiasmantes. Trois thèmes centraux interdépendants semblent émerger des huit défis mis en évidence. Le premier concerne la conquête du simple pour faire (synthèse, médicament) ou pour comprendre (Cell-Art, outils). Ce thème permet de faire converger les enjeux de la recherche fondamentale de l'industrie et du développement durable. De nombreux défis montrent l'influence profonde de la nature comme guide et source d'inspiration du chimiste (Cell-Art, photosynthèse, système immunitaire « bis », sélectivité) [60]. Le dernier thème est lié à la notion de systèmes intelligents capables d'autonomie et d'adaptabilité (médicament parfait, RMN, analyse rétrosynthétique, Cell-Art). Le visage de la chimie organique de demain sera peut-être celui d'une science cherchant à construire, avec une grande économie de moyens, des systèmes moléculaires inspirés de la nature et dotés d'une forme d'intelligence. Les orientations futures seront également profondément influencées par des innovations issues d'autres disciplines scientifiques ou par des contraintes extérieures plus ou moins prévisibles, comme l'épuisement des réserves pétrolières, par exemple. Les conclusions de la première expérience ESYOP étant données, il serait extrêmement intéressant de pouvoir les confronter aux conclusions apportées par d'autres générations de chimistes dans un cadre équivalent (doctorants, génération 40–49, 50–59, chercheurs émérites) [61]. Pourquoi ne pas imaginer également un métissage de nationalités (un ESYOP européen) ou une expérience similaire axée sur les multiples défis didactiques liés à l'enseignement de la chimie organique ? Dans un souci de dialogue et de compréhension des enjeux des divers domaines de la chimie, pourquoi ne pas étendre cette idée à d'autres disciplines telles que la chimie analytique ou la chimie des matériaux ? Nous sommes également déterminés à renouveler tous les quatre ans l'expérience ESYOP35 centrée sur la génération 30–39 ans afin de comparer les différentes réponses données et de mesurer leur évolution [62].
« C'est maintenant que se construit le futur qui n'existe nulle part. Or pour construire le futur, il faut d'abord s'en faire une image, même fausse [3] ». Science de l'action autant que de la prédiction, la prospective doit jouer un rôle essentiel dans notre démarche de scientifique. Quelle que soit la difficulté de la tâche, nous devons sans cesse exercer nos capacités à imaginer et anticiper un après-demain [63].
Remerciements
Le comité d'organisation remercie l'ensemble des partenaires qui ont soutenu la première édition des Entretiens de synthèse organique et de prospective (ESYOP) des 35 qui s'est déroulée du 20 au 23 mars 2005 à Nouan-le-Fuzelier (41) : le CEA Le Ripault, IPSEN, LVMH Recherche, l'Oréal, Organon, Sanofi-Aventis, le comité des directeurs des laboratoires CNRS d'Orléans, la Société française de chimie, l'Union des industries chimiques du centre, la délégation régionale CNRS Centre Poitou-Charentes, l'Institut de chimie organique et analytique d'Orléans et Carlo Erba-SDS. Nous remercions également les Professeurs J. M. Lehn, D. Seebach, B. Bensaude-Vincent et Messieurs T. Gaudin et G. Ricci pour leur participation enthousiaste. Nous adressons nos sincères remerciements à Mademoiselle V. Liautard et à Monsieur S. Toumieux pour leur aide efficace lors de ces trois jours. Enfin nous remercions les professeurs P. Vigny, M.-C. Lasne et G. Guillaumet pour leurs conseils au début et/ou au cours de cette aventure.
2 Seulement 0.1% du CO2 produit serait utilisé actuellement par l’industrie chimique, voir référence [33a].
3 Près d’un million de molécules nouvelles sont référencées tous les ans dans la base de données Chemical Abstract Service (CAS).
4 Idéalement, ce logiciel de retrosynthèse assisté par ordinateur devrait être distribué librement et développé en collaboration avec tous les chimistes organiciens (open-source).


