1 Introduction
Les catalyseurs hétérogènes constitués de métaux nobles supportés sont utilisés dans un large domaine de procédés chimiques, comme la déshydrogénation, l'hydrogénation et l'oxydation… L'utilisation de ZnO comme support du platine dans différentes réactions fait actuellement l'objet de plusieurs travaux. Par exemple, il a été rapporté que les catalyseurs Pt/ZnO peuvent permettre une sélectivité de 99% pour une conversion de 45% dans la déshydrogénation de l'isobutane en isobutène à 723 K [1]. Différents catalyseurs monométalliques et bimétalliques supportés ont été utilisés pour étudier l'hydrogénation sélective du crotonaldéhyde. Des métaux tels que Co, Pt, Ru, Rh, Os et Ir sur divers supports (ZnO, CeO2…) ont été examinés et ont démontré présenter de grandes différences en ce qui concerne leurs propriétés catalytiques.
Avec les catalyseurs monométalliques, une baisse de sélectivité en produits désirés est généralement obtenue [2–4]. Il est nécessaire de modifier le métal pour obtenir une certaine sélectivité en ces produits : l'iridium [5,6] le nickel [7] et l'étain [8–13] ont été utilisés pour améliorer la sélectivité vers l'hydrogénation de la liaison carbonyle avec les catalyseurs au platine. L'effet promoteur du Zn a été aussi noté récemment par Consonni et al. [14] pour la même réaction sur les catalyseurs Pt/ZnO. Ces auteurs en ont conclu que la sélectivité en alcool insaturé augmente sur un alliage Pt–Zn [14].
L'utilisation du zinc comme promoteur ou support pour la réaction d'hydrogénation sélective n'est pas limitée aux catalyseurs à base de platine. Pour cela, nous avons étudié une série à base de rhodium (1 et 5%) déposé sur Al2O3 et sur ZnO–Al2O3, avec les proportions atomiques Zn/Rh = 1, 2, 3 et 5. Ces catalyseurs ont été caractérisés par différentes techniques physicochimiques.
2 Partie expérimentale
2.1 Préparation des catalyseurs
Les catalyseurs que nous avons étudiés sont à base de rhodium (1 et 5% en poids). Ils ont été préparés par la méthode d'imprégnation basée sur l'échange anionique entre le support et le sel métallique précurseur [15]. Le support utilisé est une alumine industrielle γ-cubique (SBET = 210 m2 g−1). L'alumine (diamètre des particules : 0,1–0,25 mm) est calcinée à l'air pendant 4 h à une température de 450 °C.
2.1.1 Modification du support
Après calcination, le support alumine est imprégné par une solution aqueuse de nitrate de zinc Zn(NO3)2·4H2O (98,5% de pureté) ou de chlorure de zinc ZnCl2 (98% de pureté) à la température ambiante. L'échange anionique entre le précurseur du métal et le support est rapide et total au bout de 3 h (décoloration rapide de la solution). L'eau est évaporée lentement sur bain de sable. Le produit résultant est séché à l'étuve à 120 °C, puis calciné à l'air à 450 °C pendant 4 h.
2.1.2 Ajout du métal noble
Les supports Al2O3 et ZnO–Al2O3 obtenus ont été mis en contact avec une solution aqueuse du précurseur de RhCl3·xH2O (40% Rh, Fluka), avec des rapports atomiques Zn/Rh de 0, 1, 2, 3 et 5. La solution est ensuite évaporée sur bain de sable. Le produit obtenu est également séché à l'étuve à 120 °C, puis calciné à l'air à 450 °C pendant 4 h.
Pour des rapports atomiques Zn/Rh de 0, 1 et 5, les supports Al2O3 et ZnO–Al2O3 sont imprégnés par une solution aqueuse de nitrate de rhodium Rh(NO3)3·xH2O (36% Rh, Aldrich), avec des teneurs de 1 et 5% en poids en rhodium. Les catalyseurs préparés sont présentés dans le Tableau 1.
Description des catalyseurs
| Catalyseurs | %Rh | Zn/Rh | Supports |
| 1RA,Cl | 1 | 0 | Al2O3 |
| 5RA,Cl | 5 | 0 | Al2O3 |
| 1RA,N | 1 | 0 | Al2O3 |
| 5RA,N | 5 | 0 | Al2O3 |
| 1RZA1,Cl | 1 | 1 | ZnO–Al2O3 |
| 1RZA5,Cl | 1 | 5 | ZnO–Al2O3 |
| 5RZA5,Cl | 5 | 5 | ZnO–Al2O3 |
| 5RZA1,Cl | 5 | 1 | ZnO–Al2O3 |
| 5RZA5,N | 5 | 5 | ZnO–Al2O3 |
2.2 Caractérisation des catalyseurs
2.2.1 Chimisorption d'hydrogène (Hc)
Un échantillon de catalyseur (200 mg) est placé dans un réacteur en U et réduit in situ à 500 °C pendant 1 h sous hydrogène en continu. Après 1 h de dégazage sous argon à la même température, le catalyseur est refroidi sous argon jusqu'à la température ambiante, avant les mesures de chimisorption et les titrages. Les mesures de chimisorption sont effectuées par injection de pulses du gaz considéré (H2 ou O2) dans l'argon utilisé comme gaz vecteur.
La dispersion du métal et la taille des particules métalliques ont été mesurées par chimisorption d'hydrogène Hc à température ambiante [16]. Cette mesure a été réalisée à l'aide du montage chromatographique pulsé [17].
Pour le calcul de la dispersion, la stœchiométrie suivante est adoptée pour le rhodium:
- HC : RhS + 1/2 H2 → RhS–H
- OT : Rhs–H + O2 → RhS–O1,5 + 1/2 H2O
- HT : Rhs–O1,5 + 2H2 → Rhs–H + 3/2 H2O
À partir de la quantité d'hydrogène ou d'oxygène absorbée QCHIM, on détermine la dispersion du métal à la surface du support :
2.2.2 Thermoréduction en température programmée (TPR)
L'échantillon à analyser est placé dans le réacteur et balayé par un gaz inerte (Ar) à température ambiante. Puis il subit une montée en température de 5 °C min−1 jusqu'à 500 °C. Des impulsions d'hydrogène sont régulièrement injectées (toutes les 2 min) dans le circuit gazeux.
2.2.3 Thermodésorption programmée (TPD)
Après avoir subi un titrage HT, le catalyseur est chauffé in situ sous argon de 25 jusqu'à 500 °C, selon une vitesse de chauffe de 20 °C min−1.
3 Résultats et discussion
3.1 Chimisorption de l'hydrogène
3.1.1 Caractérisation des catalyseurs RA
3.1.1.1 Effet du sel précurseur et de la teneur en métal.
Nous avons caractérisé les catalyseurs RA à 1 et 5% en poids en métal par leur capacité d'adsorption de l'hydrogène. Les résultats obtenus sont reportés dans le Tableau 2. Nous constatons une augmentation de la quantité d'hydrogène chimisorbée lorsque la teneur en rhodium augmente, et ce quel que soit le sel précurseur utilisé. Ceci s'explique par la formation de grosses particules. Ces résultats sont confirmés par le calcul de la taille des particules. La valeur de la dispersion trouvée sur l'échantillon 1RA,Cl est inférieure à celle trouvé par Benseradj et al. [18], mais elle est supérieure à celle trouvé par Sato et al. [19]. Cette différence est liée aux conditions de préparation.
Caractérisation des catalyseurs 1RA et 5RA
| Catalyseurs | Hc (μmol gcatal−1) | DHc (%) | d (Å) |
| 1RA,Cl | 75,1 | 77,3 | 14 |
| 1RA,N | 73,4 | 75,5 | 14 |
| 5RA,Cl | 251,1 | 51,7 | 21 |
| 5RA,N | 254,2 | 52,3 | 21 |
3.1.1.2 Effet de la température de réduction
La Fig. 1 présente la variation de la dispersion du rhodium dans les catalyseurs 1RA,Cl et 5RA,Cl en fonction de la température de réduction. Nous remarquons que le métal est mieux dispersé sur les catalyseurs réduits à 500 °C. Cette dispersion diminue lorsque la température de réduction et la teneur en métal augmentent. Ce phénomène s'explique par l'effet de frittage, qui est inévitable à haute température de réduction.

Variation de la dispersion en fonction de la température de réduction sur les catalyseurs RA,Cl.
3.1.2 Caractérisation des catalyseurs RZA
3.1.2.1 Effet du sel précurseur et de la teneur en métal
Nous avons étudié l'effet du sel précurseur et de la teneur en métal sur les propriétés des catalyseurs 1RZA et 5RZA, avec le rapport atomique Zn/Rh = 5. Les résultats obtenus sont regroupés dans le Tableau 3. L'ugmentation de la teneur en rhodium de 0 à 5% provoque une diminution de la dispersion, et ce quel que soit le sel précurseur utilisé. Ceci est attribué à la formation de grosses particules. Ces résultats sont analogues à ceux trouvés par Wang et al. [20], qui ont noté que l'augmentation de la teneur en métal de 1 à 10% provoque une diminution de la dispersion du rhodium de 22,9 à 9,8%.
Caractéristiques des catalyseurs RZA5
| Catalyseurs | QHc (μmol gcatal−1) | DHc (%) | d (Å) |
| 1RZA5,Cl | 40,8 | 42,0 | 26 |
| 1RZA5,N | 43,8 | 45,1 | 24 |
| 5RZA5,Cl | 151,3 | 31,2 | 35 |
| 5RZA5,N | 191,8 | 39,4 | 27 |
3.1.2.2 Effet du rapport atomique Zn/Rh
Le Tableau 4 regroupe les résultats de chimisorption d'hydrogène sur les catalyseurs RZA,Cl. Ces résultats nous permettent de constater que la dispersion du rhodium et la taille moyenne des particules sont sensibles à la présence de Zn. Nous notons une augmentation des tailles des particules et une diminution des quantités chimisorbées lorsque le rapport atomique Zn/Rh augmente. Ces résultats peuvent s'interpréter de deux manières: par la diminution de la dispersion et/ou par la modification des propriétés électroniques du métal et, par conséquent, des propriétés de chimisorption. Ces résultats sont analogues à ceux trouvés par Silvestre-Alberto et al. [21] sur les catalyseurs Pt/TiO2. Ces auteurs ont montré que la capacité de chimisorption d'hydrogène est inférieure sur les catalyseurs Pt–Zn/TiO2. Ils ont supposé que l'état SMSI (surface métal–support interaction) n'a pas été induit à cette température (200 °C). L'origine de cette faible capacité d'adsorption d'hydrogène peut être attribuée à une faible dispersion.
Caractéristiques des catalyseurs RA,Cl et RZA,Cl
| Catalyseurs | Zn/Rh | QHC (μmol gcatal−1) | QOT (μmol gcatal−1) | QHT (μmol gcatal−1) | DHC (%) | d (Å) |
| 1RA,Cl | 0 | 75,1 | 142 | 144,2 | 77,3 | 14 |
| 1RZA1,Cl | 1 | 61,9 | 130,2 | 117,5 | 61,9 | 17 |
| 1RZA2,Cl | 2 | 53,3 | 120,6 | 110,5 | 53,3 | 20 |
| 1RZA3,Cl | 3 | 49,5 | 104,0 | 100,7 | 49,5 | 22 |
| 1RZA4,Cl | 5 | 42,0 | 94,0 | 90,8 | 42,0 | 26 |
Les résultats montrent également que la quantité d'oxygène consommée pendant le titrage OT est supérieure à la quantité d'hydrogène consommée lors du titrage HT. L'excès de la quantité d'oxygène est attribué vraisemblablement à l'oxydation du zinc. De plus, en présence de Zn, la migration des molécules d'eau formées par OT et HT est lente, ce qui va bloquer les sites du rhodium. La quantité de molécules d'eau formées par titrage HT est supérieure à celle formée par titrage OT. Donc le blocage des sites de rhodium a augmenté. Cela explique la diminution de la quantité d'hydrogène pendant le titrage.
3.1.2.3 Effet de la température de reduction
Nous remarquons sur la Fig. 2, sur laquelle est reportée la variation de la dispersion en fonction de la température de réduction, que la dispersion du métal diminue lorsque la température de réduction, le rapport Zn/Rh et la teneur en métal augmentent. Ceci est attribué au frittage, qui est très favorisé à haute température de réduction. Ces résultats sont analogues à ceux trouvés par Silvestre-Alberto et al. [21]. Ces auteurs ont observé une diminution de la quantité d'hydrogène consommée de 14,2 à 0,12 sur les catalyseurs Pt/TiO2 et de 8,04 à 0,01 sur les catalyseurs Pt–Zn/TiO2 après réduction à 200 et 500 °C, respectivement.
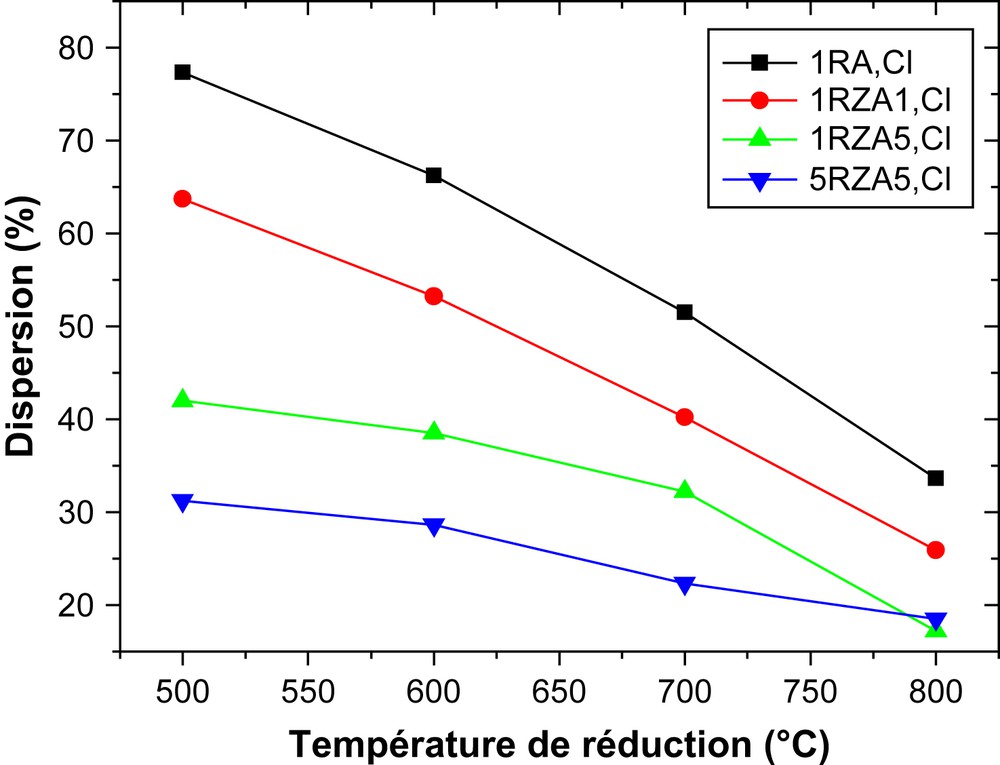
Variation de la dispersion en fonction de la température de réduction.
3.2 Désorption en température programmée
3.2.1 Effet de la teneur en métal sur la désorption d'hydrogène
Le Tableau 5 regroupe les résultats de caractérisation par désorption d'hydrogène de 25 à 500 °C. La température au maximum de désorption et la quantité d'hydrogène désorbée sur les catalyseurs chlorés et nitrés augmentent avec la teneur en rhodium. Dans tous les cas, nous n'avons observé qu'un seul pic de désorption d'hydrogène. Ceci indique la présence d'un seul site d'adsorption d'hydrogène. Dans un autre travail [17], quatre pics de désorption d'hydrogène ont été observés. Ces quatre pics correspondent à différentes espèces d'hydrogène de différentes stabilités, désorbant respectivement vers 110, 150, 230 et 350 °C. Cette différence est liée aux conditions de préparation.
Caractéristiques des catalyseurs RA (Cl) et RA (N)
| Échantillons | Tdés (°C) | (μmol atome gcatal−1) |
| 1RA,Cl | 171 | 9,56 |
| 5RA,Cl | 220 | 17,4 |
| 1RA,N | 147 | 1,71 |
| 5RA,N | 224 | 6,85 |
3.2.2 Effet du rapport atomique Zn/Rh
Les profils de désorption de l'hydrogène adsorbé à la surface des catalyseurs 1RA,Cl et 1RZA,Cl sont représentés sur la Fig. 3. Ces profils montrent un seul pic de désorption d'hydrogène situé entre 178 et 200 °C. Ce pic ne peut être attribué qu'à la quantité d'hydrogène désorbée à la surface du rhodium. Ce qui semble indiquer que le réactif est pratiquement adsorbé sous une forme unique sur RA,Cl ainsi que sur RZA,Cl.
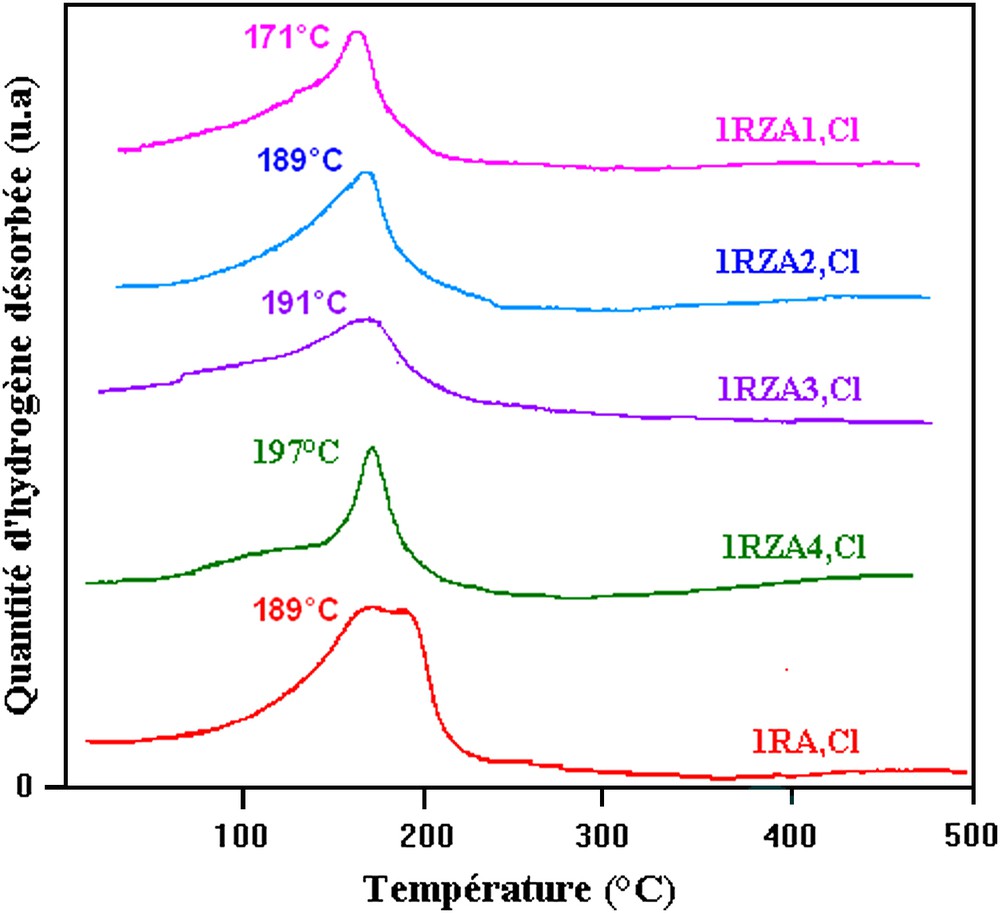
Spectres TPD de l'hydrogène sur 1RA,Cl et 1RZA,Cl.
Dans le Tableau 6, nous avons porté les quantités d'hydrogène désorbées (Qdés) et les températures de désorption (Tdés) dans les catalyseurs 1RA(Cl) et 1RZA (Cl), avec les différents rapports atomique Zn/Rh. Nous constatons que les quantités d'hydrogène désorbées sont supérieures sur les catalyseurs RA (Cl), et qu'elles diminuent avec l'addition de Zn. Ces résultats sont en accord avec ceux trouvés par la caractérisation Hc.
Caractéristiques des catalyseurs RA (Cl) et RA (N)
| Catalyseurs | Zn/Rh | Tdés (°C) | (μmol atome gcatal−1) |
| 1RA (Cl) | 0 | 171 | 47,80 |
| 1RZA (Cl) | 1 | 168 | 38,15 |
| 1RZA (Cl) | 2 | 177 | 33,60 |
| 1RZA (Cl) | 3 | 186 | 30,14 |
| 1RZA (Cl) | 5 | 196 | 28,78 |
3.3 Réduction en température programmée
L'étude de la réductibilité en température programmée pourrait apporter des informations intéressantes quant aux propriétés physicochimiques des catalyseurs [22], notamment les bimétalliques [23].
3.3.1 Effet du sel précurseur et de la teneur en métal
Nous avons étudié la réductibilité des catalyseurs 1RA et 5RA, préparés par des sels précurseurs contenant des chlorures ou des nitrates de rhodium. Les résultats obtenus sont rassemblés dans la Fig. 4. L'examen des profils obtenus sur les catalyseurs 1RA montre la présence de deux pics de réduction, qui ont pratiquement la même intensité, de telle sorte que le profil résultant est assez plat et s'étale sur toute la zone de réduction, avec un maximum de consommation d'hydrogène aux températures relativement basses, soit 250 °C pour 1RA,Cl et 184 °C pour 1RA,N. Ces pics sont attribués principalement à la réduction de l'oxyde de rhodium (Rh2O3). Ces résultats sont en accord avec ceux trouvés par TPD, qui confirment la présence d'un seul pic de désorption d'hydrogène. La valeur de la température de réduction maximale trouvée sur 1RA,Cl est identique à celle notée par Benseradj et al. [16], mais elle plus élevée que celle rapportée par Kacimi et Duprez (210 °C) [24] et par Ojeda et al. (150 °C) [25]. Cette différence de température de réduction est liée à la différence des conditions de préparation des catalyseurs.
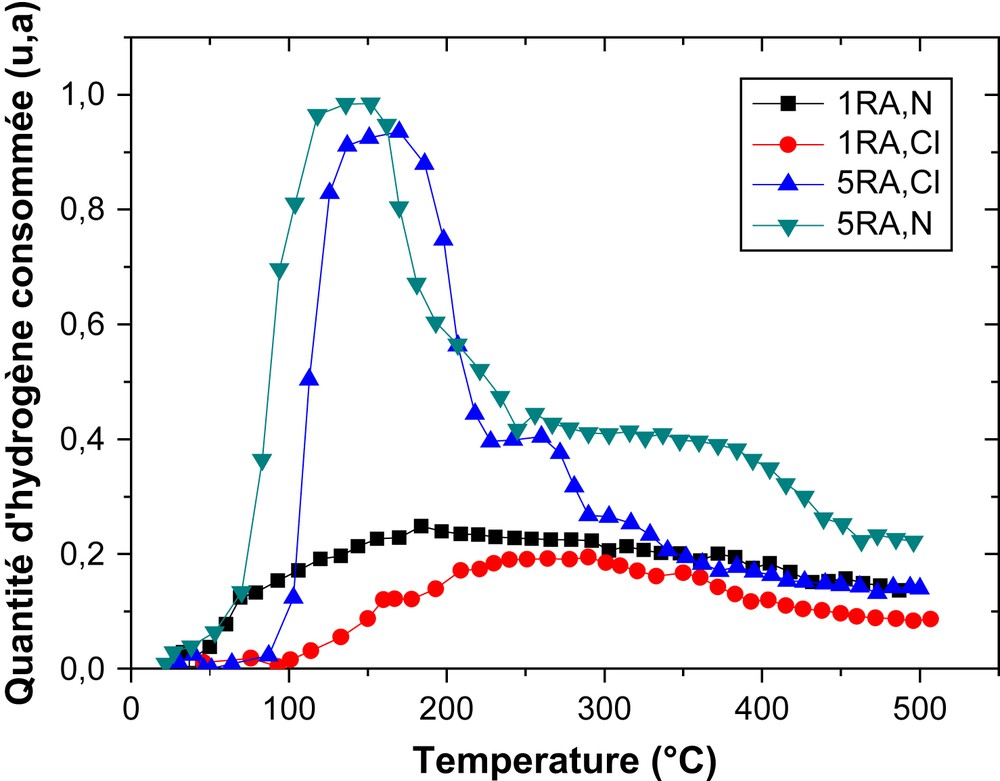
Profils TPR des catalyseurs RA,Cl et RA,N.
Nous constatons également l'existence de deux pics de réduction pour les catalyseurs 5RA. Le premier pic, bien visible et plus intense, apparaît à une température de 140 °C pour l'échantillon 5RA,N, et à 180 °C pour le catalyseur 5RA,Cl. Ces pics sont attribués à la réduction de l'oxyde de rhodium. Le deuxième pic, moins intense, apparaît à des températures supérieures à 200 °C. Il existe donc probablement une forme de rhodium en assez forte interaction avec le support. En comparant les profils des catalyseurs 1RA à ceux pour catalyseurs 5RA, on observe un déplacement de la position des pics de réduction dans les catalyseurs 5RA vers des températures relativement plus basses. Ceci est dû aux interactions métal–support.
3.3.2 Effet du rapport atomique Zn/Rh
La Fig. 5 présente les profils TPR obtenus sur la série de catalyseurs RZA,Cl (Zn/Rh = 1, 2, 3 et 5), ainsi que le profil du catalyseur RA,Cl. Nous notons un seul pic de consommation d'hydrogène. Ces résultats sont en accord avec ceux trouvé par la caractérisation en désorption en température programmée. Ces pics sont attribués à la réduction de l'oxyde de rhodium. De plus, nous observons un déplacement de la position des pics de réduction vers des températures relativement plus hautes (320–360 °C) avec les catalyseurs contenant du Zn, et ce quel que soit le rapport atomique Zn/Rh. Le zinc retarde donc la réduction du métal, ce qui est probablement dû aux interactions métal–support, ou à une modification des propriétés électroniques, ou encore à la réduction des phases formées entre le zinc et l'alumine, détectées par DRX.

Profils TPR des catalyseurs 1RA,Cl et 1RZA,Cl.
3.4 Diffraction des rayons X
Les spectres DRX des catalyseurs 5RA calcinés à 450 °C et réduits à 500 et 800 °C sont présentés sur la Fig. 6. Pour les catalyseurs 5RA,Cl et 5RA,N réduits à 500 °C, nous observons la présence de raies intenses, attribuées au support alumine. Ces résultats sont analogues à ceux trouvés par Ojeda et al. [25]. Dans un autre travail, Doi et al. [26] ont noté la présence, en plus de celle d'alumine, de rhodium et de la phase RhO2.
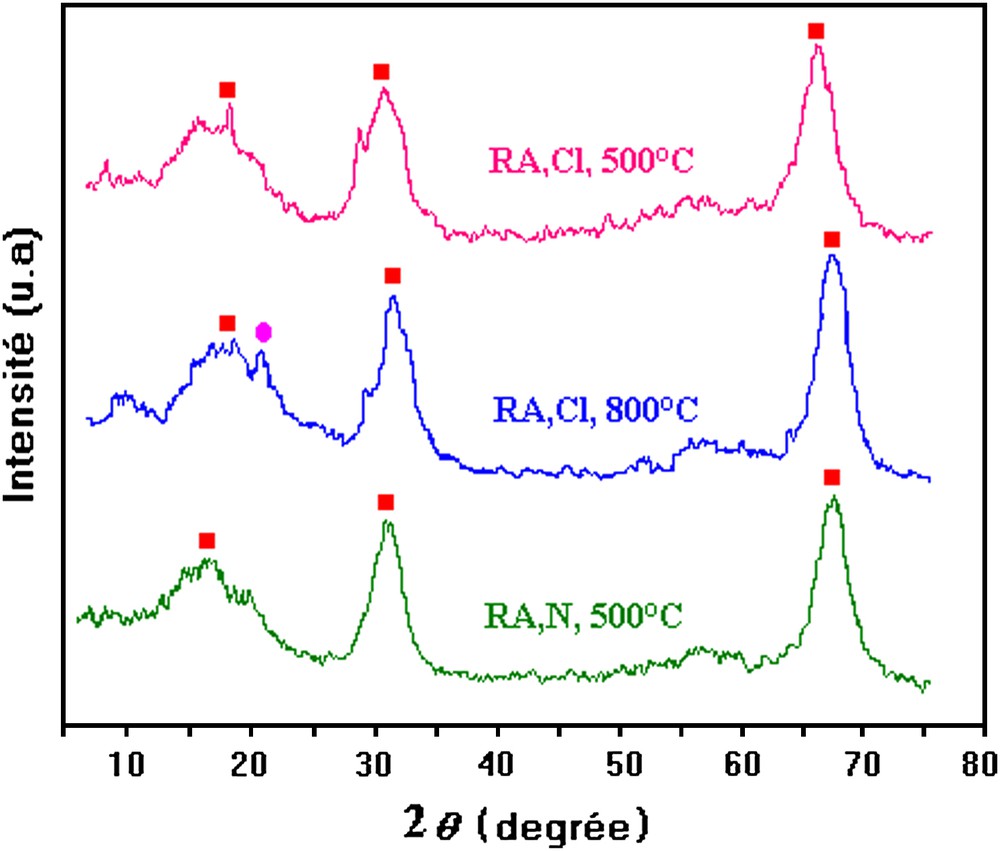
Spectres RDX des catalyseurs RA réduit à 500 et 800 °C. ■ : Al2O3,● : Al9Rh2.
Pour l'échantillon réduit à 800 °C, les réflexions dues au support alumine sont détectées. De plus, le rhodium interagit avec le support pour former Al9Rh2.
Les spectres DRX des catalyseurs 5RZA,Cl réduits à 500 et 800 °C, et du catalyseur RZA,N réduit à 800 °C, sont présentés sur la Fig. 7.
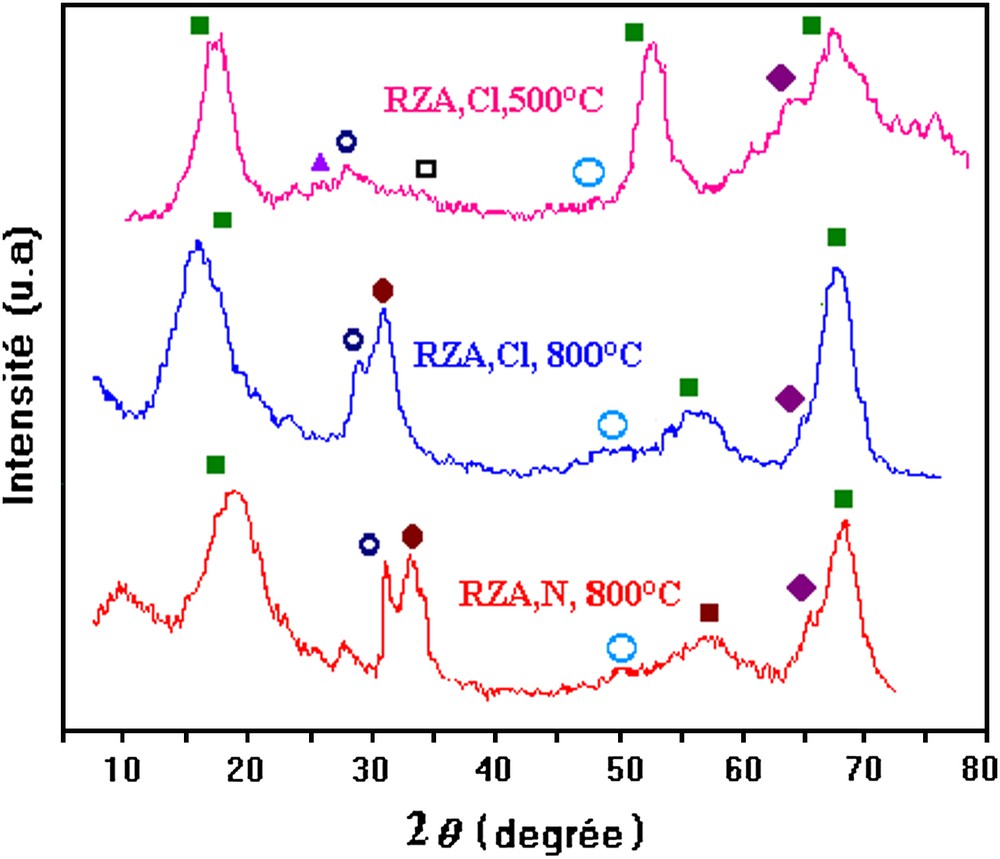
Spectres DRX des catalyseurs RZA. ■ : Al2O3, ○: ZnO, ●: ZnO2, : Al9Rh2, ▴ : Zn6Al2O, □: ZnAl2O4, ♦: Al0,71Zn0,29.
Pour tous les catalyseurs, des réflexions dues à l'alumine et à l'oxyde de zinc (ZnO) sont détectées. Pour ce dernier, une intensité plus importante est observée avec le catalyseur préparé à partir de nitrates. De plus, le zinc et le rhodium interagissent avec le support pour former les phases Al0,71Zn0,29 et Al9Rh2.
Pour le catalyseur RZA réduit à 500 °C, le zinc interagit aussi avec le support, pour former les phases ZnAl2O4 et Zn6Al2O.
Sur les catalyseurs RZA,Cl et RZA,N réduits à 800 °C, les raies caractéristiques de ZnO2 sont également observées.
3.5 MEB
Les Figs. 8 et 9 donnent le spectre d'analyse élémentaire de l'échantillon 1RA,Cl et 5RA,Cl. Une analyse détaillée du spectre MEB obtenu pour le catalyseur 1RA,Cl confirme la présence de ses constituants, à savoir Rh, Al, O et Cl, avec une intensité relativement plus importante pour l'aluminium et l'oxygène. Pratiquement les mêmes observations sont effectuées sur le spectre de l'échantillon RA à 5% en poids en métal.
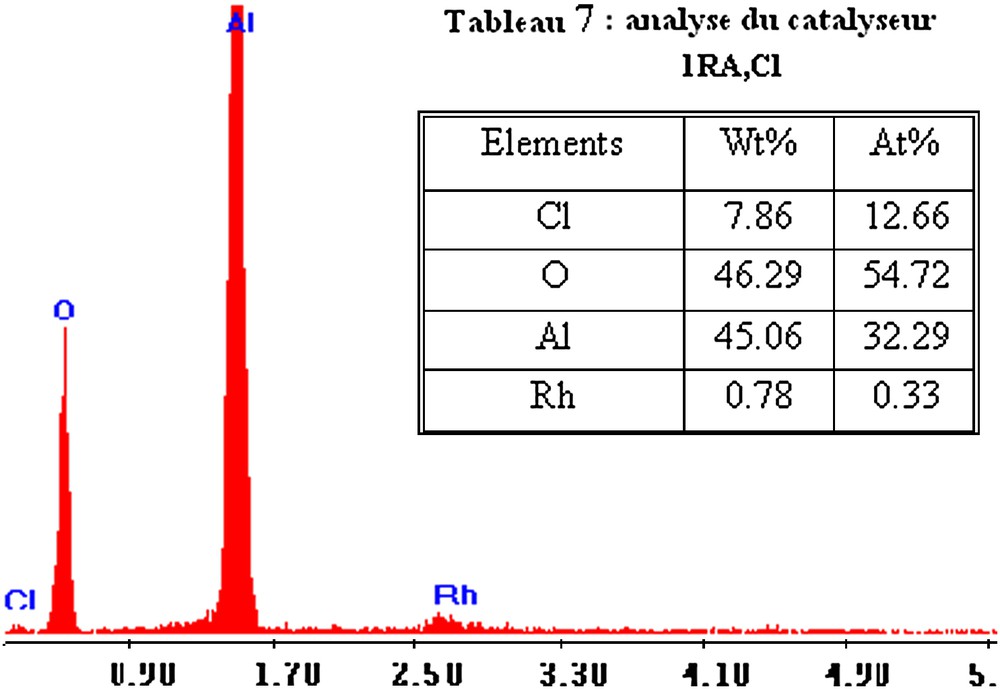
Analyse élémentaire du catalyseur 1RA,Cl.
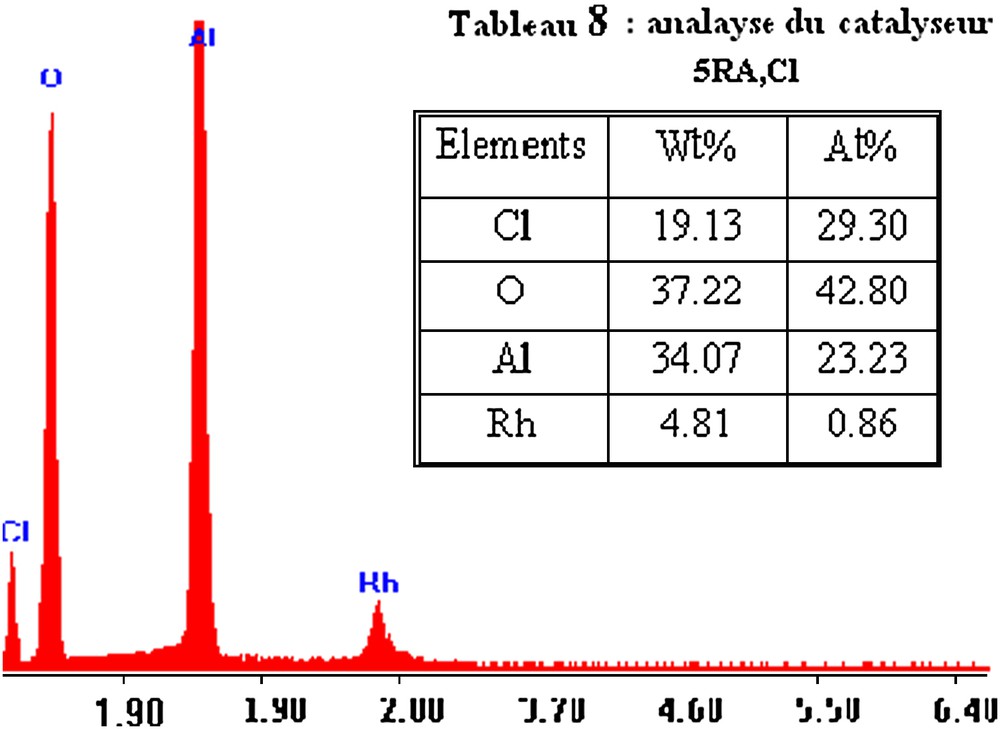
Analyse élémentaire du catalyseur 5RA,Cl.
Les Tableaux 6 et 7 présentent les pourcentages massiques et atomiques des constituants des catalyseurs 1RA,Cl et 5RA,Cl. Nous remarquons que le pourcentage en poids en rhodium est de 0,78% pour 1RA,Cl et est de 4,81% pour 5RA,Cl. Ces valeurs sont très proches de celles utilisées dans la préparation de ces catalyseurs, qui sont 1 et 5% en rhodium, respectivement.
Sur les spectres des catalyseurs RZA (Cl) (Figs. 10 et 11), on observe la présence des éléments Rh, Al, O, Cl et Zn. Nous remarquons également que l'intensité des pics augmente avec l'augmentation de la teneur en métal.
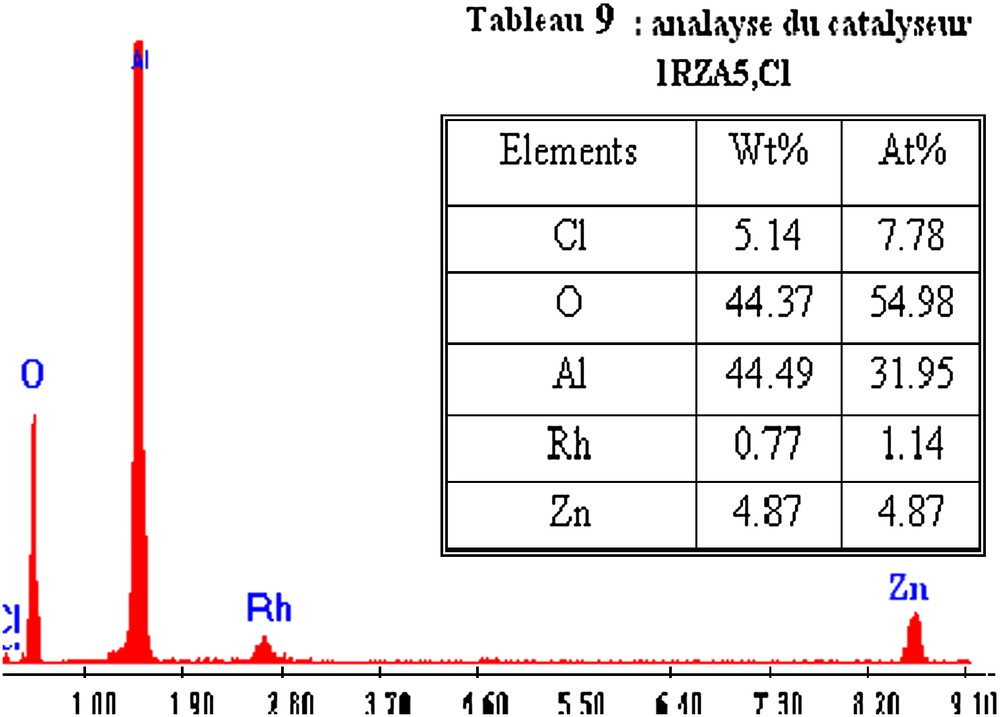
Analyse élémentaire du catalyseur 1RZA5,Cl.

Analyse élémentaire du catalyseur 5RZA5,Cl.
L'analyse élémentaire des catalyseurs RZA,Cl (Tableaux 8 et 9) montre que le pourcentage en poids en Rh est de 0,77% pour 1RZA,Cl et de 4,4% pour 5RZA,Cl. Ces valeurs sont proches de celles utilisées pour la préparation.
Les résultats montrent également que les rapports atomiques Zn/Rh obtenus sont de l'ordre de 4,27 pour 1RZA et de 4,16 pour 5RZA. Ces valeurs sont proches du rapport Zn/Rh = 5 utilisé pour la préparation de ces catalyseurs.
4 Conclusion
L’é'tude des catalyseurs à base de rhodium déposé sur alumine et sur zinc–alumine montre que la dispersion du métal est sensiblement affectée en présence de Zn. Les mesures de chimisorption d'hydrogène sur les catalyseurs RA et RZA ont montré que la quantité d'hydrogène consommée diminue lorsque le rapport atomique passe de 0 à 5 et lorsque la teneur en métal augmente de 1 à 5, et ce quel que soit le sel précurseur utilisé. La réduction à haute température diminue l'aptitude du catalyseur à chimisorber les molécules d'hydrogène. Cette diminution est probablement liée à un effet de frittage. Par ailleurs, l'étude de la réductibilité des catalyseurs montre que les catalyseurs préparés à partir de nitrates se réduisent plus rapidement que les catalyseurs préparés avec des chlorures. La caractérisation par la thermodésorption en température programmée (TPD) montre la présence d'un seul pic de désorption. Ceci semble indiquer que le réactif est pratiquement adsorbé sous une forme unique sur RA ainsi que sur RZA.


