1 Introduction
Les hétérocycles à 3 atomes tels que les aziridines ont de tout temps intéressé les chimistes à cause de la multitude de réactions chimiques et biochimiques où elles jouent le rôle de précurseurs ou d'intermédiaires réactionnels [1].
Plusieurs travaux ont montré que les nucléophiles, selon leur nature, attaquent soit le carbone CMe2 [2] soit le carbone CH2 [3] ou encore les deux sites carbonés [4] de l'hétérocycle des N-acyl-2,2-diméthylaziridines, amenant souvent à des mélanges. Cependant, l'ouverture régiospécifique de l'hétérocycle du côté du carbone le plus substitué CMe2 a été observée lors de l'utilisation d'acides de Broensted [5] ou d'acides de Lewis [6] ; les N-acylaziridines se transforment alors en amides et/ou en oxazolines correspondants.
Dans le but de mieux connaître et comprendre la réactivité intrinsèque des N-acylaziridines, nous avons thermolysé, en l'absence de tout autre réactif, diverses N-acyl-2,2-diméthylaziridines 1a–h. Nous avons choisi de multiplier les expériences de thermolyse des aziridines 1a–h pour détecter les phénomènes pourront régir la régiosélectivité ou la régiospécificité de la rupture de la liaison C–N.
2 Résultats et discussions
Hormis l'aziridine 1h qui se singularise par la présence d'un substituant phényle sur le carbone C3 de l'hétérocycle, les aziridines étudiées 1a–g diffèrent par la nature du groupe acyle porté par l'atome d'azote. Les composés 1a–c portent des substituants éthyle, benzyle et dihydrocinnamoyle ne pouvant pas engendrer une quelconque conjugaison avec le doublet libre de l'azote. Par contre, les aziridines 1d–g portent des substituants conjugués choisis pour nous renseigner sur les effets électroniques susceptibles d'orienter la réaction de thermolyse étudiée.
Les résultats obtenus montrent clairement que la transformation ou non des N-acylaziridines 1 en N-méthallylamides 2 et/ou oxazolines 3 dépend à la fois de la nature des substituants R et R′ et des conditions expérimentales suivies (Schéma 1).
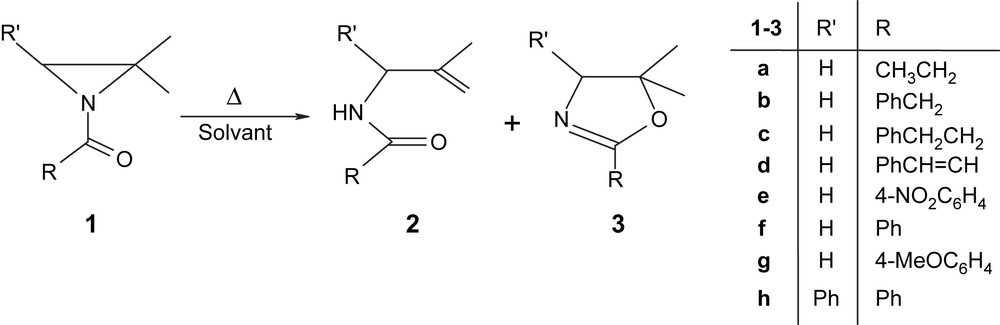
Réactions de thermolyse de N-acylaziridines 1 en N-méthallylamides 2 et oxazolines 3.
Le reflux dans le toluène pendant deux jours permet dans tous les cas de réaliser une réaction complète et hautement sélective quelque soit la nature des substituants R et R′ (Schéma 1). Dans ces conditions, les aziridines 1a–h sont en effet transformées exclusivement dans ce solvant peu polaire en leurs isomères 2a–h (Tableau 1).
Thermolyse de N-acylaziridines 1 en N-méthallylamides 2 dans le toluène (110 °C, 48 h)
| Entrée | Aziridine | 2 (%) |
| 1 | 1a | 82 |
| 2 | 1b | 100 |
| 3 | 1c | 100 |
| 4 | 1d | 100 |
| 5 | 1e | 100 |
| 6 | 1f | 100 |
| 7 | 1g | 100 |
| 8 | 1h | 100 |
Les produits de la réaction ont été identifiés par comparaison de leurs spectres IR et RMN 1H avec ceux des composés connus [5a,7]. Les rendements sont calculés pour les produits isolés, après purification par chromatographie.
Les résultats collectés dans le Tableau 2 montrent que la N-cinnamoylaziridine 1d se transforme partiellement en N-méthallylamide 2d pendant 19 heures dans l'acétone ou la butanone à 56 °C alors que l'aziridine 1h trisubstituée ne réagit pas dans ces conditions. De plus, l'aziridine 1g, portant un groupe conjugué électrodonneur sur le phényle, se comporte comme l'aziridine 1h. Cependant, l'aziridine 1e, portant un groupe conjugué électroattracteur sur le phényle, conduit au N-méthallylamide 2e de rendement dépendant de la nature du solvant.
Thermolyse de N-acylaziridines 1 en N-méthallylamides 2 dans l'acétone et la butanone (56 °C, 19 h)
| Entrée | Aziridine | Solvant | 2 (%) |
| 9 | 1d | Acétone | 26 |
| 10 | 1d | Butanone | 26 |
| 11 | 1e | Acétone | 7 |
| 12 | 1e | Butanone | 13 |
| 13 | 1g | Acétone | 0 |
| 14 | 1g | Butanone | 0 |
| 15 | 1h | Butanone | 0 |
Par contre, la N-benzoyl-2,2-diméthylaziridine 1f conduit à un mélange de N-méthallylbenzamide 2f et de 5,5-diméthyl-2-phényloxazoline 3f, dans ces deux solvants polaires à des températures et temps variables. Le composé 2f reste néanmoins le produit majoritaire (Tableau 3).
Thermolysea de la N-benzoyl-2,2-diméthylaziridine 1f en N-méthallylamide 2f et oxazoline 3f en fonction du solvant, de la durée et de la température
| Entrée | Solvant | T (°C) | t (h) | 2 (%) | 3 (%) |
| 16 | Acétone | 56 | 19 | 16 | 16 |
| 17 | Butanone | 56 | 19 | 17 | 8 |
| 18 | Butanone | 80 | 3.5 | 10 | 4 |
| 19 | Butanone | 80 | 48 | 63 | 23 |
a Dans toutes les expériences, 2 mmol de réactif sont dissoutes dans 50 mL de solvant anhydre.
La comparaison des résultats de la thermolyse des N-aroyl-2,2-diméthylaziridines 1e,f,g (Tableaux 2 et 3) suggère que la conjugaison du groupe aromatique avec le groupe carbonyle modifie la réactivité. Cependant ce n'est pas le seul critère. La configuration de l'aziridine thermolysée, l'effet de solvatation et la basse température, stabilisant les aziridines 1e et 1g, pourraient être à l'origine de l'inhibition de l'effet mésomère.
Il est aussi rapporté dans la littérature [8] que les 6-azabicyclo[3.1.0]hexanes 4 se réarrangent en un mélange d'allylamides 5 et/ou oxazolines 6 de rendement dépendant de la nature du groupe aroyle porté par l'azote du cycle aziridine (Schéma 2).

Formation d'allylamides et d'oxazolines par thermolyse d'aziridines bicycliques.
D'autre part, l'obtention d'un mélange des produits 2f et 3f après chauffage de 1f dans la butanone à reflux pendant seulement 3,5 h (Tableau 3, entrée 18) suggère que ces deux composés se forment en même temps à partir de 1f. La récupération complète de l'oxazoline 3f, après un chauffage dans la butanone à reflux pendant deux jours, prouve que celle-ci ne se transforme pas en N-méthallylamide 2f dans ces conditions. Cette hypothèse est confirmée par les résultats de Fanta [8]. En effet, cet auteur a montré que la N-méthallylamide 5 et l'oxazoline 6 ne s'isomérisent pas thermiquement en d'autres produits (Schéma 2).
L'obtention quantitative de la N-(1-phényl-méthallyl) benzamide 2h à partir de la N-benzoyl-2,2-diméthyl-3-phénylaziridine 1h (Tableau 1, entrée 8) est un résultat surprenant puisqu'on pourrait s'attendre à la formation de mélange de N-méthallylamides et d'oxazolines résultant de l'ouverture du cycle aziridine 1h du côté du carbone aliphatique tertiaire et du côté du carbone benzylique secondaire. Néanmoins, l'ouverture hautement régiospécifique du côté du carbone CMe2 a été déjà remarquée lors de l'isomérisation totale de l'aziridine 1h par l'acide sulfurique concentré en 5,5-diméthyl-2,4-diphényloxazoline faisant intervenir le carbocation aliphatique tertiaire [5a]. L'absence de produit d'ouverture du côté du carbone CHPh pourrait être interprétée en se basant sur l'étude de la conformation la plus stable de 1h [9].
Nous avons vérifié l'existence de cette conformation privilégiée par des calculs théoriques DFT/B3LYP en utilisant le programme Gaussian 98 [10]. Cette étude théorique montre que l'angle dièdre β formé par les quatre atomes (O)C–N–CMe de l'aziridine 1h possédant un azote pyramidal [11], est faible et égale à 19,63° (Fig. 1). Un atome d'hydrogène d'un des groupes méthyle est donc proche de l'atome d'oxygène du groupe amide (2,5 Å) et une légère interaction existerait entre ces deux atomes. La liaison CMe2–N serait ainsi rendue plus fragile et donc plus apte à se couper que la liaison PhCH–N.
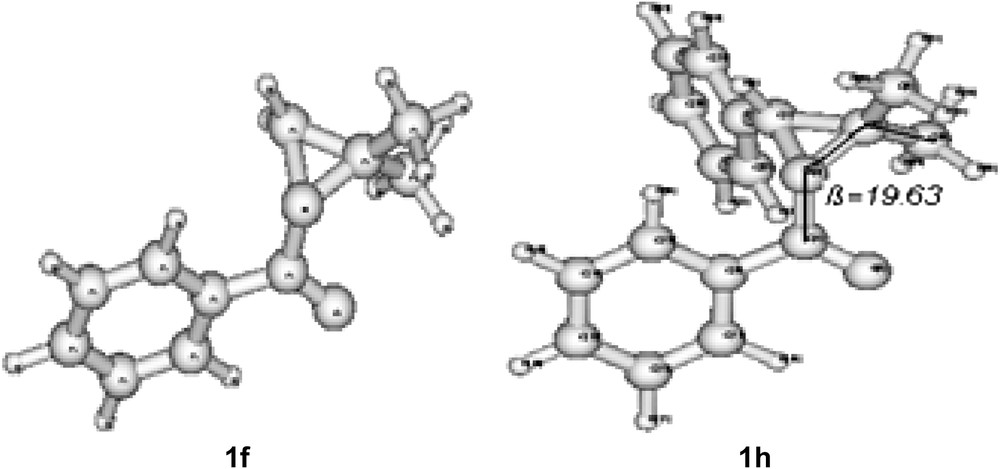
Conformations les plus stables de 1f et 1h déterminées par le programme Gaussian 98.
Il est intéressant de noter que quelque soit le ou les produits isomères obtenus, 2 et/ou 3, leurs structures montrent que leur obtention est toujours une conséquence de l'ouverture régiospécifique du cycle aziridine 1 du côté du carbone CMe2.
Plusieurs mécanismes ont été proposés pour interpréter ces réactions de thermolyse de N-acylaziridines 1 [12,13]. Heine a proposé un mécanisme via une coupure hétérolytique de la liaison CMe2–N du cycle aziridine 1 [12]. La formation d'oxazolines 3 serait issue d'une cyclisation intramoléculaire (Schéma 3, voie a). Cependant, en se basant sur l'étude cinétique et thermodynamique de la thermolyse de l'aziridine 1e en N-méthallylamide 2e dans le diglyme à différentes températures (72, 86 et 101 °C), Fanta [13b] a montré que la cinétique de cette réaction est de premier ordre et que son entropie d'activation est largement négative. De ce fait, il a proposé un intermédiaire à six chaînons dans lequel il y aurait une élimination concertée d'un atome d'hydrogène (Schéma 3, voie b).

Mécanismes proposés par Fanta et Heine relatifs à l'isomérisation thermique de 1 en produits 2 et 3.
L'analyse de la structure géométrique de 1f [10] montre sans ambiguïté que la géométrie optimisée de l'aziridine 1f est en parfait accord avec les données structurales citées dans la littérature [14]. En effet, la longueur de la liaison C–N de l'hétérocycle aziridine (1,455 Å < dC–N < 1,475 Å) est largement supérieure à celle de la double liaison CN (dCN = 1,29 Å) des imines et proche d'une simple liaison C–N (dC–N = 1,47 Å) des amines.
Le mécanisme péricyclique de type rétro-ène thermique semble alors difficilement envisageable car il est contredit par le fait que les N-acyl-2,2-diméthylaziridines 1a–h ne peuvent pas être assimilées à un système diènique conjuguée favorisant ainsi un transfert d'hydrogène.
A la lumière des résultats de la littérature et de nos travaux, nous pouvons avancer un mécanisme purement ionique. La première étape de la réaction serait ainsi une rupture hétérolytique de la liaison CMe2–N du cycle aziridine. L'intermédiaire zwitterionique 1′ ainsi formé pourrait évoluer soit par cyclisation de la partie amidate vers le carbocation aliphatique tertiaire pour conduire à l'oxazoline 3 (Schéma 4, voie a). Soit par arrachement d'un proton d'un des groupes méthyle par l'anion amidate pour conduire après prototropie au N-méthallylamide 2 (Schéma 4, voie b).
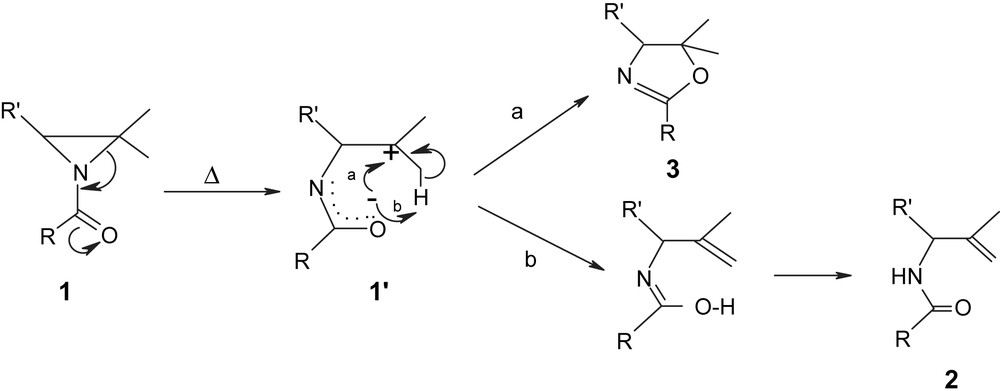
Compétition entre l'attaque nucléophile et l'arrachement du proton du zwitterion 1′.
La compétition entre la nucléophilie et la basicité de cet zwitterion 1′ est particulièrement apparente avec la formation de 2f et 3f à partir de 1f. 2f est bien le produit majoritaire comme le montre les résultats du Tableau 3.
Pour se rapprocher plus de la réalité, nous avons jugé nécessaire de notre part d'étudier théoriquement les composés intervenant dans la thermolyse de l'aziridine 1f sans les modéliser dans le but de comprendre l'origine de la régiospécificité [10]. Afin d'approfondir cette hypothèse, nous avons calculé les énergies d'activation à travers la détermination de la structure des états de transition.
La rupture de la liaison CMe2–N de l'aziridine 1f forme un complexe activé ET1. Dans ET1 l'oxygène est devenu plus négatif (−0.42) alors que le cabone CMe2 est légèrement positif (0.01). En effet, cet état de transition ET1 est proche du zwitterion 1′ proposé dans le Schéma 4, permettra à l'oxygène de se rapprocher à la fois du carbone C2 (dO–C2 = 2,99 Å) de l'hydrogène d'un des groupes méthyles (dO–H = 1,50 Å).
La formation des produits 2f et 3f avec des rendements différents révèle que la réaction de thermolyse de l'aziridine 1f peut s'interpréter par une compétition cinétique/thermodynamique (Fig. 2). L'attaque rapide de l'oxygène du groupe carbonyle sur le carbone CMe2 formerait l'oxazoline 3f qui est le produit cinétique de cette réaction.

Profil énergétique de la thermolyse de la N-benzoyl-2,2-diméthylaziridine 1f.
En compétition avec cette action, la réaction peut passer à travers l'état de transition ET2 qui est caractérisé par la formation avancée de la liaison OH. Une tautomérie acide imidique/amide permet d'aller à l'état de transition ET3 à travers le passage par l'intermédiaire réactionnel I. Dans ET3, les principales liaisons NH, CC, CO sont presque formées et cet état permet de passer facilement au N-méthallylamide 2f, produit thermodynamique de la réaction (Fig. 3).
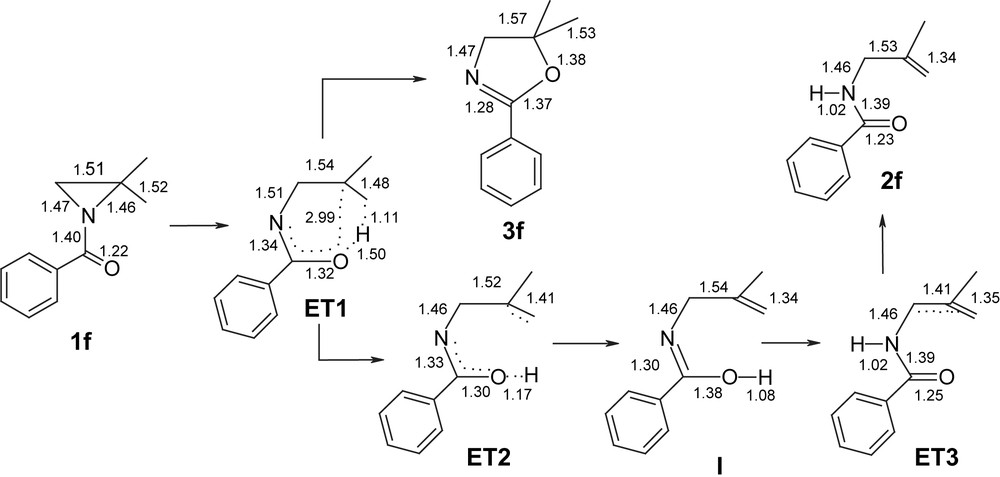
Principales caractéristiques géométriques (distances en Å) des composés intervenant dans la réaction de thermolyse du N-benzoyl-2,2-diméthylaziridine 1f.
3 Conclusion
Au vue de nos résultats présentés ici et des résultats de la littérature, nous avons présenté dans un premier stade un mécanisme purement ionique passant par un zwitterion pour expliquer la formation des divers produits observés lors du réarrangement thermique de N-acylaziridines. Nous avons ensuite étayé ce mécanisme par une contribution théorique qui fait intervenir trois étapes de transition et un intermédiaire réactionnel.
Remerciements
Nous remercions le professeur André Laurent de l'Université Claude Bernard Lyon I pour l'intérêt qu'il a apporté à l'origine de ce travail.


