1 Introduction
L’ion Mn2+, analogue du calcium, peut se substituer à celui-ci dans les cellules, en particulier au niveau du système nerveux central (SNC). Cet ion étant paramagnétique, son internalisation en fait un bon candidat en tant qu’agent de contraste, notamment T1, en imagerie de résonance magnétique (IRM) dans le cas d’études expérimentales.
Les études cérébrales constituant un pan très important de l’IRM expérimentale, de nombreuses techniques et protocoles ont été mis en œuvre pour observer le cerveau, que ce soit chez un animal sain ou modèle de maladie. La grande majorité de ces études ont été réalisées chez l’animal adulte. Les études cérébrales chez l’animal immature nécessitent d’accroître le pouvoir de résolution spatiale et conjointement la sensibilité de la méthode. L’augmentation du champ magnétique d’observation est une réponse à ces problèmes, mais elle réduit le contraste en T1 des tissus cérébraux et l’utilisation de l’imagerie par contraste renforcé au manganèse (manganese enhanced-magnetic resonance imaging [MEMRI]) devrait permettre de surmonter cette difficulté. Dans ce document, nous ferons un rapide rappel des propriétés physiologiques du manganèse, de son utilisation en RMN et en IRM et des problèmes posés par l’étude IRM des animaux immatures. Nous aborderons ensuite les différentes applications du MEMRI chez l’animal adulte et nouveau-né.
2 Manganèse et résonance magnétique nucléaire
2.1 Rôle du manganèse en physiologie et toxicité
Le manganèse est naturellement présent dans les sols, l’eau et dans tous les organismes vivants. La configuration électronique externe de l’atome de manganèse comprend sept électrons, cinq au niveau 3d et deux au niveau 4s, il peut donc se présenter sous différents degrés d’oxydation. Dans les tissus vivants le manganèse est présent sous forme Mn2+, Mn3+, Mn4+, mais, en raison de la configuration externe particulièrement stable (3 d5) de l’ion Mn2+, la plus grande partie des complexes du manganèse présentent cet état de valence. Le manganèse est un oligo-élément indispensable au fonctionnement normal d’un grand nombre de processus physiologiques. Il est notamment impliqué dans le métabolisme des sucres, des acides aminés et des lipides. Il joue un rôle important au niveau des systèmes nerveux et immunitaire, de la régulation énergétique cellulaire, de la formation des os et des tissus conjonctifs et de l’activation de certaines enzymes. Ainsi, au niveau cérébral, c’est un cofacteur important de la superoxide-dismutase et d’enzymes impliquées dans la synthèse et le métabolisme de neurotransmetteurs [1]. Bien qu’il soit un élément indispensable au bon fonctionnement de l’organisme, le manganèse est connu comme neurotoxique chez l’homme depuis le xixe siècle [2]. Une exposition chronique à niveau élevé au manganèse provoque le manganisme, maladie professionnelle dont le syndrome est proche de celui de la maladie de Parkinson [1,3].
2.2 Manganèse, RMN et IRM
Cet ion, paramagnétique, induit des variations des temps de relaxation des noyaux qui l’environnent. Cette propriété a été utilisée très tôt en RMN, notamment par Connick et Poulson [4], pour mesurer la vitesse d’échange de l’eau entre l’intérieur et l’extérieur de la première sphère de coordination du Mn2+. Ces effets de relaxation intervenant dans l’interaction Mn2+/ macromolécules ont ouvert la voie à des études RMN structurales [5,6]. Cette approche est toujours utilisée, comme le montrent de récentes études sur les macromolécules [7–12]. Par ailleurs, l’observation des échanges de molécules de solvant entre les sphères de solvatation de l’ion manganèse entraînant des modifications des temps de relaxation des noyaux du milieu environnant, a permis de mettre en place les concepts utilisés pour l’élaboration d’agents de contraste de relaxation. Lauterbur, pour sa part, a utilisé le Mn2+ pour montrer que les effets de relaxation peuvent modifier l’intensité du signal [13] ouvrant la voie à l’IRM et à l’utilisation de produits de contraste exogènes [14].
L’ion manganèse est effectivement un puissant agent de contraste, réduisant de manière drastique les temps de relaxation des noyaux de l’eau située dans son environnement (par exemple, à 7 T, les relaxivités r1 et r2 du Mn2+ en solution isotonique sont respectivement 6,2 ± 1,5 mM−1s−1 et 155 ± 10 mM−1s−1) et qui présente l’avantage d’être internalisé par les cellules. On peut remarquer que la relaxivité r1 du Mn2+ à 7 T est du même ordre de grandeur que celles des chélates de gadolinium à 0,5 T, utilisés comme agents T1 à bas champ [15]. Le manganèse, contrairement à ces dérivés de gadolinium, peut être utilisé comme agent de contraste T1 à des champs plus élevés, dans le cadre d’études expérimentales. Analogue du calcium (Ca2+), il a un comportement similaire, notamment dans les neurones où il pénètre essentiellement par les canaux calciques de type L [16]. Il est ensuite séquestré dans le réticulum endoplasmique et cumulé pour le transport, qui s’effectue le long des microtubules jusqu’aux synapses où il est libéré, puis capturé par les autres neurones (Fig. 1). Cette analogie avec le calcium explique la neurotoxicité du manganèse, toxicité qui interdit son utilisation sous forme de sel comme agent de contraste en clinique. Pour la clinique, un chélate a été développé, le Mangafodipir Trisodium (Teslascan®). C’est un agent de contraste hépatobiliaire [17], qui est aussi utilisé en imagerie du pancréas [18]. Des études sur de nouveaux agents [19,20], notamment à but théragnostique [21] sont en cours. Ces agents n’étant plus des analogues du calcium, n’auront plus des mêmes possibilités d’internalisation dans les cellules, notamment les neurones.
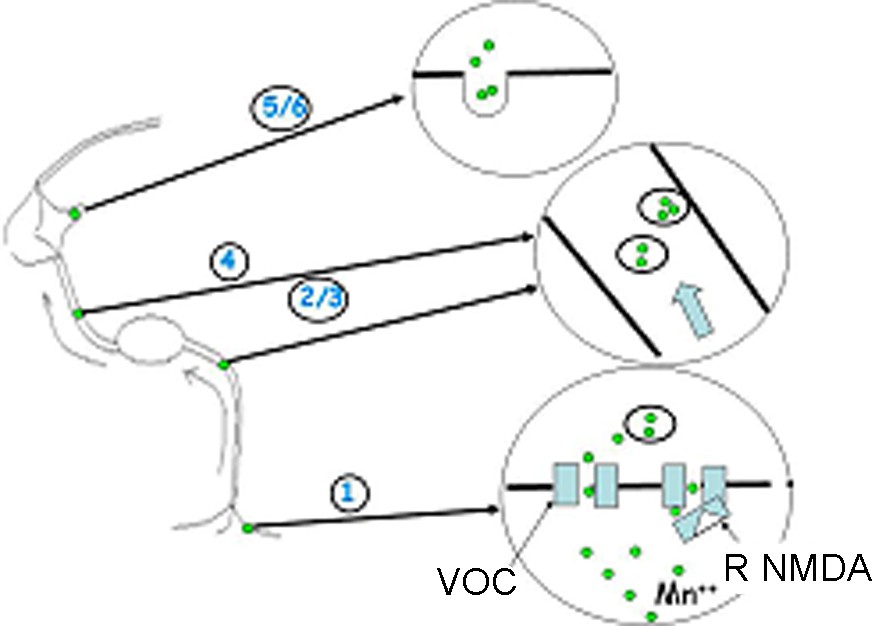
Schéma du transport de manganèse dans un neurone. 1. Entrée par canaux de Ca2+ de type L (et éventuellement par les canaux VOC et NMDA). 2/3. Séquestration dans le réticulum endoplasmique et cumul pour le transport. 4. Transport dans l’axone le long des microtubules. 5/6. Libération dans les synapses et recapture par les autres neurones.
Sous forme cationique, le manganèse ne peut pas être utilisé comme agent de contraste chez l’homme, mais, sous certaines conditions, le chlorure de manganèse peut l’être pour des études expérimentales. Le manganèse peut être administré par voie systémique : en injections intrapéritonéale (IP), intramusculaire, sous-cutanée ou intraveineuse ou par voie orale. Il diffuse alors dans l’ensemble de l’organisme et se trouve capté également dans le tissu cérébral. Une autre voie d’administration consiste à injecter le manganèse directement dans une structure cérébrale. Les doses toxiques de manganèse dépendent du mode d’administration. Les doses limites pour les différents types d’administrations systémiques sont connues chez l’animal adulte [22]. Ainsi, chez le rat adulte la dose toxique (LD50) est de 250 mg/kg par voie orale, de 147 mg/kg par voie IP et de 92,6 mg/kg par voie intraveineuse et chez la souris adulte elle est de 121 mg/kg en injection IP et de 38 mg/kg en injection intraveineuse. En règle générale, les expériences d’IRM requièrent des doses de chlorure de manganèse inférieures aux doses toxiques [22]. Lors d’études longitudinales, on peut fractionner les doses administrées afin de garder les effets de contraste du manganèse en minimisant ces effets toxiques [23]. L’élimination du manganèse des tissus cérébraux peut être suivie de manière fiable par l’observation des variations de T1 et T2 de ces tissus [24]. En ce qui concerne les injections intracérébrales chez le rat, Canals et al. ont mis au point un protocole expérimental permettant de minimiser, voire d’annuler, les effets néfastes du manganèse : infusion d’une solution 100 mM de MnCl2 ; une quantité totale injectée inférieure ou égale à 16 nmol évite la mort neuronale, inférieure ou égale à 8 nmol ne provoque pas de réaction gliale [25].
3 Imagerie de résonance magnétique du cerveau en développement
Si un nombre impressionnant d’études ont été réalisées par IRM sur différents modèles expérimentaux de maladies neurodégéneratives, de tumeurs et de lésions de type ischémique ou traumatique ou d’effets de modifications génétiques au niveau cérébral chez l’adulte, relativement peu d’études ont trait à des expériences sur les animaux immatures. Les études sur le nouveau-né ont porté sur le développement cérébral soit prénatal, comme par exemple une étude ex vivo sur les effets de l’alcool sur les structures cérébrales fœtales [26], soit postnatal, dans le cas de souris génétiquement modifiées [27,28] et surtout sur les effets de processus d’hypoxie-ischémie périnataux car, à l’heure actuelle, ils restent l’une des principales causes de morbidité chez le nouveau-né. Ces études sont principalement basées sur des techniques de pondération T1, T2 où de diffusion [29–33]. Les résultats obtenus ont suscité le besoin d’atlas d’IRM de référence de l’embryon et du nouveau-né sain pour pouvoir différencier les effets dus au développement cérébral normal de ceux dus aux mutations ou aux lésions chez le rat et la souris [34–38] en utilisant des pondérations T1, T2 et diffusion, mais aussi des études par imagerie du tenseur de diffusion [39,40]. Cette dernière technique permet de déterminer l’orientation des fibres nerveuses et donc d’obtenir une cartographie anatomique de l’organisation du tissu cérébral.
Un des principaux freins à ces études sur l’animal immature était la petite taille de l’objet à étudier qui nécessite une augmentation du pouvoir de résolution de la méthode, et, par conséquent, une augmentation de la sensibilité de la mesure, rendues possibles par l’utilisation de hauts champs (de 7 à 17,6 T). Toutefois, ce gain de rapport signal-sur-bruit se fait, en ce qui concerne le cerveau, au détriment du contraste, particulièrement du contraste en T1, d’autant plus que les différences matière grise–matière blanche sont beaucoup plus faibles chez le nouveau-né que chez l’adulte [41]. En ce qui concerne les lésions suivant une hypoxie-ischémie, l’utilisation des techniques classiques de pondération T1, T2 ou diffusion permet de détecter les lésions seulement pendant la phase aigue [42]. L’utilisation du manganèse devrait permettre de compenser cette perte de contraste et d’obtenir, en association avec une approche DTI, des images de type anatomique et de suivre à moyen et long terme la plasticité cérébrale lors du développement cérébral et, en pathologie, des remodelages des réseaux neuronaux fonctionnels.
4 Imagerie de résonance magnétique par contraste renforcé par le manganèse : applications aux études cérébrales expérimentales
La capacité du Mn2+à se substituer au Ca2+autorise son utilisation en IRM par contraste renforcé par le manganèse pour trois types d’application à des études cérébrales expérimentales :
- • la détermination de la neuro-architecture ;
- • l’étude fonctionnelle ;
- • le traçage des réseaux neuronaux.
4.1 Détermination de la neuro-architecture
Les différences de capacité à capter le manganèse par les différentes structures et sous-structures cérébrales ont permis de mettre en évidence une cyto-architecture fine du cerveau des rongeurs : par exemple, il est possible de mettre en évidence différentes couches cellulaires au niveau de bulbe olfactif, de l’hippocampe, du cortex et du cervelet [43]. Ce type d’étude a souvent été réalisé après des administrations systémiques de manganèse chez l’animal adulte. Le manganèse pénètre alors essentiellement dans le cerveau, non pas au travers de la barrière hémato-encéphalique, mais via les plexus chloroïdes, situés au niveau des ventricules. Les effets du manganèse sur le contraste de l’image perdure jusqu’à 48 heures. Cette variation de contraste est reliée à différents facteurs comme une activité fonctionnelle locale, le transport neuronal, la capacité des cellules gliales à capter le manganèse, la distribution d’enzymes « manganèse-dépendantes ».
En ce qui concerne le développement cérébral, ce type d’étude permet de suivre en parallèle le développement anatomique cérébral de souris normales ou génétiquement modifiées. Une injection systémique de manganèse permet effectivement de mieux définir les structures ou sous-structures cérébrales, en particulier dans le cervelet (Fig. 2). Ainsi, Wadghiri et al. [41] ont montré l’efficacité de l’approche MEMRI à 7 T pour mettre en évidence des défauts structuraux au niveau du cervelet de souris KO pour Gbx2 âgées de deux à 15 jours, par injection IP de manganèse (40 mg/kg) et acquisition 3D d’expériences en écho de gradient pondérées T1. Une étude comparative MEMRI in utero et histologie a permis de montrer que, des expériences 3D d’écho de gradient pondérées T1 acquises de manière synchrone à la respiration de la femelle gestante 24 heures après une injection intrapéritonéale de manganèse (20–80 mg/kg), autorisaient la segmentation du SNC d’embryons de souris, l’étude de son développement entre E12,5 et E17,5 et la distinction de différentes structures cérébrales. En particulier, une diminution du septum et une augmentation des ganglions basaux ont été observés chez les embryons de souris KO pour Nkx2,1 dès E14,5 [44]. Les contrastes au niveau du cerveau provoqués par une administration systémique de manganèse sont généralement maximaux à 24 heures. Bien que le mécanisme d’internalisation dans le SNC ne soit pas encore établi avec certitude, les doses utilisées pour les embryons et les nouveau-nés sont suffisantes pour permettre leur survie pendant au moins 24 heures et prouver l’intérêt des études de phénotypes par MEMRI in vivo.

Effet d’une injection intrapéritonéale de manganèse. L’acquisition des images a été réalisée sur des ratons âgés de neuf jours, sans injection de manganèse (colonne de gauche) ou 24 heures après injection de manganèse (colonne de droite), à 9,4 T. A. Modification du contraste en T2 au niveau du cervelet (TurboRARE temps de répétition/temps d’écho = 4000/50 ms). B. Modification du contraste en T2 (1 et 3) et en T1 (2 et 4). Pondération T2 : TurboRARE TR/TE = 4000/50 ms. Pondération T1 : MP RAGE temps de répétition/temps d’inversion–récupération = 7500/1000 ms. Au niveau cortical, l’intensité du signal dans les zones a et b (rapportée à une référence extérieure) varie après addition de manganèse. En pondération T2, avant injection de manganèse (1) Ia/Ir = 0,63 et Ib/Ir = 0,74. Après injection IP de manganèse (3), on observe une baisse d’intensité Ia/Ir = 0,51 et Ib/Ir = 0,62 correspondant à une baisse du T2 induite par la présence de manganèse au niveau cérébral. En pondération T1, avant injection de manganèse (2) Ia/Ir = 0,7 et Ib/Ir = 1,5. Les mesures de T1 montrent une faible différence de T1 entre ces deux zones T1a = 1,7 s et T1b = 1,8 s. Après injection de manganèse (4) Ia/Ir = 1,16 et Ib/Ir = 0,70. Les valeurs de T1 correspondantes sont T1a = 1 s et T1b = 1,4 s, ce qui traduit le fait que le manganèse est en concentration plus élevée dans la zone a que dans la zone b. La différence d’intensité observée entre ces deux zones lors de l’expérience d’inversion–récupération, correspond au fait que le temps de récupération de 1 s, est voisin du temps d’annulation du signal pour un T1 de 1,4 s, alors que ce temps est proche de 0,7 dans le cas d’un T1 de 1 s.
Une grande partie des modèles expérimentaux d’ischémie cérébrale chez le nouveau-né ont été mis en œuvre chez le rat âgé de sept jours, car on peut considérer que leur cerveau est à un stade de maturation équivalent à celui de nouveau-nés humains [33,45]. Une administration IP de manganèse (88 mg/kg) chez des rats de sept jours ayant subi une hypoxie-ischémie a permis de mettre en évidence, par imagerie d’écho de spin pondérée T1, à 7 T, des zones en hyperintensité au niveau du cortex et du ganglion basal dans l’hémisphère homolatéral. L’étude histologique a montré que ces zones correspondaient à une accumulation de Mn-superoxide-dismutase et de Mn-glutamine-synthétase, caractérisant une neurodégénérescence [46]. À long terme (jusqu’à 21 jours après hypoxie-ischémie), cette expérience MEMRI a permis de visualiser des lésions de la matière grise dans le cortex homolatéral [47].
4.2 Étude fonctionnelle
L’administration systémique de manganèse est également utilisée pour des études fonctionnelles (activity-induced manganese dependant contrast magnetic resonance imaging). Une région cérébrale activée voit son influx de calcium augmenter. Le manganèse exogène remplaçant le calcium va pénétrer préférentiellement dans les cellules d’une telle région, ce qui va entraîner une diminution des temps de relaxation des protons de l’eau contenue dans ces tissus. Le manganèse peut donc être utilisé comme un agent de contraste direct de l’activité cérébrale [48]. Donnant des résultats identiques sur la localisation de l’activation cérébrale, cette technique peut constituer une alternative à l’approche blood oxygen level dependent (BOLD) pour l’imagerie fonctionnelle [22] qui reste indirecte car basée sur des modifications hémodynamiques. Différentes études sur l’animal adulte, [22,49–53] ont été réalisées avec cette approche MEMRI. Sa bonne sensibilité et son aspect plus direct sont contrebalancés par le fait qu’il est souvent nécessaire d’ouvrir transitoirement la barrière hémato-encéphalique, par exemple, dans un tissu cérébral sain, par injection de mannitol, pour permettre un apport suffisant de manganèse. Il faut également tenir compte d’une accumulation non spécifique de manganèse dans la zone impliquée et vérifier au préalable que la présence de cet ion ne modifie pas la fonctionnalité des réseaux neuronaux considérés.
4.3 Traçage des réseaux neuronaux
Le fait que le manganèse se déplace le long de voies neuronales est une propriété clef pour déterminer le traçage des réseaux neuronaux fonctionnels par IRM chez l’animal adulte. Ainsi, le passage du manganèse de la muqueuse olfactive vers le bulbe olfactif par l’intermédiaire du nerf olfactif et son entrée dans le cortex olfactif ont été mis en évidence chez la souris [54]. Les systèmes auditif et visuel ont été étudiés par MEMRI chez le rongeur adulte en absence et en présence de stimulations [16,22,43]. Watanabe et al. [43,55] ont montré l’intérêt d’une injection intracérébrale de manganèse dans l’hippocampe du cerveau de souris, pour suivre les traçages neuronaux à partir de cette structure. Une injection dans le cortex somatosensoriel du rat [56] et une acquisition 3D permettent d’analyser l’organisation topographique de liaisons neuronales à partir de cette structure. Ainsi Canals et al. [25] ont optimisé le protocole d’injection intracorticale pour l’étude non invasive des connections interstructurales chez le rongeur. L’implantation d’un système de guidage a rendu possible une étude longitudinale sur 40 jours avec injection focale de Mn toutes les deux semaines, dans le cortex somatosensoriel [57]. Les liaisons corticothalamique et corticocorticale entre les deux hémisphères mettant en jeu, au cours du temps, différentes couches corticales ont été mises en évidence [58]. Ce type d’expérience nécessite de bien identifier la prise de contraste due à un passage spécifique dans le réseau neuronal de celle due au passage par le réseau sanguin et entrée par le plexus chloroïde dans le cas d’injection nasale ou due au passage par le liquide céphalorachidien en cas d’injection corticale proche des ventricules [59]. Le traçage des réseaux neuronaux par MEMRI a été utilisé, en pathologie, chez le rat adulte, pour mettre en évidence des modifications du réseau neuronal à moyen terme, par exemple, suite à une lésion latérale du système olfactif [60] ou à une lésion de type ischémique du cortex somatosensoriel primaire [61]. La complémentarité de l’imagerie du tenseur de diffusion ayant pour objet de cartographier les tractus neuronaux et de l’imagerie de contraste renforcé par le manganèse qui permet d’identifier les voies neuronales fonctionnelles fait de l’IRM une technique puissante d’étude de la plasticité neuronale postlésionnelle [62,63].
Les conséquences, sur le système olfactif, de lésions de type hypoxie-ischémie ont été aussi étudiées par cette approche MEMRI chez le lapin nouveau-né [64]. Une étude préliminaire sur le rat nouveau-né sain, à 7 T, nous a permis de mettre en évidence l’existence de réseaux corticostriataux et corticothalamiques sur des rats âgés de sept jours et de détecter des liaisons corticocorticales sur des rats de 21 jours [65], après injection focale de MnCl2 (8 nmol) dans le cortex somatosensoriel (Fig. 3). Cette détection de connexions neuronales chez des animaux immatures permet d’envisager la possibilité d’observer, au cours du développement, d’éventuels remaniements des réseaux neuronaux fonctionnels à moyen terme en cas de lésions cérébrales, en définissant des protocoles combinant des études DTI et MEMRI par administration systémique, d’une part, et intracérébrale, d’autre part.
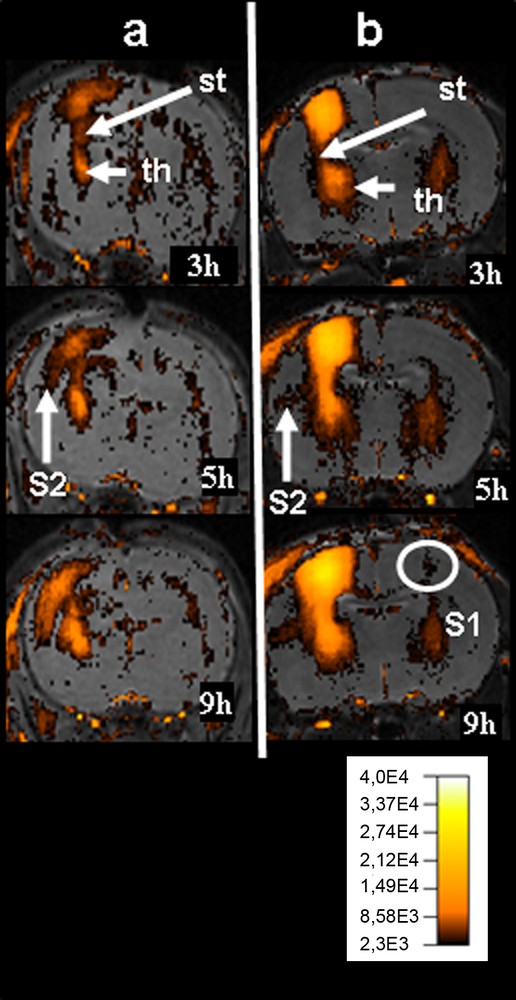
Visualisation de la présence de manganèse dans les structures cérébrales homo- et controlatérale en fonction du temps après injection focale de manganèse dans le cortex somatosensoriel (S1) de rats âgés de sept (a) et 21 (b) jours. Chaque image résulte de la superposition d’une image anatomique pondérée T2 (séquence turboRARE TR/TE = 3500/50 ms) et d’une image pondérée T1 (séquence MP-RAGE TR/Ti = 6000/1400 ms) seuillée à partir de l’histogramme du cortex controlatéral. La valeur de seuillage est l’intensité minimale définissant une aire correspondant à 5 % de l’aire de l’histogramme. Chez le rat âgé de sept jours, trois heures après injection, le manganèse arrive au niveau du striatum (st) et des noyaux thalamiques (th), et s’étend dans le cortex S2 dès cinq heures. On observe ensuite une extension du manganèse dans les zones thalamiques. Chez le rat âgé de 21 jours, on observe une évolution similaire mais on détecte, neuf heures après injection, la présence de manganèse dans le cortex S1 controlatéral.
4.4 Bilan des études chez l’animal immature
Peu d’études cérébrales ont été publiées sur l’imagerie par contraste renforcé par le manganèse chez l’animal immature. Elles portent, d’une part, sur le développement cérébral de souris génétiquement modifiées et, d’autre part, sur les effets à moyen terme de processus d’ischémie ou d’hypoxie-ischémie périnataux. Ces études ont été réalisées à des champs relativement élevés, en général 7 T, pour accroître la sensibilité des mesures et permettre, dans un temps d’acquisition convenable pour la survie de l’animal, d’avoir une résolution satisfaisante au niveau des images obtenues. Les acquisitions de type 3D permettent une segmentation en volume des réseaux neuronaux, et la zone observée n’est pas limitée par le rapport TR/TE comme lors d’acquisitions 2D. Les séquences d’écho de gradient permettent de minimiser le temps d’écho et, en jouant sur le couple temps de répétition/ angle de bascule, d’obtenir une pondération en densité de proton ou T1. La puissance des gradients activement blindés implantés sur les spectromètres imageurs haut-champ et les vitesses de commutation permettent d’utiliser des techniques 3D pondérées T1 de type magnetization-prepared rapid gradient-echo (MP RAGE) [66] ou modified driven equilibrium fourier transform (MDEFT) [67]. Ces séquences consistent en une période de préparation de l’aimantation : impulsion d’inversion adiabatique, puis délai de récupération dans le cas de la MP RAGE et impulsion de saturation, suivie d’une impulsion d’inversion adiabatique et d’un délai de récupération dans le cas de la MDEFT. Dans les deux cas, l’acquisition 3D est faite à l’aide d’une séquence d’écho de gradient rapide pondérée en densité de proton. La séquence MP RAGE correspond à une séquence d’inversion–récupération et permet une variation d’intensité entre les structures plus importante que dans le cas de la séquence MDEFT qui correspond à une séquence de saturation–récupération. Toutefois, la séquence MDEFT est moins sujette aux inhomogénéités de B1 et doit être choisie lorsqu’on utilise des bobines de surface. Les expériences déjà réalisées sur l’animal immature montrent la faisabilité de telles études au niveau de la neuro-architecture des structures cérébrales et de la fonctionnalité de leurs interconnections. Elles ne sont toutefois pas suffisantes pour permettre de définir des atlas MEMRI du développement cérébral, ni de connaître la distribution du manganèse dans les cellules cérébrales de rats ou de souris normaux. Enfin, la toxicité du manganèse chez ces animaux immatures n’est pas connue précisément. Or ces éléments représentent des prérequis indispensables à tout développement d’explorations de situations physiopathologiques.
5 Conclusion
L’utilisation de l’imagerie par contraste renforcé par le manganèse est reconnue comme une approche intéressante et complémentaire de l’imagerie du tenseur de diffusion pour étudier le remaniement et la plasticité du tissu cérébral sur des modèles expérimentaux adultes. La toxicité à moyen terme d’une administration systémique ou intracérébrale de chlorure de manganèse chez le rongeur nouveau-né n’est, à l’heure actuelle, pas connue précisément et reste à évaluer. Les études sur l’animal immature, dont la faisabilité est établie, semblent prometteuses mais nécessiteront de bien séparer développement cérébral normal et effets d’une modification génétique ou d’une lésion cérébrale.


