1 Introduction
L’isomérisation photochimique du norbornadiène (NBD) en quadricyclane (QC) continue à susciter l’attention des chercheurs depuis qu’il a été montré que le NBD peut être utilisé en tant que système de stockage et de conversion de l’énergie solaire [1–10]. Dubonosov et al. [9,10] ont réalisé une analyse intéressante des résultats publiés entre 1990 et 2004 traitant de l’isomérisation du NBD et de ses dérivés. L’application de cette réaction dans le stockage et la conversion de l’énergie solaire a été largement discutée. Le principe de cette interconversion consiste en une irradiation photochimique du système NBD le transformant en un dérivé QC de structure tendue, donc de niveau énergétique élevé (Fig. 1). Un très faible apport calorifique ou le traitement catalytique du QC redonne alors par un processus inverse le NBD en libérant 22,6 kcal/mol d’énergie thermique.

Équilibre d’interconversion : norbornadiène–quadricyclane.
Cette interconversion a été explorée en employant le NBD (qui n’absorbe pas dans le visible) en mélange avec un polymère insoluble contenant des groupements chromophores [11,12] ou avec des catalyseurs complexes, également insolubles, à base de cobalt (II) [2].
L’autre méthode conventionnellement employée pour ce système est l’introduction de groupements chromophores dans la structure du NBD pour engendrer une photosensibilisation à la lumière solaire [13]. Par exemple, la substitution de l’une des double-liaisons du NBD par un groupement électro-attracteur facilite sa conversion en QC.
Dans les polymères, l’utilisation du NBD a aussi fait l’objet de plusieurs travaux. Outre la conversion et le stockage de l’énergie solaire, l’isomérisation photochimique du NBD a été également étudiée comme une nouvelle alternative dans le domaine optoélectronique (mémoires optiques, commutateurs et autres dispositifs électroniques…) ou comme système photochromique ayant des applications potentielles dans le domaine de stockage des données [14].
Les structures NBD sont généralement introduites dans les chaînes macromoléculaires en tant que groupements pendants, soit par modification chimique de polymères [15–20], soit par polymérisation cationique de monomères vinyliques contenant cette structure [21] ou par polycondensation d’anhydrides carboxyliques avec des bis-époxydes contenant le NBD dans leur chaîne centrale [22].
En 1994, Nishikubo et al. [23] ont décrit pour la première fois la synthèse de polyamides contenant dans la chaîne principale des motifs NBD par polycondensation de l’acide 2,5-norbornadiène-2,3-dicarboxylique (ou de son chlorure) et diverses diamines. La même équipe a présenté peu de temps après, la synthèse de poly(ester-amide)s [24] par polyaddition d’amines N,N’-disubstituées par des acides NBD-dicarboxyliques et de l’éther diglycidique du bisphénol A.
Dans tous ces travaux, l’étude de l’interconversion des systèmes NBD a été menée sur des polymères, soit en solution, soit sous forme de films minces.
Les résultats que nous présentons dans cet article concernent l’étude du comportement photochimique de dérivés imides et amides de NBD pentaméthylé modèles de polyimides et polyamides.
2 Résultats et discussions
2.1 Synthèse des modèles imides et amides
2.1.1 Préparation du modèle mono imide-NBD 4
L’acide 2 est obtenu par cycloaddition de Diels-Alder entre le 1-benzyl-1,2,3,4,5-pentaméthyl-cyclopenta-2,4-diène, synthétisé au laboratoire par Ben Romdhane et al. [25] et l’acide but-2-yne-1,4-dioique. Après purification par précipitation dans l’eau et séchage sous-vide, l’acide 2 pur est obtenu avec un rendement de 80 %. Ce dernier est par la suite cyclisé par l’emploi de l’anhydride acétique dans la pyridine. Après recristallisation dans l’éther de pétrole, l’anhydride-NBD 3 pur est obtenu avec un rendement de 98 % (Fig. 2).

Schéma de synthèse du modèle mono imide-NBD (4).
L’obtention de l’imide-NBD 4 est réalisée en deux étapes. La première consiste en une condensation de l’anhydride 3 avec la 4-aminobenzophénone dans le N,N-diméthylformamide (DMF). Après évaporation du solvant, l’amide acide intermédiaire est cyclisé en deuxième étape avec l’anhydride acétique en présence d’acétate de sodium comme catalyseur. Après trois heures à 60 °C, l’imide-NBD 4 est obtenu avec un rendement de 60 % après sa purification par passage sur colonne gel de silice (éluant : éther de pétrole).
2.1.2 Préparation du modèle bis-imide-NBD 8
La procédure de préparation du bis-imide-NBD 8 est identique à celle de son homologue monofonctionnel. Le bis-diène, α,α’-bis-(1,2,3,4,5-pentaméthylcyclopenta-2,4-diényl) méta-xylène 5 est également préparé au laboratoire par Ben Romdhane et al. [25]. Le tétra acide 6 est obtenu à 75 % après sa précipitation dans le dichlorométhane suivie d’un séchage sous-vide. Sa déshydratation en dianhydride 7 par l’anhydride acétique dans la pyridine est réalisée avec un rendement de 97 %. La condensation de la 4-aminobenzophénone sur le dianhydride 7 suivie d’une cyclisation à l’aide d’un mélange anhydride acétique–acétate de sodium conduit au bis-imide-NBD 8. Après sa purification sur colonne de gel de silice (éluant : éther/éther de pétrole 3/7), le produit pur est obtenu avec un rendement de 62 % (Fig. 3).

Schéma de synthèse du modèle bis-imide-NBD 8.
2.1.3 Préparation des modèles diamides-NBD 10-a et 10-b
La synthèse de deux modèles de diamides est faite dans des conditions de catalyse par transfert de phase (CTP). Le dichlorure d’acide 9 est préalablement préparé par une méthode sélective décrite dans la littérature comme étant efficace surtout quand l’acide de départ contient d’autres fonctions sensibles [26–28]. Il s’agit de faire réagir, l’acide 2 avec le chlorure de l’acide oxalique dans le dichlorométhane en présence de DMF comme catalyseur. Après deux heures à 40 °C, un rendement voisin de 85 % est atteint (Fig. 4).

Schéma de synthèse des modèles diamides-NBD 10-a et 10-b.
L’agent de transfert de phase utilisé pour la synthèse des deux diamides est le chlorure de tétrabutylammonium. L’amine est alors introduite dans la solution contenant le dichlorure d’acide 9 avec le catalyseur et une solution de soude 1 M. Le rapport molaire : amine/chlorure d’acide étant égal à 2. L’ensemble est mis sous agitation magnétique à température ambiante et sous atmosphère inerte pendant trois heures. L’amide est ensuite purifié par passage sur colonne de gel de silice en utilisant le système éluant : cyclohexane/acétate d’éthyle (8/2). Le rendement pour les deux diamides est voisin de 70 %.
Les résultats des analyses par IR et par RMN du proton et du carbone 13 ainsi que les températures de fusion de ces quatre modèles sont résumés dans les Tableaux 1 et 2.
Caractérisation spectrale de l’imide-NBD (4) et du bis-imide-NBD (8).
| Caractérisation de l’imide-NBD (4) | ||
| Bandes infrarouge | δ (ppm) observés en RMN 1H | δ (ppm) observés en RMN 13C |
| νC=O imide1659 cm−1 ;νC=C aro1602 cm−1 ; νC=C aro 1450 cm−1 ; νC=C éthylénique1504 cm−1 ; νC-N 1354 cm−1 | 1,1 (6H, d, s) ; 1,09 (3H, b, s) ; 1,9 (6H, c, s) ; 2,95 (2H, a, s) ; 7,2-7,9 (14H,efg, m) (TMS, chloroforme d) | 8 (d) ; 17 (b) ; 12 (c) ; 40 (a) ; 60 (i) ; 65 (j) ; 138,5 (h) ; 127,5 (g) ; 128,5 (u) ; 126 (o) ; 131,5 (v) ; 130,5 (t) ; 131 (e + p) ; 136 (q) ; 128 (f) ; 133 (s) ; 137 (k) ; 139 (n) ; 143 (l) ; 166 (m) ; 196 (r) (TMS, chloroforme d) |
| Température de fusion = 151 °C | ||
| Caractérisation du bis-imide-NBD (8) | ||
| Bandes infrarouge | δ (ppm) observés en RMN 1H | δ (ppm) observés en RMN 13C |
| νC=O imide 1632 cm−1 ;νC=C aro 1591 cm−1 ; νC=C aro 1452 cm−1 ; νC=C éthylénique 1519 cm−1 ; νC-N 1354 cm−1 | 1,1 (6H, d, s) ; 1,09 (3H, b, s) ; 1,87 (6H, c, s) ; 2,92 (2H, a, s) ; 7,2-7,9 (13H,efg, m) (TMS, chloroforme d) | 25 (d) ; 26 (b) ; 25,5 (c) ; 31 (a) ; 34 (i) ; 50 (j) ; 120 (h) ; 127,5 (g) ; 130 (u) ; 129 (o) ; 132 (v) ; 131 (t) ; 131,3 (e) ; 131,5 (p + q) ; 132,5 (f) ; 135 (s) ; 138 (k) ; 142 (n) ; 144 (l) ; 169 (m) ; 196 (r) (TMS, chloroforme d) |
| Température de fusion = 168 °C |
Caractérisation spectrale des diamides-NBD (10-a et 10-b).
| Caractérisation du diamide-NBD (10-a) | ||
| Bandes infrarouge | δ (ppm) observés en RMN 1H | δ (ppm) observés en RMN 13C |
| νNH amide 3030 cm−1 ;νC=O amide 1644 cm−1 ; νC-N amide 1165 cm−1 ;νNH amide 1597 cm−1 ; νC=C aro 1480 cm−1 ;νC=C aro 1502 cm−1 ; νC=C aro 1545 cm−1 ;νC-H aro 2844 cm−1 | 1,85 (6H, d, s) ; 1,22 (3H, b, s) ; 1,10 (6H, c, s) ; 2,73 (2H, a, s) ; ,9-7,4 (23H,Aro, m) ; 7,8 (2H, h, s) (TMS, chloroforme d) | 9 (d) ; 14 (b) : 17 (c) ; 27 (a) ; 40 (i) ; 68 (j) ; 117 (s) ; 119 (p) ; 122 (o) ; 124 (u) ; 126 (g) ; 128 (f) ; 130 (t) ; 132 (e) ; 134 (n) ; 134 (k) ; 139 (h) ; 144 (l) ; 154 (r) ; 158 (q) ; 165 (m) (TMS, chloroforme d) |
| Température de fusion = 180 °C | ||
| Caractérisation du diamide-NBD (10-b) | ||
| Bandes infrarouge | δ (ppm) observés en RMN 1H | δ (ppm) observés en RMN 13C |
| νC=C amide 1670 cm−1 ; νN-H amide 3300 cm−1 ; νC=O amide 1700 cm−1 ; νC=O amide 1680 cm−1 ; νC=C aro 1592 cm−1 ; νC=C aro 1452 cm−1 | 1,8 (6H, d, s) ; 1,2 (3H, b, s) ; 1,07 (6H, c, s) ; 2,7 (2H, a, s) ; 7-7,6 (23H,Aro, m) ; 7,9 (2H, h, s) (TMS, chloroforme d) | 9 (d) ; 14 (b) ; 15,5 (c) ; 39,5 (a) ; 47 (i) ; 64 (j) ; 135 (k) ; 161 (l) ; 169 (m) ; 153 (n) ; 139 (h) ; 200 (r) ; 120 (o) ; 123 (g) ; 128 (u) ; 130 (t) ; 132 (v) ; 133,5 (p + f) ; 134 (k) ; 138 (s + q) ; 140 (e + h) (TMS, chloroforme d) |
| Température de fusion = 105 °C |
2.2 Étude de l’isomérisation NBD → QC des composés modèles sous irradiation solaire
Kawashima et al. [16] ont déjà étudié des polymères comportant des structures NBD pentaméthylés pendantes. Ils ont montré que de telles structures se convertissent en QC avec de bons rendements photochimiques. Par ailleurs, Maruyama et al. [29] ont montré à leur tour que des NBD non substitués mais sous forme d’anhydrides ou d’imides se transforment aussi en QC, soit par apport photochimique ou par traitement catalytique.
En ce qui concerne nos travaux, nous nous sommes intéressés particulièrement à l’étude de l’isomérisation de NBD → QC des composés modèles imides et amides. Ces modèles regroupent à la fois les deux types de structures citées dans la littérature, c’est-à-dire des NBD pentaméthylés qui soient sous forme d’imides ou d’amides. À ce jour de tels composés n’ont jamais été décrits.
2.2.1 Choix du solvant
Maafi et al. [4] ont déjà étudié pour des NBD aromatiques l’équilibre d’interconversion NBD–QC dans plusieurs solvants protiques ou aprotiques (DMSO, éthanol, THF, chloroforme…). Le résultat de cette étude montre que ces composés absorbent bien dans le THF ou le dichlorométhane (DCM).
Dans ce qui suit nous présentons les résultats du choix de solvant donnant la meilleure absorbance pour les composés modèles étudiés. Les solvants utilisés pour cette étude sont : le DMSO, le chloroforme et le dichlorométhane (DCM). Les concentrations des imides (4 et 8) étant de 10−2 mol/L alors que celles des diamides 10-a et 10-b sont de 4.10−4 mol/L. Les solutions ainsi préparées sont passées une à une dans le spectrophotomètre UV-Visible en effectuant un balayage de longueur d’onde variant de 320 nm à 600 nm. L’absorbance maximale est déterminée pour chaque solvant aux premières longueurs d’onde correspondant à un signal non saturé : 370 nm pour les imides 4 et 8 (Fig. 5A) et 320 nm pour les diamides 10-a et 10-b (Fig. 5B).

a: Absorbance enregistrée à 370 nm pour les composés (4 et 8) dans les différents solvants étudiés. b: Absorbance enregistrée à 320 nm pour les composés 10-a et 10-b dans les différents solvants étudiés.
Comme nous pouvons le constater, le solvant présentant la meilleure absorbance pour les quatre composés étudiés est le DCM. De plus, vu que la solubilité de ces composés y est optimale, notre choix s’est porté sur ce solvant pour effectuer le reste de cette étude.
2.2.2 Effet de la concentration
L’effet de la concentration est aussi un facteur important dans l’étude de l’équilibre d’interconversion NBD–QC. À cette fin, nous avons réalisé pour chacun des quatre modèles une série de solutions avec le DCM comme solvant. Pour les modèles imides 4 et 8 les concentrations étudiées varient de 10−2 à 10−4 mol/L, alors que pour les deux modèles diamides elles sont de 10−4, 2.10−4 et 4.10−4 mol/L. Ces solutions sont ensuite passées une à une dans le spectrophotomètre UV-Visible en effectuant un balayage de longueur d’onde variant de 320 nm à 600 nm. La concentration choisie pour chaque solution sera celle qui donne une meilleure absorbance.
Les résultats obtenus révèlent que pour les imides 4 et 8 la meilleure absorbance enregistrée, tout en restant solubles dans le DCM, correspond à des concentrations de 10−2 mol/L, alors que pour les deux diamides 10-a et 10-b elles sont de 4.10−4 mol/L. À titre d’exemple nous présentons sur la Fig. 6 la variation de la densité optique du diamide-NBD 10-b à différentes concentrations dans le DCM, en fonction de la longueur d’onde.

Variation de la densité optique du diamide-NBD (10-b) à différentes concentrations dans le DCM, en fonction de la longueur d’onde.
2.2.3 Variation de l’absorbance des modèles étudiés en solution après irradiation par la lumière solaire en fonction du temps
L’isomérisation photochimique des structures NBD des modèles étudiés est réalisée en solution dans le DCM dans une cuve en quartz par irradiations solaires. La procédure d’irradiation est décrite dans la partie expérimentale. Comme il est montré sur la Fig. 7, l’absorbance à 370 nm relative à la structure NBD dans le modèle bis-imide 8 décroît graduellement en fonction du temps traduisant ainsi une isomérisation quantitative en QC. Après 120 minutes, il ne reste que 31 % comme quantité résiduelle en NBD (Fig. 8).

Variation de l’absorbance du bis-imide (8) en fonction du temps d’irradiation et de la longueur d’onde.
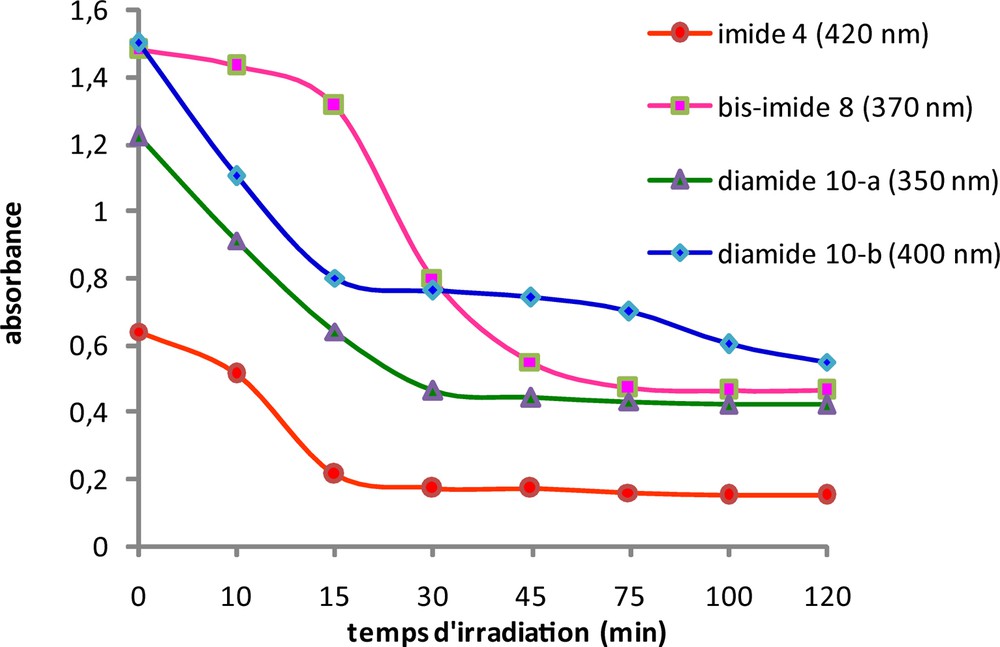
Variation de la quantité de NBD résiduelle en fonction du temps d’irradiation pour les quatre composés étudiés.
L’évolution des spectres UV des trois autres modèles en fonction du temps ont été également enregistrés sous irradiations solaires.
Le taux de conversion des structures NBD de tous ces modèles en groupements QC a été calculé à partir de la diminution de la densité optique des différentes solutions. Sur la Fig. 9 nous présentons la variation du taux de conversion des modèles étudiés sous irradiations solaires en fonction du temps. À partir de ces courbes nous pouvons d’abord noter que la conversion des NBD appartenant aux quatre modèles étudiés suit une allure exponentielle surtout en début d’irradiation pour atteindre par la suite une limite au bout d’un temps dépendant de la structure du composé. Par ailleurs, bien que la différence entre les taux de conversion des imides et amides ne soit pas très importante, ces derniers semblent être moins sensibles à l’irradiation. Cependant, pour ces deux modèles diamides 10-a et 10-b les courbes obtenues sont quasiment identiques et plus de 50 % des NBD sont convertis en motif QC au bout de 30 minutes. La structure aromatique centrale des diamines utilisées (diphényléther ou diphénylcétone) ne semble pas jouer un rôle important quant à leur comportement photochimique. D’autres modèles de diamides sont actuellement en cours d’étude. Sur la Fig. 9 nous pouvons également noter que le bis-imide 8, renfermant deux motifs NBD, possède la réactivité photochimique la plus élevée (plus de 90 % de conversion au bout de 45 minutes). Cela semble prometteur pour des polyimides renfermant le même type de structure. L’ensemble des résultats d’irradiation obtenus montre que la structure NBD dans ces modèles s’apprête bien à la transformation en QC après une courte durée d’irradiations solaires.
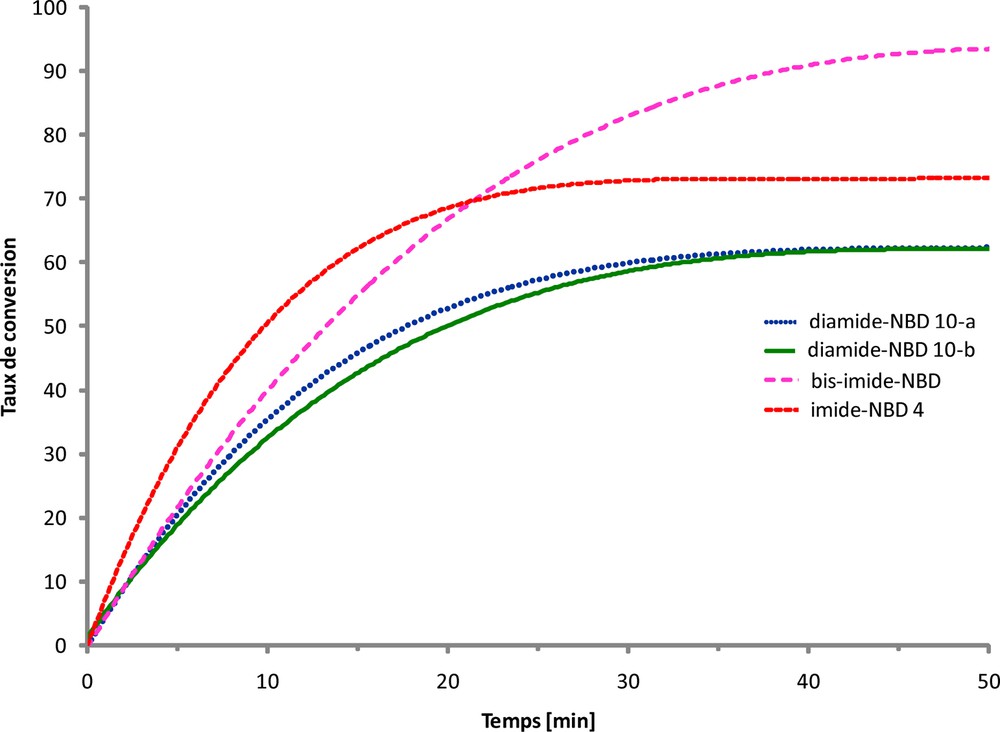
Variation du taux de conversion des composés étudiés sous irradiations solaires en fonction du temps.
La mise en évidence des structures QC obtenues par réaction photochimique des structures NBD a été également réalisée par infrarouge à transformée de Fourrier. À titre d’exemple nous présentons sur la Fig. 10 les spectres de l’imide 4 avant et après 20 minutes d’irradiation solaire. Si on s’intéresse particulièrement au signal sortant vers 1504 cm−1 relatif à la bande νC=C éthylénique caractéristique de la structure NBD, nous pouvons remarquer qu’il diminue d’intensité après irradiation.

Spectres infrarouges du modèle imide 4 avant et après 20 minutes d’irradiation solaire.
2.2.4 Étude cinétique de l’isomérisation photochimique des modèles étudiés
Une étude cinétique pour déterminer l’ordre de la transformation NBD→QC a été réalisée à l’aide des composés 4, 8, 10-a et 10-b. La constante de vitesse est déterminée dans chaque cas.
En partant de l’hypothèse que cette transformation suit une cinétique d’ordre 1, la vitesse de la réaction peut s’écrire :
| (1) |
À partir de l’Eq. (1), nous pouvons écrire :
| (2) |
La concentration en NBD peut être déterminée par la relation de Beer Lambert :
| (3) |
λ et ɛ étant des constantes, l’Eq. (2) peut s’écrire :
| (4) |
| (5) |
Étant donnée que les concentrations utilisées lors de notre étude sont bien inférieures à 0,1 mol/L et bien que la loi de Beer Lambert ne soit applicable que pour des rapports ln(A0/A) ne dépassant pas l’unité, nous avons tenté de l’appliquer dans notre étude en nous inspirant des travaux cités dans la littérature et qui l’appliquent pour des rapports supérieurs à l’unité [20,22,30,31].
Sur la Fig. 11, nous présentons les courbes ln (A0/A) en fonction du temps pour les quatre composés. Les constantes de vitesse apparentes pour chacune de ces transformations sont consignées dans le Tableau 3. Toutes ces courbes se présentant sous la forme d’une droite confirment que la transformation des motifs NBD contenus dans les quatre composés suit une cinétique d’ordre 1.
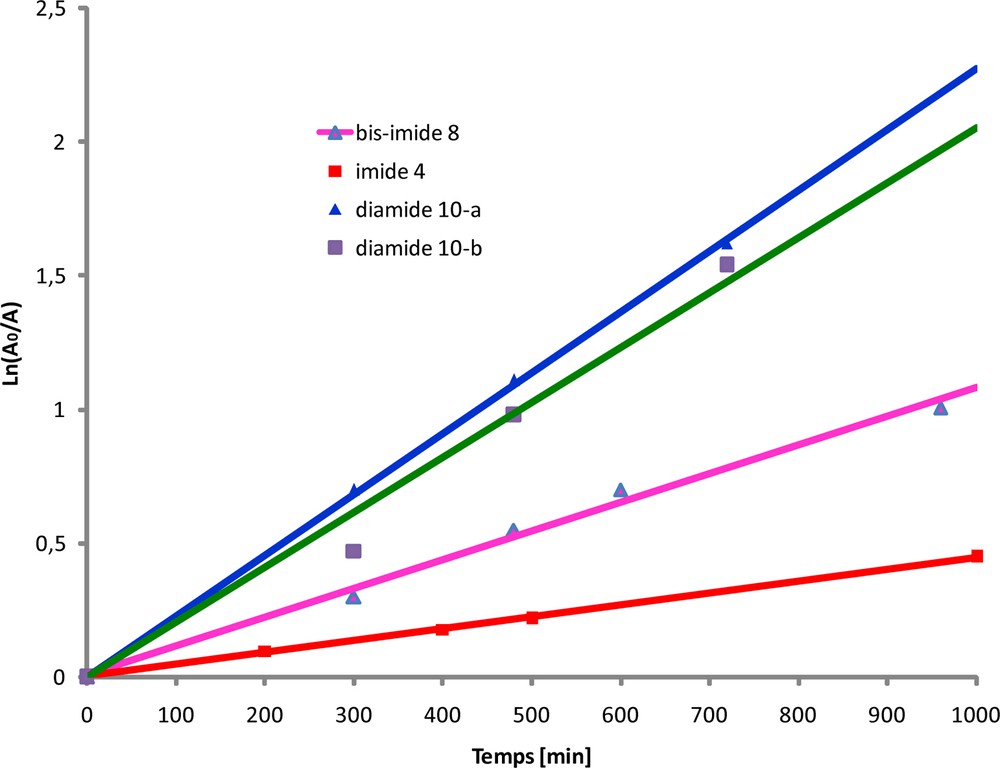
Courbes ln (A0/A) en fonction du temps pour les quatre composés étudiés.
Constantes de vitesse apparentes des quatre composés modèles étudiés.
| Composés | Constante de vitesse apparente “k” (min−1) |
| Imide-NBD (4) | 3.10−3 |
| Bis-imide-NBD (8) | 12.10−3 |
| Diamide-NBD (10-a) | 2,3.10−3 |
| Diamide-NBD (10-b) | 2.10−3 |
3 Partie expérimentale
3.1 Produits et appareillages
Tous les produits de départ ainsi que les solvants sont fournis par Sigma-Aldrich et utilisés sans purifications.
Les spectres de RMN 1H et de 13C sont enregistrés sur un spectromètre BRUKER AC 250. Les déplacements chimiques sont mesurés par rapport au TMS et le solvant utilisé est le CDCl3.
Les spectres infrarouges sont enregistrés sur un spectromètre IR PARAGON 1000 PERKIN ELMER. Les échantillons sont préparés, soit en solution dans le chloroforme, soit en pastilles de KBr. Les spectres UV-Visible sont enregistrés sur un spectrophotomètre JENWAY IC 6400.
Les températures de fusion sont déterminées à l’aide d’un calorimètre différentiel à balayage SETARAM DSC131.
3.2 Synthèse des composés modèles
3.2.1 Préparation des composés 1 et 5
Pour l’obtention de ces produits, nous avons reproduit les synthèses décrites par Ben Romdhane et al. [25]. Les rendements obtenus sont respectivement de 80 % et 70 % pour les composés 1 et 5.
3.2.2 Préparation des composés 2 et 6
La procédure de synthèse est la même pour ces deux composés. Dans un ballon tricol de 100 mL équipé d’un réfrigérant et d’une agitation magnétique, 2,2 mmol de diène 1 (1,3 mmol pour le bisdiène 5) sont dissous dans 3 mL de THF et ajoutés à 2,5 mmol d’acide but-2-ynedioique (2,9 mmol). Après chauffage pendant une heure à 60 °C, le mélange réactionnel est refroidit et précipité ensuite dans 150 mL d’eau (200 mL de dichlorométhane). Les composés 2 et 6 sont récupérés par filtration et séchage sous-vide dans un dessiccateur contenant du P2O5 comme desséchant. Les rendements sont de 80 % pour le composé 2 et de 75 % pour le composé 6.
Analyse centésimale :
Calculée pour C21H24O4 (composé 2), C : 74,09 %, H : 7,11 %, O : 18,80 % ; trouvée, C : 73,93 %, H : 7,40 %, O : 18,67 %,
Calculée pour C36H42O8 (composé 6), C : 71,74 %, H : 7,02 %, O : 21,24 % ; trouvée, C : 71,37 %, H : 7,30 %, O : 21,33 %,
3.2.3 Préparation des composés 3 et 7
La procédure de synthèse est la même pour ces deux composés. Dans un ballon tricol de 100 mL équipé d’un réfrigérant et d’une agitation magnétique, 0,88 mmol de composé 2 ou de composé 6 sont dissous dans 5 mL d’anhydride acétique et 2 mL de pyridine. Le mélange est agité pendant 24 heures à température ambiante sous atmosphère inerte. À la fin de la réaction le solvant est éliminé par filtration et l’anhydride obtenu est lavé par 2 mL d’acide acétique et 10 mL d’éther. Après recristallisation dans l’éther de pétrole, l’anhydride-NBD (composé 3) et le dianhydride-NBD (composé 7) purs sont obtenus avec des rendements respectifs de 98 % et 97 %.
Analyse centésimale :
Calculée pour C21H22O3 (composé 3), C : 78,23 %, H : 6,88 %, O : 14,89 % ; trouvée, C : 78,30 %, H : 6,72 %, O : 14,97 %,
Calculée pour C36H38O6 (composé 7), C : 76,30 %, H : 6,76 %, O : 16,94 % ; trouvée, C : 75,83 %, H : 6,98 %, O : 17,19 %,
3.2.4 Préparation de l’imide-NBD 4 et du bis-imide-NBD 8
La synthèse de l’imide ou du bis-imide passe par une étape intermédiaire qui est la formation de l’amide acide. Nous décrivons dans ce qui suit le protocole expérimental d’obtention de l’imide-NBD 4. Le bis-imide-NBD 8 est obtenu avec le même protocole expérimental.
Dans un ballon tricol de 100 mL équipé d’un réfrigérant et d’une agitation magnétique, 1,5 mmol d’anhydride 3 (1,5 mmol de dianhydride 7) et 1,3 mmol de 4-aminobenzophénone (2,6 mmol) sont dissous dans 15 mL de DMF sous atmosphère inerte. Le mélange obtenu est laissé sous agitation pendant une heure à température ambiante.
Pour la cyclisation de la structure imide, 75 mg d’acétate de sodium et 5 mL d’anhydride acétique fraîchement distillé sont ajoutés au mélange contenant l’amide acide. Après chauffage à 60 °C pendant trois heures, le mélange réactionnel est refroidit et précipité ensuite dans l’eau. Le produit brut est séché sous-vide en présence de P2O5. Après purification par passage sur colonne de gel de silice en utilisant l’éther comme éluant (éther/éther de pétrole 3/7 pour le bis-imide-NBD 8) le produit pur est obtenu avec un rendement de 60 % (62 % pour le bis-imide-NBD 8).
Analyse centésimale :
Calculée pour C34H31NO3 (composé 4), C : 81,41 %, H : 6,23 %, N : 2,79 %, O : 9,57 % ; trouvée, C : 80,92 %, H : 6,52 %, N : 2,61 %, O : 9,95 %,
Calculée pour C62H56N2O6 (composé 8), C : 80,49 %, H : 6,10 %, N : 3,03 %, O : 10,38 % ; trouvée, C : 78,96 %, H : 6,20 %, N : 2,97 %, O : 11,87 %,
3.2.5 Préparation du dichlorure d’acide 9
Dans un ballon tricol de 100 mL surmonté d’un réfrigérant et équipé d’une agitation magnétique, 1,4 mmol de l’acide 2 sont dissous dans 10 mL de chloroforme. Trois millimole de chlorure de l’acide oxalique et quelques gouttes de DMF sont ensuite ajoutées au mélange réactionnel. On laisse réagir sous azote deux heures à 40 °C. Dès qu’on ajoute les gouttes de DMF (catalyseur), on remarque que la solution vire au marron foncé. À la fin de la réaction, la solution est évaporée pour éliminer le solvant et le chlorure de l’acide oxalique restant. Le rendement en dichlorure de l’acide 9 est égal à 85 %.
3.2.6 Préparation des diamides-NBD 10-a et 10-b
La procédure de synthèse est la même pour ces deux composés. Dans un ballon tricol de 100 mL équipé d’un réfrigérant et d’une agitation magnétique et contenant 1,45 mmol de dichlorure de l’acide 9, 15 mL de soude 1 M, 2,9 mmol d’amine et (0,09 g) de chlorure de tétrabutylammonium sont ajoutés. Le mélange réactionnel est laissé sous agitation pendant trois heures à température ambiante. La phase organique est ensuite séparée puis lavée successivement avec une solution de soude 1 M, une solution d’acide chlorhydrique 1 M et enfin trois fois à l’eau.
L’amide est purifié par passage sur colonne de gel de silice en utilisant le mélange d’éluants : cyclohexane/acétate d’éthyle dans les proportions respectives 8/2. Le rendement des deux diamides est voisin de 70 %.
3.3 Irradiation solaire des composés étudiés
La solution contenant le produit à irradier est placée dans un ballon monocol contenant un barreau aimanté. Après un barbotage par un courant d’azote pur pendant dix minutes et sous agitation magnétique, le ballon est alors bouché par un septum et placé au soleil. Les prélèvements se font toujours sous agitation à l’aide d’une seringue et à des intervalles de temps réguliers.
Ces irradiations ont été réalisées courant un mois de mai à partir de 11 heures.
4 Conclusion
Dans ce travail nous nous sommes intéressés à l’étude par spectrophotométrie UV-Visible de l’isomérisation photochimique sous irradiation solaire de composés modèles imides, bis-imides et diamides tous renfermant des structures norbornadiènes au sein de leurs structures. Au cours de cette étude, nous avons noté pour les quatre composés modèles utilisés que la transformation en quadricyclane est quantitative et rapide sous irradiations solaires. Nous avons également montré que cette transformation suit une cinétique du premier ordre.
Tous ces résultats sont prometteurs et peuvent être extrapolés pour l’obtention d’une nouvelle variante de matériaux destinés au stockage et à la conversion de l’énergie solaire : des polyimides-NBD et des polyamides-NBD pouvant être obtenus par polycondensation de dianhydrides et de dichlorures d’acides renfermant des motifs NBD, avec diverses diamines.


