1 Introduction
La synthèse des 1,3-dioxolanes fait souvent appel à l’utilisation d’un catalyseur solide à caractère acide tel que les métaux phosphatés [1], l’acétate de rhodium (II) [2] et le chlorure d’étain (II) [3]. Ces réactions sont effectuées dans des solvants généralement nocifs et difficiles à séparer du brut réactionnel.
Des recherches de processus catalytiques ont été alors établies, en utilisant des argiles pontées, pour répondre aux demandes de la chimie verte [4–6]. En effet, des travaux ont étudié les propriétés catalytiques des argiles pontées titane dans l’oxydation du (E)-hex-2-ène-1-ol en acide hex-2-énoïque [7]. Les polycations les plus utilisés pour modifier les argiles sont le zirconium [8] et l’aluminium [9]. Les argiles pontées aluminium sont utilisées pour la conversion du limonène en α-terpène [10] et l’alkylation du benzène par le propène [11]. D’autres travaux ont signalé que la synthèse des 3,4-dihydropyrimidinones [12] et l’alkylation du phénol [13] sont catalysées par les argiles pontées zirconium.
Dans le but d’augmenter la stabilité thermique et d’améliorer l’activité catalytique de ces catalyseurs hétérogènes naturels au cours des réactions organiques, les chercheurs ont eu recours à l’ajout des terres rares au cours de la préparation des argiles pontées. Dans ce contexte, les argiles pontées aluminium et modifiées par le cérium sont utilisées dans plusieurs réactions comme la synthèse du méthane [14] et l’oxydation du phénol [15]. En plus, les oxydations de l’acétone et du toluène sont effectuées en présence de laponites pontées lanthane, praséodyme et zirconium, puis modifiées par le cérium [16,17].
Compte tenu des résultats de la littérature, il nous a paru intéressant d’explorer le comportement des argiles diversement pontées aluminium et zirconium vis-à-vis d’un mélange d’éthylène glycol et d’acétone en absence de solvant et sous pression autogène tout en étudiant l’effet de l’ajout de faibles quantités de cérium sur les propriétés catalytiques de ces catalyseurs.
2 Résultats et discussion
Récemment, nous avons étudié la catalyse hétérogène de l’acétalisation de l’acétone 2 par l’éthylène glycol 1 en 2,2-diméthyl-1,3-dioxolane 3 en présence d’argiles activées à l’acide [18]. Ces catalyseurs sont préparés à partir d’argiles brutes H originaires du Djebel Haidoudi de la région de Gabes du Sud-Est tunisien.
Ces résultats prometteurs nous ont motivé à préparer le dioxolane 3 en utilisant cette fois-ci deux argiles pontées. L’argile G, provenant du gisement Oued Tfal de la région de Gafsa du Sud-Ouest tunisien, est un minéral interstratifié illite - smectite composé d’environ 78 % de smectite, de type beidellite renfermant une faible quantité de kaolinite et des impuretés comme le quartz, la Calcite et le feldspath. L’argile W, commercialisée d’origine Américaine nommée Wyoming, utilisée comme référence, est un minéral de type montmorillonite renfermant des impuretés comme le quartz et le feldspath. Les formules chimiques de ces matériaux après purification et échange au sodium, établies selon la méthode de Mauguin [19], sont :
G-Na : [Si7,42Al0,57] [Al2.96Fe0.73Mg0.24] Na0.71K0.21Ca0.01O22
W-Na : [Si7.84Al 0.15] [Al3.10Fe0.34Mg0.51] Na0.72K0.02Ca0.01O22
Ces deux argiles sodiques sont utilisées comme catalyseurs dans la synthèse du 2,2-diméthyl-1,3-dioxolane 3. Or, les résultats révèlent que l’éthylène glycol 1 et l’acétone 2 sont inertes vis-à-vis des argiles G-Na et W-Na après chauffage à 40 °C, pendant trois jours dans un autoclave sous pression autogène. Cependant, nous avons rapporté dans nos précédents travaux que le dioxolane 3 est obtenu à partir des réactifs 1 et 2 en présence d’une argile tunisienne interstratifié illite- smectite H pontée chrome [20].
Nous avons alors été mené à modifier ces matériaux en vue de préparer d’autres argiles pontées aluminium (A) et zirconium (Z) et en appliquant la méthode directe « D » et la méthode indirecte « I » [21]. Le pontage consiste à intercaler, d’une manière irréversible, de gros polycations métalliques simples ou mixtes entre les feuillets des argiles G et W. Les argiles ainsi modifiées sont caractérisées par un espacement interfoliaire important, une stabilité thermique et une acidité développée. L’analyse des résultats regroupés dans le Tableau 1 montre que les argiles pontées sont devenues plus acides que les argiles purifiées sodiques. De plus, nous avons remarqué que les points de charges nuls (PCN) dépendent de la nature de ces catalyseurs hétérogènes et de leur mode de pontage.
Principales caractéristiques physico-chimiques des argiles-Na, des argiles-A et des argiles-Z.
| Entrée | Argile | d001(Å) | Type d’acidité | PCN | % Al2O3 | % ZrO2 | % CeO2 |
| 1 | G-Na | 10 | Lewis | 7,33 | 24,8 | 0 | 0 |
| 2 | W-Na | 10 | Lewis | 8,57 | 23,34 | 0 | 0 |
| 3 | GA-D | 17,4 | Lewis | 6,15 | 34,6 | 0 | 0 |
| 4 | GA-I | 18 | Lewis | 6,31 | 34,19 | 0 | 0 |
| 5 | WA-D | 17 | Lewis | 6,13 | 34,26 | 0 | 0 |
| 6 | WA-I | 17,4 | Lewis | 6,45 | 35,54 | 0 | 0 |
| 7 | GZ-D | 18,2 | Lewis + Brönsted | 4,72 | 20,34 | 16,71 | 0 |
| 8 | GZ-I | 15,3 | Lewis + Brönsted | 4,75 | 21,26 | 13,42 | 0 |
| 9 | WZ-D | 18,2 | Lewis + Brönsted | 4,75 | 21,3 | 17,35 | 0 |
| 10 | WZ-I | 17,8 | Lewis + Brönsted | 4,78 | 15,25 | 21,99 | 0 |
En première étape de la synthèse du dioxolane 3, nous avons traité un mélange d’éthylène glycol 1 et d’acétone 2 par ces argiles pontées aluminium G-A et W-A dans les mêmes conditions expérimentales que celles utilisées avec les argiles sodiques G-Na et W-Na (Schéma 1). Les résultats montrent que l’argile G-A et l’argile W-A se comportent de la même manière vis-à-vis des substrats 1 et 2, elles favorisent la formation de 3 avec un rendement faible (6 %).
Acétalisation de l’acétone 2 catalysée par les argiles pontées.
La structure du 2,2-diméthyl-1,3-dioxolane 3 est identifiée sans ambiguïté par comparaison de ces spectres IR, de RMN 1H et de RMN 13C avec ceux du composé connu [18].
Dans le but d’obtenir le dioxolane 3 avec des rendements satisfaisants, nous étions mené à réaliser cette réaction d’acétalisation pendant des temps variables en présence des argiles pontées aluminium. Nous avons alors remarqué que, quel que soit le type du catalyseur utilisé, l’allure des courbes représentées sur la Fig. 1 se manifeste par une augmentation du rendement en dioxolane 3 jusqu’à atteindre une valeur maximale, après 24 heures de réaction, puis diminue au cours du temps. Par ailleurs, les argiles pontées aluminium par la méthode directe GA-D et WA-D catalysent la réaction d’acétalisation de l’acétone 2 par l’éthylène glycol 1 avec un rendement de 15 % qui est légèrement supérieur (12 %) à celui obtenu par action des argiles pontées aluminium par la méthode indirecte GA-I et WA-I. Cette légère variation du rendement en produit 3 pourrait être due à l’acidité de surface de ces catalyseurs. En effet, les argiles GA-D et WA-D ont des points de charges nulles légèrement inférieurs à ceux des argiles GA-I et WA-I (Tableau 1, entrées 3–6).
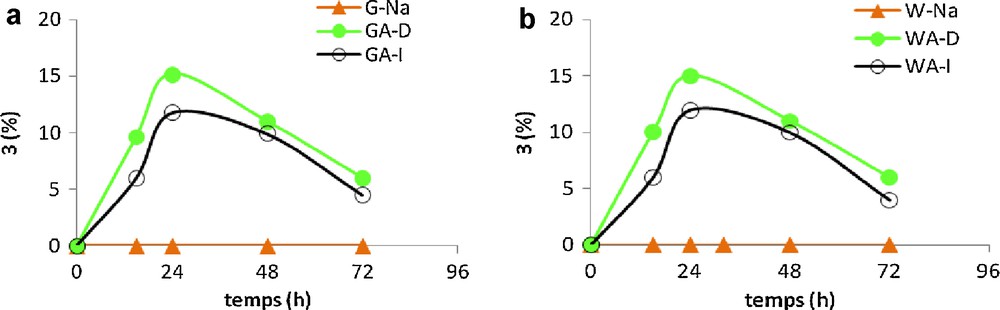
Synthèse du dioxolane 3 en présence des argiles pontées aluminium.
La synthèse du dioxolane 3 avec des faibles rendements nous a encouragé à utiliser des argiles pontées zirconium d’acidité supérieure à celle des argiles pontées aluminium (Tableau 1, entrées 7–10). L’analyse de la Fig. 2 révèle que cette réaction d’acétalisation conduit au produit recherché 3 avec des rendements dépendant de la matière première du catalyseur et de la méthode du pontage. En effet, la vitesse de formation de dioxolane 3 avec l’argile WZ-D est supérieure à celle de l’argile GZ-D. Le rendement de 3 atteint un maximum de 42 % après 48 heures de réaction dans le cas du WZ-D, alors qu’il est de 41 % après 120 heures de réaction en utilisant l’argile GZ-D.
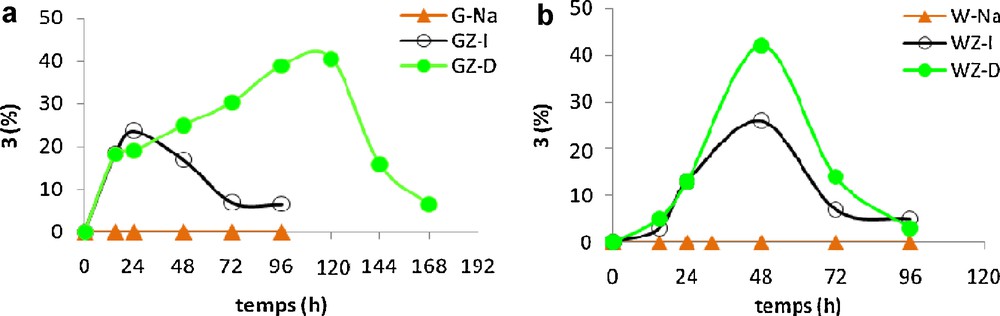
Synthèse du dioxolane 3 en présence des argiles pontées zirconium.
En ce qui concerne les argiles tunisiennes, nous avons remarqué que le rendement maximal est de 41 % pour une durée de 120 heures alors qu’il est de 21 % pour une durée de 24 heures pour GZ-D et GZ-I respectivement (Fig. 2a). Il est à remarquer que la position du maximum vers les temps faibles (24 heures), observée dans le cas du catalyseur GZ-I, peut être expliquée par la différence de disposition du pont zirconium et par conséquence une accessibilité différente aux sites acides actifs. En effet, la distance basale de l’argile GZ-I est faible (15,3 Å) et inférieure à celles des autres argiles pontées (17 < d001 < 20,6 Å) (Tableaux 1 à 3). Ces résultats montrent alors que l’argile pontée par la méthode directe GZ-D favorise une réaction lente avec un rendement satisfaisant, en revanche l’argile pontée par la méthode indirecte GZ-I conduit rapidement au produit 3 mais avec un rendement plus faible.
Principales caractéristiques physico-chimiques des argiles-Z/A.
| Entrée | Argile | d001(Å) | Type d’acidité | PCN | % Al2O3 | % ZrO2 | % CeO2 |
| 1 | GZ/9A-D | 18,2 | Lewis + Brönsted | 6,09 | 33,81 | 6,62 | 0 |
| 2 | GZ/A-D | 19,2 | Lewis + Brönsted | 5,5 | 26,48 | 17,31 | 0 |
| 3 | G9Z/A-D | 20,5 | Lewis + Brönsted | 5,14 | 25,05 | 20,98 | 0 |
| 4 | WZ/9A-D | 17,1 | Lewis + Brönsted | 6 | 30,65 | 7,52 | 0 |
| 5 | WZ/A-D | 18,1 | Lewis + Brönsted | 5,44 | 26,91 | 18,9 | 0 |
| 6 | W9Z/A-D | 20,6 | Lewis + Brönsted | 4,95 | 24,91 | 22,71 | 0 |
Principales caractéristiques physico-chimiques des argiles-C-A, des argiles-C-Z et des argiles-C-Z/A.
| Entrée | Argile | d001(Å) | Type d’acidité | PCN | % Al2O3 | % ZrO2 | % CeO2 |
| 1 | GCA-D | 18,45 | Lewis | 5,10 | 34,11 | 0 | 0,44 |
| 2 | GCZ-D | 19,32 | Lewis + Brönsted | 4,27 | 20,18 | 16,57 | 0,58 |
| 3 | GCZ/9A-D | 17,5 | Lewis + Brönsted | 5,53 | 33,56 | 6,62 | 0,15 |
| 4 | GCZ/A-D | 19,15 | Lewis + Brönsted | 4,69 | 26,11 | 16,96 | 0,31 |
| 5 | GC9Z/A-D | 20,57 | Lewis + Brönsted | 4,48 | 24,97 | 20,88 | 0,43 |
| 6 | WCA-D | 17,57 | Lewis | 5,08 | 33,96 | 0 | 0,46 |
| 7 | WCZ-D | 19,4 | Lewis + Brönsted | 4,25 | 21,14 | 17,24 | 0,50 |
| 8 | WCZ/9A-D | 17,55 | Lewis + Brönsted | 5,51 | 30,58 | 7,48 | 0,17 |
| 9 | WCZ/A-D | 19,26 | Lewis + Brönsted | 4,63 | 26,92 | 18,88 | 0,35 |
| 10 | WC9Z/A-D | 20,45 | Lewis + Brönsted | 4,39 | 24,78 | 22,64 | 0,48 |
Dans le cas des argiles américaines, l’hétérocycle 3 est obtenu après 48 heures de réaction avec un rendement de 26 % et 42 % avec WZ-I et WZ-D respectivement (Fig. 2b).
Pour expliquer ces résultats, nous avons suggéré que le nombre total de sites acides de Bronsted et de Lewis joue alors un rôle important sur le déroulement de cette réaction d’acétalisation (Tableau 1, entrées 7–10).
L’objet de la deuxième étape de ce travail consiste à utiliser des argiles pontées par des polymères mixtes au zirconium–aluminium préparées par la méthode directe avec des rapports variables en vue d’augmenter le rendement en dioxolane 3 (Tableau 2).
Les résultats révèlent que le rendement en dioxolane 3 dépend fortement du rapport Z/A. En effet, l’augmentation de la quantité de zirconium entraîne une amélioration du rendement en produit 3, il est égale à 8 % pour GZ/9A-D, 42 % pour GZ/A-D et 52 % pour G9Z/A-D (Fig. 3a).
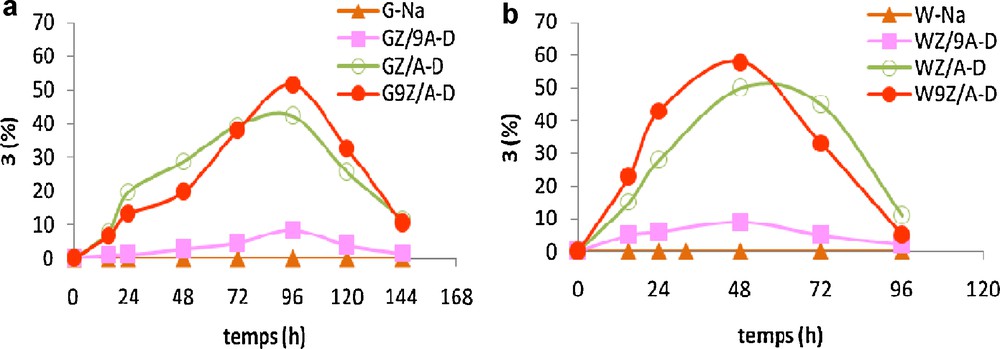
Synthèse du dioxolane 3 en présence des argiles pontées zirconium-aluminium.
Il convient aussi de noter que les argiles américaines modifiées avec un polymère mixte au zirconium-aluminium avec des rapports variables Z/A catalysent la synthèse du dioxolane 3 avec des rendements proches de leurs homologues tunisiennes (Fig. 3b) :
GZ/9A-D < GZ/A-D < G9Z/A-D
WZ/9A-D < WZ/A-D < W9Z/A-D
Cependant, nous avons observé que les argiles tunisiennes pontées sont moins réactives que les argiles américaines pontées, le rendement de 3 atteint un maximum après 96 heures de réaction pour les argiles tunisiennes alors qu’il est de 48 heures pour les argiles Américaines.
La variation du rendement de 3 est donc en corrélation avec l’acidité du catalyseur et du nombre de sites acides de Lewis et de Brönsted (Tableau 2).
Par ailleurs, il est connu que l’ajout des terres rares au cours du pontage des argiles augmente leur pouvoir catalytique [22,23]. Nous avons alors étudié dans la troisième étape de ce travail l’effet de l’ajout d’une faible quantité de cérium, sous forme de cations Ce3+, sur la performance catalytique des différents catalyseurs (Tableau 3). La comparaison des courbes relatives aux argiles pontées par un mélange cérium-aluminium (CA) montre que le maximum du rendement en 3 dépend de la nature du catalyseur utilisé. Comme prévu, l’ajout du cérium favorise la formation du dioxolane 3 avec des rendements supérieurs à leurs homologues obtenus en utilisant des argiles pontées aluminium.
En effet, l’analyse des courbes regroupées sur la Fig. 4 révèle que, pour la même durée de réaction (24 heures), les rendements maximaux du composé 3 avec les argiles GCA-D et WCA-D (30 % et 29 %) sont très supérieurs à ceux des argiles GA-D et WA-D (15 %). Cette augmentation du rendement de 3 pourrait être expliquée par l’introduction de quantités de cérium dans la charpente des argiles G et W, ce qui augmente leur acidité et entraîne par conséquence une diminution du point de charge nul (Tableau 1, entrées 3,5) vs (Tableau 3, entrées 1,6).
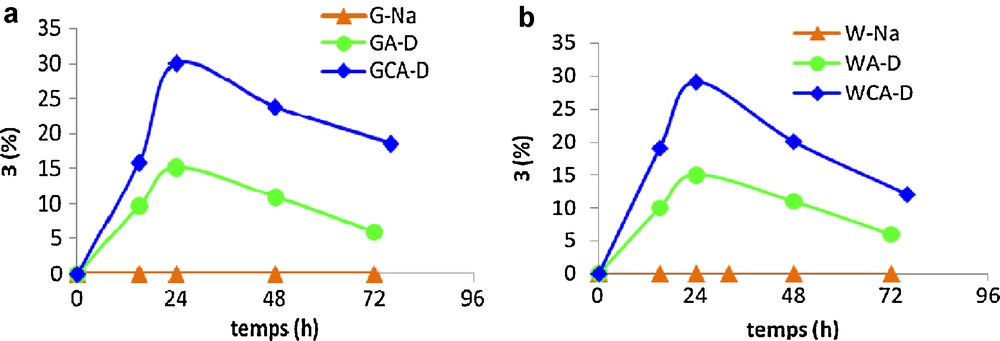
Synthèse du dioxolane 3 en présence des argiles pontées cérium-aluminium.
De plus, nous avons examiné l’effet du cérium sur le déroulement de la synthèse du dioxolane 3 tout en comparant les résultats obtenus avec les argiles pontées zirconium à ceux obtenus avec les argiles pontées par un mélange cérium-zirconium (Tableau 3, entrées 2,7). Il est intéressant de noter que l’ajout d’une faible quantité du cérium au cours du pontage par le zirconium entraîne une augmentation du rendement et une diminution du temps de réaction (Fig. 5). En effet, le rendement maximal passe de 42 % (48 heures) à 58 % (24 heures) pour WZ-D et WCZ-D et de 41 % (120 heures) à 58 % (24 heures) pour GZ-D et GCZ-D respectivement. Les catalyseurs mixtes bentonites-CZ-D sont plus réactifs et plus acides que leurs homologues bentonites-Z-D. Cette variation considérable du rendement de l’hétérocycle 3 pourrait être expliquée par la diminution des point de charges nuls des argiles après introduction du cérium (Tableau 1, entrées 7,9) vs (Tableau 3, entrées 2,7).
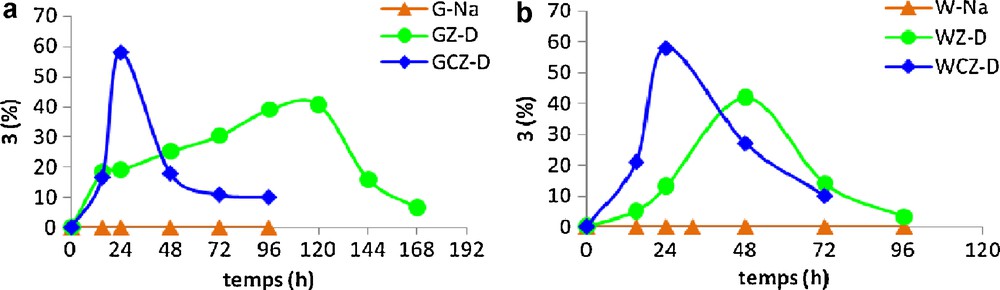
Synthèse du dioxolane 3 en présence des argiles pontées cérium-zirconium.
Ces résultats satisfaisants nous ont mené à préparer une nouvelle variété de catalyseurs en ajoutant du cérium (20 %) au cours du pontage mixte zirconium–aluminium avec différents rapports Z/A (Tableau 3).
La comparaison des résultats représentés sur la Fig. 6 révèle que les argiles pontées cérium-zirconium-aluminium accélèrent l’acétalisation de l’acétone 2. En effet, le temps de réaction nécessaire pour que le rendement en dioxolane 3 atteigne son maximum est de 24 heures pour les échantillons modifiés par un pontage mixte C-Z-A-D alors qu’il est de 96 heures (Fig. 6a) et 48 heures (Fig. 6b) pour leurs homologues Z-A-D.
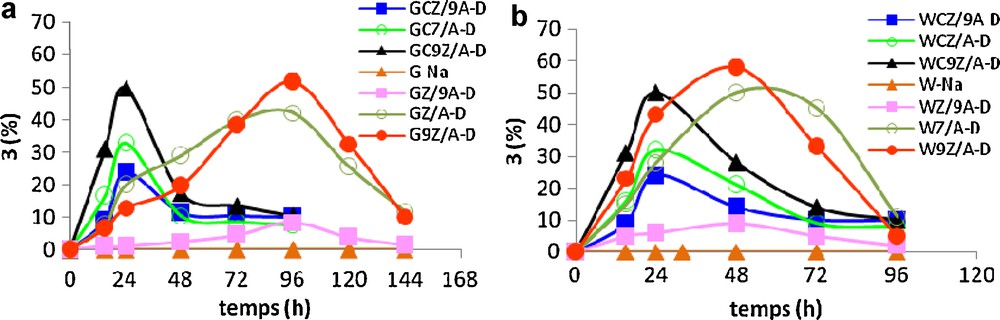
Synthèse du dioxolane 3 en présence des argiles pontées cérium-zirconium/aluminium.
L’augmentation du rendement de 3 est due à la diminution du point de charge nul et à l’augmentation de l’acidité de ces catalyseurs (Tableaux 2 et 3). Cette variation est comme suit :
C-Z/9A-D < C-Z/A-D < C-9Z/A-D.
À la lumière des résultats obtenus, nous pouvons conclure que les argiles GCZ-D et WCZ-D, possédant les points de charges nuls les plus bas (4,25 et 4,27 respectivement), sont les catalyseurs les plus efficaces pour synthétiser le 2,2-diméthyl-1,3-dioxolane 3 avec le meilleur rendement (58 %) par acétalisation de l’acétone 2 par l’éthylène glycol 1 (Fig. 7).
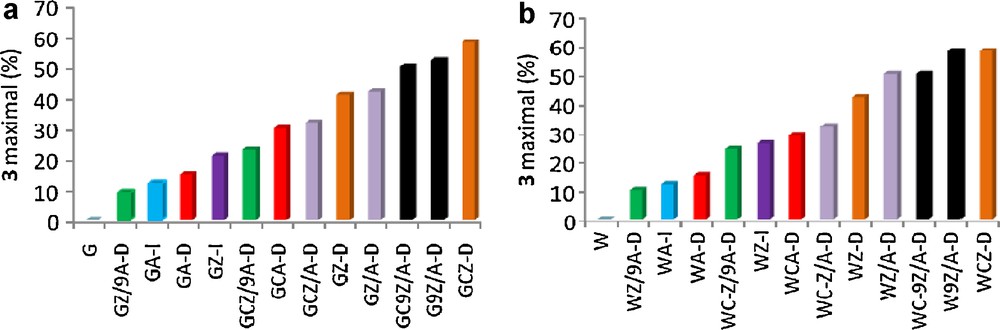
Évolution du rendement maximal du dioxolane 3 en fonction de la nature du catalyseur.
Par ailleurs, nous avons jugé important de vérifier le relargage des ions métalliques Zr, Al et Ce en milieu réactionnel. Les résultats d’analyse par absorption atomique révèlent que seulement une très faible quantité de catalyseur, inférieure à 17 (Zr), 34 (Al) et 0,5 (Ce) μmol/100 mg, passe en solution. Dans ces conditions, il n’est pas envisageable que la réaction d’acétalisation soit catalysée par les ions relargués en solution (catalyse homogène) et qu’il s’agit plutôt d’une catalyse hétérogène.
De plus, nous avons étudié l’activité catalytique de toutes les argiles pontées récupérées par filtration des bruts des réactions d’acétalisation de l’acétone 2 [24]. L’abattement du rendement du dioxolane 3 de 20 à 30 % montre que ces catalyseurs sont effectivement recyclables. Nos résultats sont similaires à ceux de la littérature (20–40 %) et relatifs à la régénération des catalyseurs hétérogènes épuisés pour être réutilisés dans d’autres réactions de synthèse organique [25].
Il est intéressant de noter que le dioxolane 3 est obtenu par catalyse avec les argiles pontées mixtes cérium–zirconium avec un rendement de 58 % qui est supérieur à celui des argiles pontées chrome (32 %) [20] mais il est proche de celui des argiles activées à l’acide (54 %) [18].
De son côté, Patel [1] a rapporté que l’acétalisation du cyclohexanone par l’éthylène glycol en présence de Zr (IV) phosphaté dans le toluène sous-reflux conduit au dioxolane correspondant avec un rendement égal à 75 %.
Par ailleurs, nous avons constaté que le rendement en 2,2-diméthyl-1,3-dioxolane 3 diminue pour une longue période de réaction d’acétalisation (Fig. 1 à 6). La décomposition de 3 en un mélange d’éthylène glycol 1 et d’acétone 2 est due à l’attaque nucléophile de l’eau sur cet hétérocycle 3 qui est catalysée par les acides de Lewis et de Bronsted des argiles pontées présentes dans le milieu réactionnel. L’intermédiaire formé par ouverture du composé 3 se réarrange en produits 1 et 2 (Schéma 2).
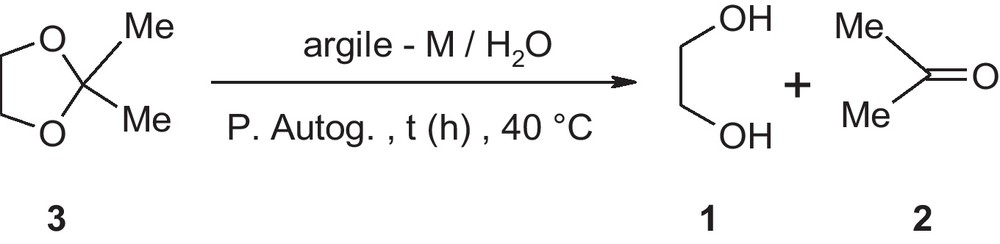
Hydrolyse du dioxolane 3 catalysée par les argiles pontées.
Dans ce cadre, il est judicieux de signaler que la détermination du PCN de nos catalyseurs a été effectuée en milieu aqueux. La libération de l’eau par la réaction d’acétalisation n’affecte pas alors les valeurs des PCN signalées dans les Tableaux 1 à 3.
3 Conclusion
L’étude cinétique de la synthèse du 2,2-diméthyl-1,3-dioxolane permet de conclure que l’ajout d’une faible quantité de cérium et ou d’aluminium au cours du pontage améliore le pouvoir catalytique des catalyseurs pontés zirconium et accélère la vitesse de la réaction d’acétalisation de l’acétone par l’éthylène glycol. Dans cette étude nous avons montré qu’il s’agit d’une catalyse hétérogène et que nos catalyseurs peuvent être recyclés pour une éventuelle réutilisation ce qui rend ces derniers promoteurs dans une catalyse acide.
4 Partie expérimentale
4.1 Préparation des argiles pontées
L’argile G est originaire de l’Oued Tfal de la région de Gafsa du Sud-Ouest tunisien alors que l’argile W est une argile commercialisée d’origine américaine.
4.1.1 Purification
Ce procédé de purification consiste à disperser une masse d’argile brute dans l’eau distillée avec un rapport solide/liquide égal à 1/5. Le mélange est soumis à une agitation pendant 12 heures jusqu’à l’homogénéisation complète puis tamisé par un tamis de type ASTME 11–70 Praifsieb 106 μm. La suspension obtenue est traitée par HCl (0,3 M) jusqu’à la cessation de l’effervescence correspondante au dégagement du gaz carbonique. Cette étape est suivie par des lavages successifs à l’eau distillée afin de neutraliser la suspension d’argile. L’argile prétraitée est dispersée dans une solution de NaCl (1 M) avec un rapport solide/liquide égal à 1/5. La suspension est ensuite soumise à une agitation pendant un jour suivie d’une centrifugation. Cette opération (agitation-centrifugation) est répétée cinq fois pour assurer un échange total. La suspension d’argile sodique est lavée plusieurs fois à l’eau distillée puis soumise à une série de dialyses jusqu’à élimination totale des ions chlorures (test avec le nitrate d’argent). Cette suspension est ensuite séchée à une température de 80 °C, broyée, tamisée et récupérée.
4.1.2 Préparation de la solution pontante
Il est à signaler qu’à la fin de la préparation des argiles pontées, toutes les solutions doivent être limpides et dépourvues de toutes particules solides pour éviter la formation des précipités d’hydroxydes.
4.1.2.1 Solution pontante simple à base d’aluminium ou de zirconium
Cette solution est préparée par hydrolyse d’une solution de nitrate d’aluminium [Al(NO3).9H2O] 0,1 M ou de tetrachlorure de zirconium (ZrCl4) 0,1 M par une solution de soude 0,2 M. L’hydrolyse est effectuée avec un débit discontinu sous une agitation magnétique. Le pH final de la solution pontante est de 4,1 pour l’aluminium et de 2,8 pour le zirconium.
4.1.2.2 Solution pontante mixte à base d’aluminium et de zirconium
Le procédé de polymérisation consiste à préparer une solution d’aluminium 0,1 M et une solution de zirconium 0,1 M. Les deux solutions sont mélangées à température ambiante avec les rapports Z/A égaux à 9/1, 1/1 et 1/9. Le mélange obtenu est, ensuite, hydrolysé par une solution de soude 0,2 M jusqu’à atteindre un pH égal à 3,8. On laisse ce mélange sous agitation pendant une nuit à la température ambiante.
4.1.2.3 Solution pontante mixte à base de cérium
Cette solution est préparée en mélangeant à température ambiante une solution de nitrate de cérium [Ce(NO3)3.6H2O] 0.1 M avec une solution de Zr ou Al ou Zr/Al 0,1 M avec un rapport Ce/M égal à 1/5 tout en conservant les rapports Z/A (dans le cas de C/Z-A) comme précédemment (1/9, 1/1 et 9/1). Le mélange est ensuite hydrolysé par une solution de soude 0,2 M jusqu’à atteindre un pH égal à 4,1, 2,8 et 3,8 pour CA, CZ et C-Z/A respectivement. Le mélange est laissé sous agitation pendant une nuit à la température ambiante.
4.1.3 Intercalation
Le pontage des bentonites par des polycations d’oxydes métalliques est réalisé par les deux méthodes suivantes.
4.1.3.1 Méthode directe « D »
Des suspensions de bentonite sodique (1 %) sont initialement bien homogénéisées pendant deux heures. L’ajout des solutions pontantes (Zr, Al ou Zr-Al) est effectué goutte à goutte à l’aide d’une ampoule à décanter et sous agitation constante. Le mélange est maintenu sous agitation pendant 24 heures à la température ambiante pour favoriser le bon contact entre le polymère et l’argile. Le mélange résultant est centrifugé et le matériau obtenu est lavé par dialyse (cinq fois successives avec l’eau distillée). L’argile pontée obtenue après lavage est d’abord séchée à 80 °C, puis calcinée à 550 °C durant deux heures.
4.1.3.2 Méthode indirecte « I »
On ajoute de l’argile en poudre à la solution pontante sous agitation. Les opérations qui suivent la centrifugation se reproduisent de la même manière que précédemment.
4.2 Synthèse du 2,2-diméthyl-1,3-dioxolane 3
7,68 g (124 mmol) d’éthylène glycol 1, 3,64 g (63 mmol) d’acétone 2 et 0,1 g d’argile pontée sont placés dans un autoclave étanche puis chauffés à 40 °C sous pression autogène pendant des temps variables. Après refroidissement du réacteur à la température ambiante, le catalyseur est séparé par filtration. L’éthylène glycol 1 résiduel est éliminé par traitement du filtrat par 20 mL d’eau distillée. On extrait la phase aqueuse par l’éther (3 × 20 mL). Les phases organiques sont réunies puis séchées sur sulfate de magnésium. Après filtration et évaporation des solvants (éther et acétone) sous vide, on récupère le 2,2-diméthyl-1,3-dioxolane 3.


