1 Introduction
Les exigences environnementales, de plus en plus sévères, représentent actuellement le défi majeur de notre société [1–3]. Elles sont la force motrice de l’industrie mondiale, dont le but est d’améliorer les réactions des procédés chimiques actuel [2,4,5] et de concevoir de nouveaux processus avec une plus grande économie d’atomes [6–10].
La pollution des eaux usées représente sans aucun doute un des aspects les plus inquiétants de la crise globale de l’environnement, et suscite à l’heure actuelle un intérêt particulier à l’échelle internationale [11]. Parmi les polluants toxiques, les composés chromés ont fait l’objet de nombreuses recherches et d’une attention toute particulière durant ces dernières années [12–14]. Le chrome est un métal largement utilisé, les quantités de chrome sont liées, pour l’essentiel, à des émissions d’origine industrielle. Les principales activités humaines qui augmentent les concentrations en chrome dans l’eau sont la fabrication de l’acier chromé, le chrome comme additif dans les alliages, comme colorant et mordant en teinture, dans les rejets des ateliers de galvanoplastie, dans les produits de conservation du bois, etc. [15] Il existe principalement dans la nature sous la forme de dérivés et peut se trouver à l’état trivalent (Cr3+, chromites) ou hexavalent (Cr6+, chromates et dichromates), mais les deux valences présentent des toxicités et des mobilités différentes. Le chrome hexavalent Cr(VI) constitue un danger pour la santé humaine ; c’est un élément toxique, il est considéré comme un polluant dangereux et cancérigène [16] ; même s’il n’est présent que sous forme de traces, il pose un problème majeur pour la santé publique. La valeur limite maximale autorisée pour le chrome Cr (VI) dans l’eau potable est de 100 mg/L [17]. La forte toxicité de cet élément nécessite le traitement des eaux chromées. Les techniques classiques de traitement d’effluent contaminé par le chrome sont nombreuses ; on citera notamment les techniques de filtration membranaire [18], la précipitation [19], l’échange d’ions et l’adsorption [20,21]. L’utilisation de membranes et l’échange d’ions sont des méthodes d’élimination efficaces, mais qui restent trop coûteuses et sont par conséquent peu applicables à la production d’eau potable. L’adsorption est l’une des méthodes simples, efficaces, économiques et les plus utiles pour l’enlèvement des polluants des eaux usées. Dans ce cas, le matériau solide joue un rôle très important. Bien que, depuis l’Antiquité, le développement et l’utilisation de matériaux solides ont été l’un des objectifs fondamentaux de notre monde [1], ce n’est que depuis quelques années seulement que le développement de nouveaux matériaux, en l’occurrence les matériaux poreux, connaît un plein essor [22–26].
Parmi les différents adsorbants poreux généralement étudiés, les hydroxydes doubles lamellaires (HDL) ou encore les argiles anioniques font l’objet d’un vif intérêt depuis ces dernières années en vue d’applications variées, en raison de leur grande capacité d’échange anionique (2 à 5 mmol/g), de leur surface spécifique importante (20 à 120 m2/g), de la présence de charges sur cette surface et surtout de l’échangeabilité des anions interlamellaires [27–29]. La formule générale d’un HDL est [25,30,31] :
(1)[MII1−xMIIIx(OH)2]X+ [An−x/n]·mH2O
où MII est le cation divalent (Mg2+, Zn2+, Ni2+, Mn2+, Fe2+…), MIII le cation trivalent (Al3+, Cr3+, Fe3+, Co3+, Mn3+…), An− l’anion compensateur (Cl−, NO3−, ClO42−, CO32−…), m le nombre de molécules d’eau, n la charge de l’anion et x la fraction du cation (2+) dans la structure. Pour obtenir une structure pure, il est nécessaire que la valeur de x soit comprise entre 0,20 et 0,33 [31,32]. Cette formule générale montre clairement qu’il est possible de synthétiser un grand nombre de composés avec des stœchiométries différentes, voire même avec plus de deux métaux et de deux anions différents. Les hydroxydes doubles lamellaires, et plus particulièrement, les oxydes mixtes résultant de leur calcination, trouvent de nombreuses applications industrielles et en trouveront sûrement d’autres dans le futur, dans des domaines encore inexplorés. Leurs principales applications incluent leur utilisation comme catalyseurs, supports de catalyseur, dans les domaines médicaux, pharmaceutiques et électrochimiques. Ils sont considérés comme une nouvelle classe pour leur structure en feuillets, la plus favorable à la préparation des matériaux composites. En raison de leurs propriétés d’échanges anioniques, ces matériaux ont été largement utilisés comme adsorbants. Ils sont très efficaces surtout pour l’adsorption et l’intercalation des anions écologiquement indésirables, ainsi pour le piégeage des polluants, tels que CrO42−, CrO72−, SeO32−, SeO42−, l’arsenic… [12,33–38].
La présente étude porte sur l’élimination des anions dichromate (CrO72−) par les oxydes mixtes (HT-C) obtenus par calcination de l’hydrotalcite HT préparé par la méthode de coprécipitation.
2 Matériels et méthodes
2.1 Matériels
La synthèse de l’hydrotalcite a été réalisée par la méthode classique de coprécipitation [30]. À une solution aqueuse composée de Mg(NO3)2·6H20 (1 M) et de Al(NO3)2·9H2O (0,5 M) est ajoutée une solution de NaOH (3 M) et de Na2CO3 (0,943 M). L’addition se fait goutte à goutte sous agitation pendant 4 heures, à température ambiante. Afin de faciliter la cristallisation, le précipité obtenu a été chauffé à 70 °C durant 18 heures sous agitation continue. Puis, il a été centrifugé et lavé plusieurs fois à l’eau distillée afin de purifier au maximum le produit, et enfin séché à 80 °C pendant une nuit.
L’hydrotalcite préparé est calciné à 450 °C pendant 2 heures avant chaque mesure expérimentale d’adsorption et dénommé HT-C.
2.2 Techniques de caractérisation
Les diffractogrammes des phases préparées ont été obtenus à l’aide d’un diffractomètre à poudre D8 Advance équipé d’une anticathode en cuivre (raie Cu Kα, λ = 1,5406 Ǻ). Les diagrammes de diffraction ont été enregistrés avec une durée d’acquisition de 1 seconde par pas de 0,04° (2θ). Le domaine observé de l’angle (2θ) est compris entre 2 et 80°.
Les spectres IRTF ont été réalisés à l’aide d’un spectromètre PerkinElmer FT–IR Spectrum 1000, dans un domaine allant de 500 à 4000 cm−1. L’étude se fait à partir d’un échantillon broyé, puis mélangé à du bromure de potassium (Kr) dans les proportions ∼ 1:100. Le mélange est pastillé sous pression (≈ 10 tonnes/cm2).
L’analyse thermogravimétrique (ATG/ATD) a été réalisée avec un appareil PerkinElmer TGA-Q5000 sous air à une vitesse de montée en température de 10 °C/min, de la température ambiante jusqu’à 750 °C.
Les mesures texturales (BET) ont été effectuées à l’aide d’un appareil Coulter SA3100. Cette technique consiste à déterminer l’isotherme d’adsorption de l’azote gazeux à une température voisine de son point d’ébullition (–195 °C). Avant de démarrer les mesures d’adsorption, les échantillons subissent un dégazage pendant plusieurs heures sous vide à 250 °C.
Les analyses d’absorption UV–visible ont été effectuées sur un spectrophotomètre UV Pharma Spect 1700 (SHIMADZU) piloté par ordinateur. Les longueurs d’ondes maximales sont obtenues directement par balayage automatique entre 200 et 600 nm.
2.3 Cinétique d’adsorption des anions dichromate
Dans une série d’erlenmeyers de 50 mL, on place une masse m = 200 mg de HT-C, 25 mL d’une solution de dichromate de potassium (K2Cr2O7) de concentration égale 6 mmol/L. Ces erlenmeyers sont ensuite fermés, placés dans un bain thermostaté à température ambiante et agités de façon régulière (4 tr/min) pendant un intervalle de temps bien défini allant jusqu’à 30 heures d’agitation. La quantité d’anions dichromate (Cr2O72−) retenues sur HT-C est déterminée à l’aide de l’équation suivante :
| (2) |
où qt est la quantité de l’espèce adsorbée à l’instant t par unité de masse d’HT-C (mmol·g−1) et C0 et Ct sont les concentrations initiale et à l’instant t des anions dichromate (mmol·L−1), m est la masse d’HT-C (g) et V est le volume de la solution (L).
2.4 Isotherme d’adsorption
On place une masse m = 200 mg de HT-C en contact avec 25 mL de solution de dichromate (K2Cr2O7) à différentes concentrations [0–100 mmol/L]. Le temps de contact moyen est fixé à 24 heures, au bout duquel l’équilibre entre les différentes phases est supposé atteint. Les mélanges ont été ensuite centrifugés, et les surnageants ont alors été prélevés et analysés, dans les mêmes conditions, par spectrométrie d’adsorption UV–visible. L’isotherme d’adsorption est obtenue en traçant la quantité adsorbée par gramme d’adsorbant (qe) en fonction de la concentration d’adsorbat à l’équilibre (Ce). La quantité de dichromates adsorbée (qe) est calculée selon l’équation suivante :
| (3) |
où qe est la quantité de l’espèce adsorbée à l’équilibre (mmol·g−1) et C0 et Ce sont respectivement les concentrations initiale et résiduelle à l’équilibre des anions chromate (mmol·L−1).
2.5 Effet de la masse d’hydrotalcite
Dans cette partie, nous avons fait varier la masse de l’hydrotalcite calciné HT-C de 30 mg à 1200 mg (C0 = 6 mmol/L, t = 24 h, température = 25 °C).
2.6 Effet du pH sur l’adsorption des ions chromate
Dans toutes les expériences, la masse des échantillons est de 200 mg, le volume des solutions de dichromate de potassium est de 25 mL. La concentration a été fixée à 6 mmol·L−1, pour un temps de contact de 24 heures. Le pH de la solution initiale (pHi) a été ajusté par l’ajout de NaOH (1 M) et de HCl (1 M).
3 Résultats et discussion
3.1 Caractérisations physicochimiques
Nous avons représenté sur la Fig. 1 les diffractogrammes RX de l’hydrotalcite (HT), de (HT-C) après un traitement thermique à 450 °C durant 2 heures, et de (HT-H) après réhydratation de l’hydrotalcite calciné. La réhydratation de HT-C a été réalisée en mettant sous agitation la phase calcinée avec de l’eau distillée durant 1 heure à température ambiante, opération suivie d’un séchage à 80 °C pendant une nuit. Nous observons sur ce diagramme, et pour la phase non calcinée (Fig. 1a), la présence de deux types de réflexions : (i) des raies symétriques selon les plans hkl suivants : (003), (006), (110) et (113), ainsi que (ii) des raies asymétriques selon les réflexions : (012), (015) et (018), correspondant à des valeurs d’angles élevées caractérisant une phase pure unique de type hydrotalcite [39,40]. Nous constatons aussi sur ce diffractogramme que l’intensité de la raie (003), caractéristique de la distance interlamellaire, est très forte, traduisant une bonne cristallinité de la phase étudiée. La valeur calculée de cette distance (d003) obtenue est de l’ordre de 7,70 Ǻ, en accord avec celle trouvée dans la littérature [41]. Cette valeur est déterminée généralement par la somme de l’épaisseur du feuillet de type brucite et la taille d’anion interlamellaire ; la valeur de l’épaisseur de la brucite rapportée est de 4,78 Ǻ [41], la taille de l’anion CO32−, dans ce cas, est donc 2,9 Ǻ. La raie de la réflexion (110), qui représente la moitié de la distance métal–métal au sein du feuillet, est souvent exploitée afin de calculer les différents paramètres de la maille (a = 2·d110 ; c = d003 + 2 d006 + 3·d009 [31]) : ces derniers sont respectivement a = 3,055 A° et c = 23,19 A°. Pour l’échantillon HT-C (Fig. 1b), nous remarquons la disparition des raies caractérisant la phase HT due à la décarbonation et à la déshydroxylation de la structure lamellaire, et l’apparition de deux nouvelles bandes situées à 43,5 et 63° correspondant aux plans hkl (200) et (220) de la structure périclase (MgO, JCPDS 87-0653) [42]. Après réhydratation de HT-C, (Fig. 1c), nous observons le même spectre RX que celui de la phase HT non calcinée ; la valeur de la distance interlamellaire calculée est de l’ordre de 7,62 A°. Néanmoins, les raies de diffraction pour HT-H sont légèrement plus larges que celles pour HT (voir la figure insérée sur la Fig. 1) ; cet élargissement pourrait être attribué au processus de désintercalation/ré-intercalation des molécules d’eau ainsi que des anions CO32−.

Diagrammes de diffraction des rayons X de Mg2Al–CO3, (a) initial, (b) après un traitement thermique à 450 °C/2 heures et (c) après réhydratation.
L’analyse texturale N2-BET permet de déterminer la surface spécifique. D’après la Fig. 2, la forme des isothermes d’adsorption pour le Mg2Al-CO3 calciné et non calciné est de type IV selon la classification IUPAC, avec une hystérésis de type H3 caractéristique des matériaux mésoporeux [43,44]. La valeur obtenue de la surface spécifique pour l’HT non calciné est de 85 m2/g, très similaire à celle obtenue ailleurs [45]. Après calcination, une augmentation importante de la surface spécifique est observée, la valeur trouvée est de 251 m2/g pour l’échantillon HT-C. Soit un rapport de 3.

Isotherme d’adsorption de N2 à 77 K de la phase Mg2Al–CO3 calcinée et non calcinée.
Les résultats de l’analyse thermogravimétrique différentielle (Fig. 3) montrent que l’HT non calciné se décompose selon deux étapes endothermiques distinctes :
- • perte des molécules d’eau de surface et de celles intercalées vers 250 °C ;
- • déshydroxylation des feuillets, destruction de la structure lamellaire et formation des oxydes mixtes des métaux aux environs de 450 °C.

Analyse thermogravimétrique (ATG/ATD) pour la phase Mg2Al–CO3.
Le faible pic à très haute température, autour de 650 °C, est probablement dû à la perte de certains ions carbonate résiduels fortement liés aux feuilles de brucite.
Les spectres infrarouge superposés des phases HT, HT-C et HT-H sont rassemblés sur la Fig. 4. Pour la phase HT (Fig. 4a), la large bande située entre 3100 et 3700 cm−1 est attribuée au mode de vibration de valence des groupements OH−(OH···OH) de l’eau physisorbée et/ou au mode de vibration de valence des groupements OH−(M–OH) liés aux anions carbonates en présence de cations divalents et trivalents (Mg2+ et Al3+). La faible bande centrée vers 1636 cm−1 correspond au mode de vibration de déformation des molécules d’eau fortement adsorbées entre les feuillets. Dans un environnement symétrique, les anions carbonates peuvent être caractérisés par trois bandes de fréquences 1415 cm−1 (ν3(CO3)), 880 cm−1, (ν2 (CO3)) et 680 cm−1(ν4(CO3)). Dans notre échantillon, ces bandes sont décalées vers les faibles fréquences (ν3 est observée à 1372 cm−1). Ce décalage peut être expliqué par le réarrangement des anions CO32−dans l’espace interfoliaire en présence de molécules d’eau [46]. Après calcination (Fig. 4b), nous observons une diminution importante de l’intensité de tous les pics d’adsorption. L’intensité de la bande (νH2O) aux alentours de 1600 cm−1 semble décroître, traduisant le départ des molécules d’eau interfeuillets. Nous remarquons aussi un élargissement de la symétrie de la bande de vibration des anions carbonates ν3(CO3), avec une faible intensité par rapport à celle observée pour la phase HT, montrant la perte des ions carbonates durant la déshydratation de HT, le plus souvent sous forme de CO2. Après réhydratation (Fig. 4c), nous voyons clairement le très bon accord entre le spectre IR de la phase HT et celui de la phase HT-H, ceci montre la ré-intercalation des molécules d’eau ainsi que des anions carbonates CO32−dans l’espace interlamellaire et la formation d’une nouvelle phase HT.

Spectres infrarouge de la phase Mg2Al–CO3 (a) avant, (b) après un traitement thermique à 450 °C et (c) après réhydratation.
3.2 Étude de l’adsorption des anions Cr2O72−
Pour l’étude de l’élimination des anions chromate, nous avons utilisé la phase HT-C, car c’est la phase qui présente la surface spécifique la plus élevée.
3.2.1 Cinétique d’adsorption
Cette partie a pour objectif principal la détermination de la durée nécessaire afin d’obtenir l’équilibre de fixation des anions dichromate sur la phase HT-C. L’effet du temps de contact sur la rétention des ions dichromates par l’échantillon HT-C est présenté sur la Fig. 5. La courbe montre que l’adsorption des ions augmente avec le temps d’agitation et atteint l’équilibre au bout de 10 heures de contact. En effet, nous remarquons deux périodes, la première allant jusqu’à 10 heures, pendant laquelle l’activité de HT-C est très importante (la quantité maximale adsorbée au bout de 10 heures est de 0,45 mmol/g), puis, à partir de 10 heures, la réaction atteint presque un quasi-équilibre.

Cinétique d’adsorption des anions Cr2O72− sur L’HT-C (m = 200 mg, V = 25 ml et C0 = 6 mmol/L).
Différents modèles ont été appliqués, seul le modèle de pseudo premier ordre répond aux résultats expérimentaux dont l’équation est la suivante :
| (4) |
où k est la constante de vitesse du modèle de pseudo premier ordre (min−1) ; qe et qt sont les quantités adsorbées par unité de masse d’adsorbant à l’instant t et à l’équilibre, respectivement (mmol/g).
La vitesse de fixation des anions dichromate sur l’HT-C (Fig. 6) montre que la réaction d’adsorption procède par deux étapes, en accord avec l’équation de type :
| (5) |
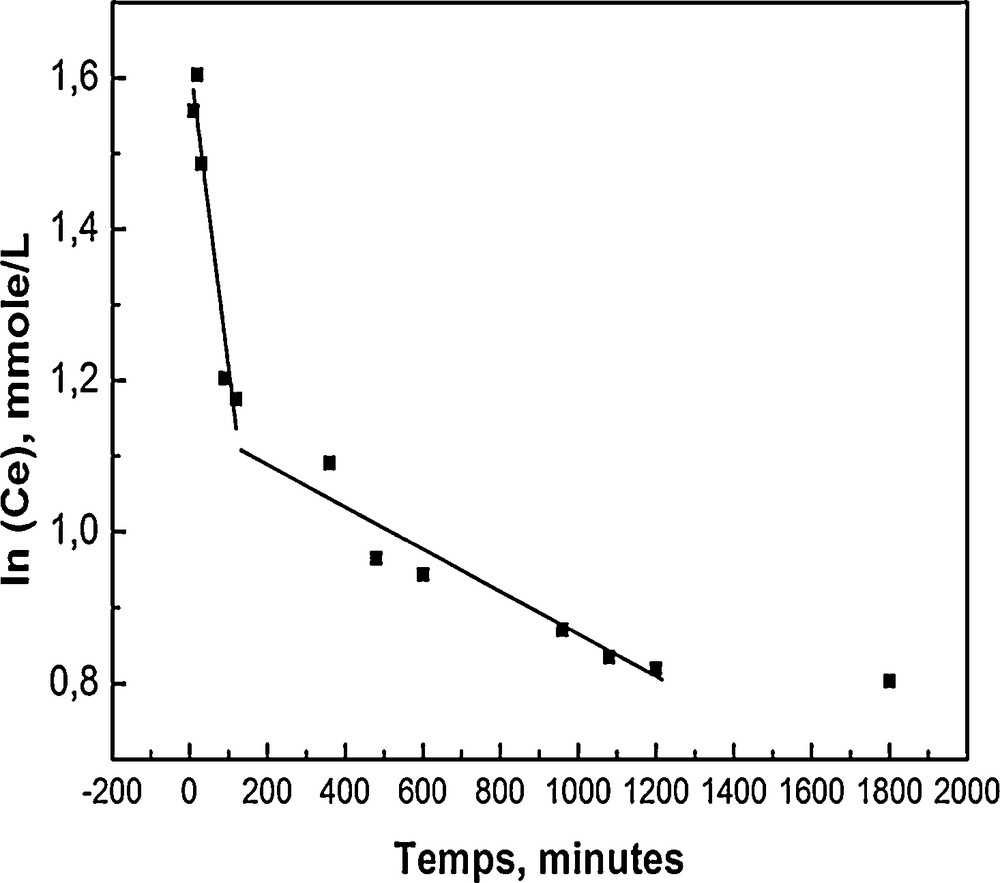
Vitesse de fixation des anions dichromate Cr2O72− sur HT-C (m = 200 mg, V = 25 ml et C0 = 6 mmol/L).
Le mécanisme d’adsorption des dichromates sur HT-C procède en deux étapes dont les constantes de vitesses sont différentes. La première étape est rapide et peut être interprétée par un processus de reconstruction de HT-C, connu sous le nom de l’effet de mémoire [48]. La seconde étape d’adsorption est lente, car, après reconstruction, les anions OH− et CO32− présents dans la solution entrent en compétition avec les anions dichromate, et réduisent la capacité d’adsorption de HT-C vis-à-vis des dichromates [37,47].
3.2.2 Isothermes d’adsorption
Nous avons représenté sur la Fig. 7 l’isotherme d’adsorption des anions dichromate sur HT-C ; l’allure de cette courbe montre une isotherme de type S selon la classification de Gilles et al. [49]. De plus, les résultats montrent que le HT-C possède une bonne affinité pour les ions dichromate, dont la capacité d’adsorption expérimentale à saturation est de 4,85 mmol/g. Les modèles d’isothermes d’adsorption sont généralement utilisés afin de décrire les interactions entre l’adsorbat et l’adsorbant lorsque le processus d’adsorption atteint l’équilibre, permettant ainsi d’extraire les paramètres importants pour la conception du système d’adsorption. Les données d’adsorption ont été analysées par les deux modèles de Langmuir et de Freundlich [50,51].

Isotherme d’adsorption des ions Cr2O72−sur HT-C, (m = 200 mg, V = 25 ml et t = 24 heures).
3.2.2.1 Modèle de Langmuir
L’équation de Langmuir, dérivée de la cinétique où des arguments d’équilibre sont communément appliqués à la chimisorption des gaz, a pour expression, dans le cas de l’adsorption en solution :
| (6) |
ave qe est la quantité adsorbée de Cr2O72− à l’équilibre (mmol/g), Ce est la concentration à l’équilibre (mmol/L), qmax est la capacité maximale d’adsorption (mmol/g) et KL est la constante de Langmuir, liée à la température et au système adsorbat–adsorbant (L·mmol−1).
La forme linéaire de l’équation de Langmuir est :
| (7) |
3.2.2.2 Modèle de Freundlich
L’équation de Freundlich est bien adaptée pour décrire l’équilibre en phase aqueuse. Sa formule empirique est :
| (8) |
où KF et sont les constantes de Freundlich reliées à la capacité d’adsorption et à l’intensité d’adsorption de l’adsorbant, respectivement.
La linéarisation de cette équation implique un passage sous forme logarithmique :
| (9) |
Les courbes des transformées linéaires de Langmuir et de Freundlich obtenues sont présentées dans la Fig. 8, et les différents paramètres calculés sont résumés dans le Tableau 1. Nous y observons de très bons coefficients de corrélation (R2) pour les deux modèles d’isotherme utilisés, qui sont respectivement de l’ordre de 0,999 et 0,997 pour celui de Langmuir et celui de Freundlich, respectivement. Nous pouvons en conclure que l’adsorption obéit à la fois au modèle de Langmuir et à celui de Freundlich.

Transformée linéaire de l’isotherme d’adsorption des ions Cr2O72−sur HT-C : (A) Langmuir, (B) Freundlich.
Constantes de transformée linéaire de Langmuir et de Freundlich pour l’adsorption des ions Cr2O72−.
| Échantillon | Langmuir | Freundlich | ||||
| qmax (mmol/g) | KL (mmol−1·L) | R2 | 1/n | KF (mmol/g) | R2 | |
| HT-C | 3,60 | 0,051 | 0,999 | 0,94 | 4,46 | 0,997 |
3.2.3 Effet de la masse d’adsorbant
Nous avons représenté sur la Fig. 9 l’évolution de la quantité adsorbée selon la variation de la masse d’HT-C utilisée. Sur cette figure, nous voyons que la masse exerce une grande influence sur le processus d’adsorption. En effet, la quantité adsorbée diminue fortement avec l’augmentation de la quantité d’HT-C, et demeure constante au-delà de 200 mg ; cet effet peut être attribué à l’augmentation de la surface et des sites actifs d’adsorption [45]. En outre, nous avons présenté sur la Fig. 9 l’allure du rendement d’adsorption des anions Cr2O72−sur HT-C (, exprimé en %) ; nous remarquons que ce rendement d’adsorption augmente au fur et à mesure que la masse d’HT-C augmente ; il croît de 30 % à 80 % si on augmente la masse de 30 à 200 mg, puis s’approche de 100 % pour des valeurs élevées en masse.

Effet de la masse de HT-C sur l’adsorption de Cr2O72−(V = 25 mL, C0 = 6 mmol/L et t = 24 h).
3.2.4 Effet du pH de la solution
Le pH de la solution initiale est un paramètre très important, qui influe fortement sur l’état de surface de HT-C ainsi sur sa capacité d’adsorption. De même, il détermine les espèces ioniques présentes en solution. L’effet du pH de la solution initiale sur la rétention des anions Cr2O72−est présenté sur la Fig. 10. Nous avons indiqué également sur la même figure la variation du pH à l’équilibre (pHe) après adsorption en fonction de pHi, valeur initiale. Sur la Fig. 10, nous constatons que le pH à l’équilibre, pHe, augmente au fur et à mesure que le pH de la solution initiale, pHi, augmente. Ceci est probablement dû à la libération des ions OH− lors de la reconstruction de la structure de HT-C [38]. La Fig. 10 présente également l’évolution de la quantité adsorbée d’ions dichromate en fonction de pHi. Nous observons que la quantité adsorbée augmente en fonction de pHi (cette dernière valeur allant de 1 à 4). D’après cette figure, le meilleur pH pour l’adsorption avoisine la valeur 4. Pour des pH supérieurs à 4, nous observons une diminution de la quantité adsorbée. À pH acide (pHi < 3), la diminution de la capacité d’adsorption est probablement liée à la dissolution de l’HT-C dans la solution, tandis qu’à pH basique, la diminution de l’adsorption peut être expliquée par l’adsorption compétitive des ions OH−de la solution et des ions chromate [37,45]. Le mécanisme d’élimination des ions chromate par l’oxyde mixte HT-C peut être interprété sur la base des équations (10–13). L’espèce dominante du Cr(VI) à pH < 5 est HCrO4− [52].
| (10) |
| (11) |
| (13) |

Adsorption de Cr2O72−sur HT-C (m = 200 mg, C0 = 6 mmol/L et t = 24 h).
Des résultats similaires ont été mentionnés par d’autres auteurs [53]. Le maximum d’adsorption a été obtenu à pH = 4. Nous pouvons expliquer ce résultat par les attractions électrostatiques entre la surface de HT-C (MOH(s)) chargée positivement et l’espèce HCrO4−selon l’équation (14) :
| MOH(s) + H3O+ + HCrO4+ → MOH2+–CrO4– + H2O | (14) |
Enfin, nous avons suivi par IR la bande de vibration des anions carbonates (CO32−) après fixation des anions dichromate (Cr2O72−). Nous remarquons sur la Fig. 11 que le pic observé autour de 1370 cm−1, caractéristique du mode de vibration des anions carbonate, diminue en intensité avec l’augmentation de la concentration des ions dichromate ; ceci traduit probablement l’intercalation de ces derniers dans l’espace interlamellaire en remplacement des ions carbonate, qui s’ajoute aux interactions électrostatiques.

Spectre IR de la phase Mg2Al–CO3 : (a) état initial, après adsorption des ions Cr2O72−, (b) C1 = 2·10−4 mol/L et (c) C2 = 8·10−2 mol/L.
4 Conclusion
L’objectif principal de ce travail était d’étudier l’adsorption des anions Cr2O72−sur une argile anionique de type hydrotalcite. Comme nous avons montré précédemment, les oxydes mixtes formés de la phase hydrotalcite calcinée montrent une surface très importante, ces oxydes pouvant revenir à la structure originale via réhydratation et incorporation simultanée des anions dans l’interfeuillet de la solution mise en contact : c’est l’effet de reformation et de reconstruction des HT. Pour cela, nous avons choisi la phase calcinée HT-C, qui montre une bonne rétention pour l’adsorption des anions dichromate, comme adsorbant. L’étude de l’adsorption nous a permis d’établir l’isotherme d’adsorption : à ce stade, deux modèles théoriques d’adsorption sont appliqués, celui de Langmuir et celui de Freundlich. L’étude de la cinétique d’adsorption des ions Cr2O72− sur HT-C montre que l’adsorption procède par deux étapes, dont la première est rapide, l’équilibre étant atteint au bout de 10 heures de contact entre les anions dichromate et l’HT-C.


