1 Introduction
Le paludisme est la parasitose la plus répandue dans le monde. Même si les chiffres récents annoncent une diminution globale de mortalité de 25% dans la région africaine par rapport à la situation de 2000, il reste l'un des facteurs de pauvreté très important sur ce continent [1]. Environ 300–500 millions de cas cliniques et de 1,2 à 2,8 millions de décès dus au paludisme surviennent chaque année. Le Plasmodium falciparum, espèce responsable du taux de mortalité et de morbidité dû au paludisme en Afrique sub-saharienne, développe des résistances aux traitements actuels tels les ACT [2]. Face à ce phénomène, la recherche de nouveaux antipaludiques est d'un besoin urgent. L'isolement de la quinine et de l'artémisinine à partir des espèces Cinchona ledgeriana et Artemisia annua respectivement et de plusieurs autres métabolites secondaires ayant des propriétés antimalariales valide les plantes médicinales comme une source potentielle de médicaments [3]. Les plantes du genre Vitex sont connues pour leur utilisation en médecine traditionnelle dans le traitement du paludisme [4]. Ce genre comprend près de 250 espèces constituées d'arbres ou d'arbustes localisés dans les régions tropicales et subtropicales [5].
Vitex thyrsiflora Baker (Verbenaceae) est un petit arbre glabrescent largement répandu au Cameroun [6]. Dans les régions où ils sont trouvés, leurs écorces du tronc sont utilisées pour le traitement de l'orchite. Au Cameroun, plus précisément dans la région du Littoral, la population locale utilise la décoction des écorces du tronc pour traiter les infections parasitaires, incluant le paludisme [6]. Les écorces des racines sont également utilisées dans le traitement des douleurs de l'estomac et de la stérilité [7]. Les études chimiques antérieures menées sur les feuilles et les fruits de cette plante ont conduit à l'isolement de la 20-hydroxyecdysone [7]. Toutefois, les recherches effectuées sur d'autres espèces du genre Vitex ont abouti à l'isolement des iridoïdes [8], des lignanes [9,10], des diterpènes [11,12], des stéroïdes [13], des flavonoïdes et des triterpénoïdes [10]. À notre connaissance, aucune étude phytochimique et biologique n'a été rapportée jusqu'à présent sur les écorce du tronc de cette plante.
Dans le cadre de la recherche de nouvelles substances antiplasmodiales à partir des plantes médicinales du Came-roun [14], nous avons porté nos investigations sur l'étude phytochimique, l'activité antiplasmodiale in vitro des extraits et des composés purifiés à partir de Vitex thyrsiflora Baker.
2 Méthodologie
2.1 Partie expérimentale
Les points de fusion ont été mesurés sur un appareil de point de fusion X-4-micro et ne sont pas corrigés. Les spectres Infrarouge (IR) ont été enregistrés sur un spectrophotomètre SHIMADZU FTIR-8400S. Les rotations optiques ont été obtenues avec un polarimètre numérique JASCO P-1020. Les spectres de masse en impact électronique (I.E à 70 eV) ont été obtenus à l'aide d'un spectrophotomètre de type Jeol JMX AX-500 et d'un spectromètre AX-700. Les spectres de masse à haute résolution en mode électrospray (ESI) ont été réalisés sur un spectromètre Micro masse Time of flight QTOF (Daltonique Bruker). Les spectres de RMN 1H et 13C ont été enregistrés sur un spectromètre de type Bruker Avance I DRX 500, tandis que les spectres RMN 2D ont été réalisés sur un spectromètre de type Bruker Avance 600. Les déplacements chimiques (δ) sont exprimés en partie par million (ppm) avec le tétraméthylsilane (TMS) comme référence interne. Les constantes de couplage (J) sont exprimées en hertz (Hz). Les diverses chromatographies de purification ont été réalisées en utilisant comme phase stationnaire le gel de silice de type Merck, dont les particules ont un diamètre compris entre 0,063 et 0,200 mm ou le gel de Séphadex LH-20. Les plaques préfabriquées de silice 60 GF254 ont été utilisées pour la chromatographie sur couche mince et révélées à la lumière UV (254 ou 365 nm), ensuite pulvérisées avec l'acide sulfurique à 50% et chauffées à l'étuve.
2.2 Matériel végétal
Les écorces du tronc de V. thyrsiflora Baker (Verbenaceae) ont été récoltées en novembre 2009 à Melong (région du Littoral, Cameroun). Elles ont été identifiées par M. Nana Victor par comparaison de l'échantillon à un spécimen authentique de l'Herbier national du Cameroun (N° 34861 HNC).
2.3 Extraction et isolement
Les écorces du tronc de V. thyrsiflora ont été découpées, séchées et broyées. La poudre obtenue (6 kg) a été extraite à température ambiante avec un mélange CH2Cl2/MeOH (1:1, 3 × 15 L) pendant 3 jours, pour fournir 170 g d'extrait brut après évaporation sous pression réduite. Une portion de cet extrait (160 g) a été suspendue dans l'eau (1 L) et extraite de nouveau au CH2Cl2 (3 × 1,5 L), à l'AcOEt (3 × 1,5 L) et au n-BuOH (3 × 1,5 L) pour donner respectivement 70, 20 et 80 g. 60 g de la fraction soluble au CH2CI2 ont été chromatographiés sur colonne de gel de silice, élués au système n-hexane/AcOEt (100:0 ; 95:5 ; 90:10 ; 80:20 ; 1:1 ; 0:100) puis AcOEt-MeOH (90:10 ; 80:20 ; 0:10), par polarités croissantes, pour donner 47 fractions de 600 mL. Ces fractions ont été recueillies et combinées sur la base de la CCM analytique pour conduire à cinq fractions majeures A–E (A : 1–6 ; B : 7–10 ; C : 11–16 ; D : 17–35, E : 36–47). La fraction A (10 g), contenant principalement les acides gras, n'a pas été étudiée. La fraction B (2 g) a été purifiée par chromatographie sur colonne de gel de silice (Φ 30 mm × L 500 mm) avec le système n-hexane/AcOEt (100:0, 99:1, 98:2, 95:5, 90:10, 85:15 et 80:20) pour donner les composés 2 (30 mg) et 3 (45 mg). De même, la fraction C (10 g) a été chromatographiée sur colonne de gel de silice (Φ 60 mm × L 400 mm) avec un mélange n-hexane/AcOEt (100:0, 95:5, 90:10, 85:15, 80:20, 70:30 et 0:100) pour donner les composés 4 (20 mg) et 5 (36 mg). La fraction D (10 g) a été également séparée par chromatographie à l'aide d'une colonne de gel de silice (Φ 30 mm × L 500 mm) en utilisant le système de solvant n-hexane/AcOEt (100:0, 95: 5, 90:10 et 0:100) comme phase mobile. Les sous-fractions éluées avec le système n-hexane/AcOEt (95: 5) (70 mg) ont été combinées et chromatographiées à nouveau avec le système n-hexane/acétone/CH2Cl2 (8.5:1:0.5) pour conduire au composé 1 (52 mg) et á un mélange complexe de β-sitostérol, campestérol et stigmastérol (5 g). La fraction E (5,0 g) a précipité dans l'AcOEt et nous avons obtenu après filtration le composé 6 (100 mg).
2.4 Evaluation de l'activité antiplasmodiale in vitro et de la cytotoxicité
Les tests de sensibilité aux extraits et composés ont été réalisés sur des plaques de 96 puits selon la méthode décrite par Desjardins et al. [15], avec quelques modifications [14,15]. Les produits à tester ont été préalablement dissous dans 200 μL de diméthylsulfoxyde (DMSO) et prédilués avec le milieu de culture pour obtenir une concentration finale de 1000 μg/mL (extraits bruts et fractions) et 200 μg/mL (composés purs). Les essais précédents ont montré que les concentrations inférieures ou égales à 0,5% étaient inactives sur le Plasmodium falciparum. Toutes les solutions stock ont été stérilisées par passage à travers un microfiltre de 0,2 μm de diamètre avant leur conservation à −20 °C jusqu'à l'utilisation. Dans les mêmes conditions, une solution stock de dichlorhydrate de quinine à 2 μg/mL (Rotexmedica, Trittau, Allemagne) a été préparée et utilisée comme contrôle positif. Cependant, le milieu ajusté à 0,5% v/v de DMSO a été utilisé comme contrôle négatif ; ainsi, le DMSO a été au contact des parasites. La parasitémie, préalablement estimée par microscopie (appréciation qualitative), a été quantifiée au début et à la fin du test par la méthode enzymatique qui repose sur l'activité de la lactate déshydrogénase [14].
La cytotoxicité des extraits et des composés pures a été évaluée contre la souche LLC-MK2 (ATCC) des cellules épithéliales de rein de singe, en utilisant le test de tétrazolium [(3-(4,5-diméthylthiazol-2-yl))] (MTT) [16,17].
3 Résultats et discussion
L'extrait au dichlorométhane des écorces du tronc de V. thyrsiflora a été chromatographié sur une colonne de gel de silice pour donner plusieurs sous-fractions, qui ont été de nouveau purifiées sur colonne de chromatographie ouverte pour conduire à six composés connus (Fig. 1). Ces derniers ont été identifiés à l'acide 20(R),24(E)-3-oxo-9β-lanosta-7,24-dien-26-oïque (1) [18], α-amyrine (2) [19], β-amyrine (3) [20], friédeline (4) [20], palmitate de β-sitostérol (5) [21] et au glucoside de β-sitostérol (6) [20], tous rapportés ici pour la première fois dans cette plante. Leurs structures ont été élucidées sur la base de leurs données spectroscopiques par comparaison avec celles de la littérature.
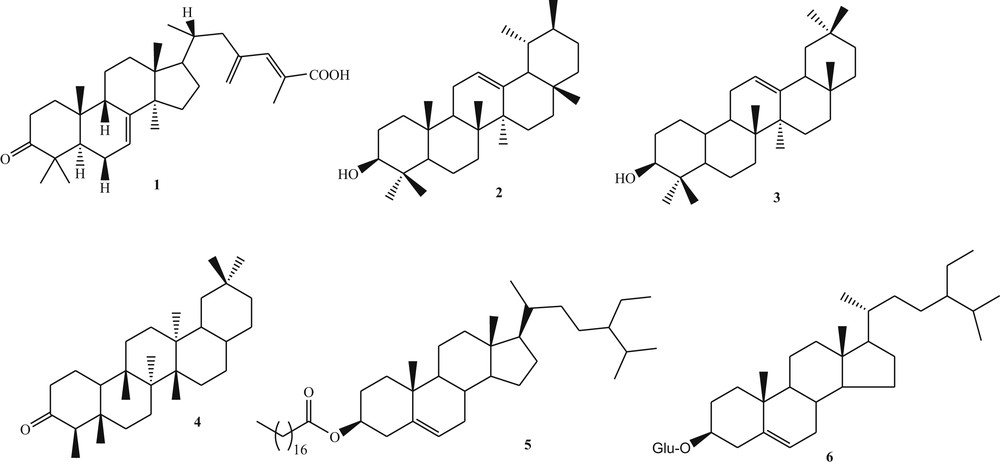
Structures des composés isolés (1–6).
Les extraits à l'AcOEt et au CH2Cl2 ainsi que les fractions issues de l'extrait au CH2Cl2 et quatre des composés isolés (1, 3–5) ont été évaluées pour leur activité antiplasmodiale in vitro contre les souches multi-résistantes Dd2 et K1 de P. falciparum (Tableau I). L'extrait à l'AcOEt a présenté une activité antiplasmodiale in vitro modérée (15 μg/mL ≤ CI50 ≤ 50 μg/mL), tandis que l'extrait au CH2Cl2 a été actif (5 μg/mL ≤ CI50 ≤ 15 μg/mL) avec une CI50 = 14,32 μg/mL [22]. La fraction E a présenté une activité antiplasmodiale in vitro très intéressante (CI50 < 5 μg/mL), suivie de la fraction D qui a été active (5 μg/mL ≤ CI50 ≤ 15 μg/mL). Les fractions A et B ont présenté une activité antiplasmodiale in vitro modérée (15 μg/mL ≤ CI50 ≤ 50 μg/mL) comparée à la fraction C qui a été inactive (CI50 > 50 μg/mL). De tous les composés testés, seul le palmitate de β-sitostérol a présenté une activité antiplasmodiale très significative avec les CI50 de 3,09 et 8,98 μg/mL. L'acide 20(R),24(E)-3-oxo-9β-lanosta-7,24-dien-26-oïque (1) et la friédeline (4) ont été faiblement actifs avec des CI50 allant de 16,09 à 21,34 μg/mL, respectivement, tandis que la β-amyrine (3) s'est avérée inactive (CI50 > 50 μg/mL). Selon Bero et al. [22], l'activité antiplasmodiale in vitro d'un composé est considérée comme très grande lorsque sa CI50 < 1 μg/mL. Pour une 2 μg/mL ≤ CI50 ≤ 11 μg/mL, le composé est actif. Lorsque 11 μg/mL ≤ CI50 ≤ 50 μg/mL, il est considéré comme faiblement actif. Les composés ayant une CI50 > 50 μg/mL sont considérés inactifs [22]. Les résultats obtenus démontrent que le composé 5 présente un potentiel considérable et pourrait être exploité comme point de départ pour les hémi-synthèses des composés antiplasmodiaux. Re-tester cette molécule en combinaison avec d'autres principes actifs pourrait également accroître son efficacité. La friedeline (4) a été précédemment isolée des écorces du tronc de Endodesmia calophylloides (Guttiferae) et évaluée pour son activité antiplasmodiale in vitro contre la souche chloroquino-résistante W2 de P. falciparum. Elle a montré une CI50 de 7,2 μM, illustrant une activité modérée de cette molécule [23]. Néanmoins, les tests effectués ici ont plutôt révélé une activité négligeable sur les souches W2 et K1, ce qui souligne une grande variabilité de l'effet de l'activité de la friedeline en fonction des souches de parasite en présence. Le glucoside de sitostérol (6) n'a plus fait l'objet de test dans le présent travail car il a été précédemment évalué in vitro et largement exploré par d'autres auteurs. Ledit composé (6) a démontré, en culture synchronisée, une activité considérable contre la souche sensible 3D7 (CI50 = 1,90 μg/mL) et une très faible activité contre la souche résistante à la quinine Dd2 (CI50 = 5,34 μg/mL) [24] ; tandis qu'elle a été reportée inactive (CI50 > 10 μg/mL) sur la souche W2 en culture synchronisée [25]. Toutes les molécules testées ont été non cytotoxiques sur la souche de cellules épithéliales de singe, même à 75 μg/mL de concentration. L'activité antiplasmodiale in vitro de cette plante ainsi que celle des composés 1 et 5 sont rapportées ici pour la première fois.
Activité antiplasmodiale in vitro de l'extrait à l'AcOEt, au dichlorométhane, des fractions et de quatre composés (1, 3–5) isolés de V. thyrsiflora.
| Substances | Activité antiplasmodiale | Cytotoxicité | |
| CI50 sur Dd2 (μg/mL) | CI50 sur K1 (μg/mL) | CC50 sur LLC-MK2 (μg/mL) | |
| Extrait à l'AcOEt | 16,75 ± 4,34 | – | – |
| Extrait au CH2Cl2 | 14,32 ± 0,59 | – | – |
| F–A | 31,76 ± 1,49 | – | – |
| F–B | 46,54 ± 6,67 | – | – |
| F–C | 65,53 ± 6,23 | – | – |
| F–D | 12,96 ± 2,41 | – | – |
| F–E | 3,93 ± 0,04 | – | – |
| L'acide 20(R),24(E)-3-oxo-9β-lanosta-7,24-dien-26-oïque (1) | 16,09 ± 2,13 | 45,58 ± 0,98 | >100 |
| β-amyrine (3) | 67,56 ± 2.45 | 78,59 ± 1.85 | >100 |
| Friedeline (4) | 21,34 ± 3.56 | 13,66 ± 1.07 | >100 |
| Palmitate de β-sitostérol (5) | 3,09 ± 0.88 | 8,98 ± 2.39 | >100 |
| Quinine | 0,0035 ± 0,002 | 0,060 ± 0,01 | – |
4 Conclusion
Les études menées sur l'extrait au dichlorométhane des écorces du tronc de Vitex thyrsiflora ont conduit à l'isolement de six composés (Fig. 1). Cet extrait a été actif (CI50 > 10 μg/mL) contre la souche Dd2 de P. falciparum résistante à la quinine. Quatre composés isolés dudit extrait ont été évalué pour leur activité antiplasmodiale contre les souches multi-résistantes Dd2 et K1 de P. falciparum. L'acide 20(R),24(E)-3-oxo-9β-lanosta-7,24-dien-26-oïque (1), la β-amyrine (3), et le palmitate de β-sitostérol (5) ont été identifiés comme les principes actifs dudit extrait (Tableau I). Les résultats de l'activité antiplasmodiale in vitro de l'extrait brut et des composés 1, 4 et 5 pourraient ainsi justifier l'utilisation de cette plante en médecine traditionnelle pour le traitement du palu-disme et suggèrent que ces métabolites soient considérés comme de potentiels candidats d'agents antipaludiques.
Remerciements
Nous sommes reconnaissants envers l'université de Dschang pour le financement de certains consommables, la Fondation internationale pour la science (IFS), Stockholm (Suède), l'Organisation pour l'interdiction des armes chimiques, La Haye, Pays-Bas (FIS OIAC, financement n° F/4901-1 [Prof. Hippolyte K. Wabo] et n° F/5122-1 [Dr Denis Zofou]) et l'Académie chinoise des sciences (CAS) pour leur soutien financier.


