1 Introduction
Les maladies infectieuses, notamment le paludisme à Plasmodium falciparum, les helminthoses à Haemonchus contortus et les candidoses à Candida albicans, font partie des maladies humaines et animales les plus récurrentes et graves [1–5]. Malheureusement, la plupart des médicaments anti-infectieux proposés pour leur traitement peuvent présenter actuellement une inefficacité liée majoritairement à la pharmacorésistance développée par les germes infectieux [6–9]. Cette situation fait de la lutte contre ces pathologies un enjeu de santé publique et de sécurité alimentaire primordial. Dans un tel contexte, il est nécessaire d’élaborer sans cesse de nouveaux médicaments pour une chimiothérapie anti-infectieuse performante. C’est dans cette perspective que nous nous sommes intéressés au noyau imidazopyridine et à l’enchainement arylpropénone des chalcones en tant que pharmacophores d’activité anti-infectieuse. L’hétéroaryle imidazo[1,2-a]pyridine, souvent considéré comme isostère, voire bioisostère du noyau benzimidazole (Fig. 1) par suite de l’internalisation d’un des atomes d’azote imidazolique du benzimidazole, fait actuellement l’objet d’intenses investigations en vue de son utilisation en tant que vecteur pharmacophore pour l’élaboration de nouveaux médicaments. Il possède de nombreuses propriétés biologiques, dont des propriétés anti-infectieuses, en l’occurrences des propriétés anthelminthiques, comme le benzimidazole [10–12], antifongiques, car c’est avant tout un azolé comme celui des antifongiques médicamenteux [13–15], antiprotozoaires [16,17], antibactériennes [18,19], antituberculeuses [20] et antivirales [21,22]. Même s’il n’existe à ce jour aucun médicament anti-infectieux à noyau imidazopyridine, ce dernier pourrait prochainement remplacer le benzimidazole dans la mise au point de nouveaux agents anti-infectieux, tant en médecine humaine que vétérinaire. En effet le noyau benzimidazole, support hétérocyclique important de nombreuses molécules à activité pharmacologique [23–25] commence à montrer ses limites en infectiologie, notamment en parasitologie, par l’émergence de nombreuses pharmacorésistances [26,27]. Un autre groupement chimique, en l’occurrence l’enchainement arylpropénone des chalcones ou 1,3-diphényl-2-propènones (Fig. 1), retient actuellement l’attention des pharmacochimistes. En effet, ce groupement fonctionnel constitue un excellent pharmacophore pour la mise au point de nombreux candidats medicaments, tant pour traiter les maladies métaboliques que les maladies infectieuses [28–31]. À l’origine utilisées en tant que ligand régulateur de certaines voies de signalisation cellulaire, les chalcones auraient des activités biologiques liées à la présence du groupement arylpropénone, qui se comporterait comme un accepteur de Michaël capable de complexer les enzymes à fonction thiol (glutathion S-transférase, cystéine, kératine, etc.) [32,33]. Aussi, en utilisant le concept pharmacochimique de mise au point de nouvelles molécules hybrides par juxtaposition d’entités bioactives comme stratégie de création de nouveaux agents anti-infectieux [34–39], nous avons conceptualisé et préparé de nouveaux composés hybrides à profil chimique d’imidazopyridinyl-arylpropénones (Fig. 1). Afin d’identifier, au travers d’une étude de relations structure–activité, de potentiels candidats anti-infectieux pour un développement futur, nous avons réalisé un criblage anti-infectieux de ces composés. Le présent travail décrit donc la conception, la synthèse puis la caractérisation physico-chimique de nouveaux hybrides d’imidazopyridinyl-arylpropénones. Il décrit également leurs activités in vitro tant antiparasitaires (antiplasmodiales et nématocides) vis-à-vis de P. falciparum et H. contortus que leurs activités antifongiques vis-à-vis de C. albicans.
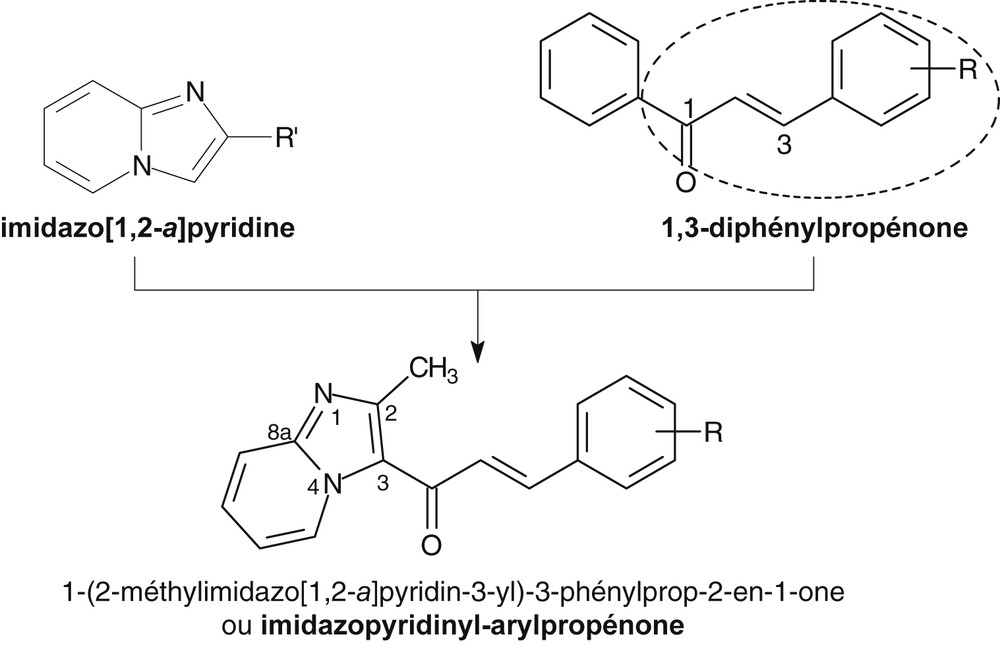
Stratégie d’accès aux imidazopyridinyl-arylpropénones par juxtaposition d’entités anti-infectieuses.
2 Chimie
Pour préparer les arylpropénones de l’imidazopyridine 5, nous avons adopté la méthode classique de condensation de Claisen–Schmidt d’un arylaldéhyde avec une méthylcétone (Fig. 2). Le dérivé cétonique utilisé dans cette étude a été préparé selon la méthode décrite par Lombardino [40]. Ainsi le 3-acétyl-2-méthylimidazo[1,2-a]pyridine 3 a été obtenu à partir de la 2-aminopyridine 1 et de la 3-chloro-penta-2,4-dione 2 par suite d’une réaction d’hétérocyclisation au sein de l’éthanol à reflux (Fig. 2). L’accès aux imidazopyridinyl-arylpropénones a consisté dès lors en une condensation du dérivé méthylcétonique 3 avec des benzaldéhydes commerciaux convenablement choisis 4.

Procédure générale de préparation des imidazopyridinyl-arylpropénones (5a–y).
La méthode pratique d’accès aux composés 5 a consisté à soumettre à température ambiante le 3-acétyl-2-méthylimidazopyridine 3 à l’action de 1,2 équivalents de benzaldéhydes au sein d’un mélange éthanolique de soude à 7,5 équivalents durant 4 à 6 heures. La neutralisation du milieu réactionnel par une solution d’acide acétique à 30% a permis d’isoler les composés 5 sous forme de précipité. La purification de ces derniers par recristallisation au sein de solvants convenablement choisis a conduit aux composés 5a–y, avec des rendements de 30 à 90%.
L’identification spectroscopique de ces produits (Tableau 1) révèle effectivement la présence de groupements chimiques caractéristiques. Il s’agit pour le 2-méthylimidazo[1,2-a]pyridine du groupement imine en C8a (–C=N) et du méthyle (CH3) en C2. Quant à l’enchainement arylpropénone, celui-ci a été caractérisé par la présence effective de la propénone (CO–CHCH), c’est-à-dire du carbone du carbonyle conjugué aux protons vinyliques de la liaison éthylénique. Pour tous les composés caractérisés, les spectres de résonance magnétique nucléaire (1H, 300 MHz et 13C, 75 MHz) ont été enregistrés sur un appareil Brucker Avance 300. Les spectres de masse ont été enregistrés sur un spectromètre JEOL JMS DX300 en mode ESI (ionisation par électrospray/quadripolaire ou ESI masse). Les points de fusion (PF) ont été déterminés au moyen d’un banc de Kofler et ne sont pas corrigés. Les solvants et réactifs, y compris les benzaldéhydes utilisés, proviennent d'Aldrich (France) ou d'Acros Organics (France). Les médicaments de référence ivermectine, fenbendazole, fluconazole, chloroquine proviennent de Sigma Chemical Co. (USA) et ont été fournis sous forme de poudre pure. Par ailleurs, une 1,3-diphénylpropénone ou modèle moléculaire arylpropénone a été synthétisée sous forme de poudre dans notre laboratoire selon la méthode de Claisen–Schmidt, à l'aide de l’acétophénone et du benzaldéhyde.
Données physicochimiques des groupements caractéristiques des composés 5a–y.
| Composés | R | Données physicochimiques : 1H, 13C NMR (DMSO-d6, δ ppm) de –CN, CH3, –CO–CHCH–et données ESI masse |
| 5a | H | 1H: 7.80 (1H, d, J = 15.6 Hz, CHCH); 7.50 (1H, d, J = 15.6 Hz, CHCH); 2.89 (3H, s, CH3). 13C: 179.50 CO); 151.98 CN), 141.56 (CHCH); 121.69 (CHCH); 18.36 (CH3). ES+ SM: 263 [M+H+]. Recristallisation : MeCN/H2O (1:1). Rendement : 80%. PF: 156–158 °C |
| 5b | 2-CH3 | 1H: 7.75 (1H, d, J = 16 Hz, CHCH); 7.48 (1H, d, J = 16 Hz, CHCH); 2.89 (3H, s, CH3). 13C: 179.35 CO); 152.04 CN); 141.50 (CHCH); 121.70 (CHCH); 18.12 (CH3). ES+ SM: 277 [M+H+]. Recristallisation : cyclohexane. Rendement : 70%. PF: 153–155 °C |
| 5c | 3-CH3 | 1H: 7.75 (1H, d, J = 16 Hz, CHCH); 7.54 (1H, d, J = 16 Hz, CHCH); 2.81 (3H, s, CH3). 13C: 179.22 CO); 152.07 CN); 141.57 (CHCH); 121.77 (CHCH); 18.09 (CH3). ES+ SM: 277 [M+H+]. Recristallisation : hexane/DCM (3:1). Rendement : 71%. PF: 127–130 °C |
| 5d | 4-CH3 | 1H: 7.75 (1H, d, J = 16 Hz, CHCH); 7.48 (1H, d, J = 16 Hz, CHCH); 2.89 (3H, s, CH3). 13C: 179.36 CO); 151.98 CN); 141.56 (CHCH); 121.70 (CHCH); 18.10 (CH3). ES+ SM: 277 [M+H+]. Recristallisation : cyclohexane. Rendement : 68%. PF: 151–153 °C |
| 5e | 4-CH(CH3)2 | 1H: 7.78 (1H, d, J = 15.8 Hz, CHCH); 7.45 (1H, d, J = 15.8 Hz, CHCH); 2.89 (3H, s, CH3). 13C: 179.36 CO); 151.98 CN);; 141.56 (CHCH); 121.70 (CHCH); 18.10 (CH3). ES+ SM: 305 [M+H+]. Recristallisation : hexane. Rendement : 58%. PF: 132–135 °C |
| 5f | 2-OH | 1H: 7.80 (1H, d, J = 15.6 Hz, CHCH); 7.38 (1H, d, J = 15.6 Hz, CHCH); 2.78 (3H, s, CH3). 13C: 179.50 CO); 151.95 CN); 141.56 (CHCH); 120.89 (CHCH); 18.26 (CH3). ES+ SM: 279 [M+H+]. Recristallisation : éthanol. Rendement : 56%. PF: > 260 °C |
| 5g | 3-OH | 1H: 7.80 (1H, d, J = 15.6 Hz, CHCH); 7.38 (1H, d, J = 15.6 Hz, CHCH); 2.78 (3H, s, CH3). 13C: 179.17 CO); 152.01 CN); 141.59 (CHCH); 120.70 (CHCH); 18.07 (CH3). ES+ SM: 279 [M+H+]. Recristallisation : éthanol. Rendement : 70%. PF: 255–257 °C |
| 5h | 4-OH | 1H: 7.80 (1H, d, J = 15.6 Hz, CHCH); 7.38 (1H, d, J = 15.6 Hz, CHCH); 2.78 (3H, s, CH3). 13C: 179.39 CO); 151.43 CN); 141.97 (CHCH); 121.88 (CHCH); 18.10 (CH3). ES+ SM: 279 [M+H+]. Recristallisation : éthanol. Rendement : 57%. PF: > 260 °C |
| 5i | 2-OCH3 | 1H: 7.72 (1H, d, J = 15.6 Hz, CHCH); 7.50 (1H, d, J = 15.6 Hz, CHCH); 2.80 (3H, s, CH3). 13C: 179.30 CO); 152.05 CN); 141.22 (CHCH); 120.90 (CHCH); 18.20 (CH3). ES+ SM: 293 [M+H+]. Recristallisation : hexane/DCM (3:1). Rendement : 71%. PF: 196–198 °C |
| 5j | 3-OCH3 | 1H: 7.72 (1H, d, J = 15.6 Hz, CHCH); 7.50 (1H, d, J = 15.6 Hz, CHCH); 2.80 (3H, s, CH3). 13C: 179.30 CO); 152.05 CN); 141.22 (CHCH); 120.92 (CHCH); 18.03 (CH3). ES+ SM: 293 [M+H+]. Recristallisation : hexane/DCM (3:1). Rendement : 70%. PF: 127–129 °C |
| 5k | 4-OCH3 | 1H: 7.72 (1H, d, J = 15.6 Hz, CHCH); 7.48 (1H, d, J = 15.6 Hz, CHCH); 2.79 (3H, s, CH3). 13C: 179.41 (CO); 151.70 (CN); 141.52 (CHCH); 121.89 (CHCH); 18.11 (CH3). ES+ SM: 293 [M+H+]. Recristallisation : acétate d’éthyle. Rendement : 73%. PF: 158–160 °C |
| 5l | 3,4-di-OCH3 | 1H: 7.66 (1H, d, J = 15.6 Hz, CHCH); 7.33 (1H, d, J = 15.4 Hz, CHCH); 2.81 (3H, s, CH3). 13C: 179.45 (CO); 148.90 (CN); 141.92 (CHCH); 121.89 (CHCH); 18.0 (CH3). ES+ SM: 323 [M+H+]. Recristallisation : hexane/DCM (3:1). Rendement : 70%. PF: 169–171 °C |
| 5m | 2,5-di-OCH3 | 1H: 7.66 (1H, d, J = 15.6 Hz, CHCH); 7.35 (1H, d, J = 15.4 Hz, CHCH); 2.80 (3H, s, CH3). 13C: 179.60 (CO); 146.49 (CN); 141.92 (CH=CH); 121.89 (CHCH); 18.16 (CH3). ES+ SM: 323 [M+H+]. Recristallisation : hexane/DCM (3:1). Rendement : 86%. PF: 165–167 °C |
| 5n | 4-N(CH3)2 | 1H: 7.78 (1H, d,J= 16 Hz, CHCH); 7.45 (1H, d,J= 16 Hz, CHCH); 2.85 (3H, s, CH3). 13C: 179.36 (CO); 151.98 (CN); 141.46 (CHCH); 121.70 (CHCH); 18.10 (CH3). ES + SM: 306 [M+H+]. Recristallisation : eau. Rendement : 30%. PF: 197–200 °C. |
| 5o | 2-Cl | 1H: 7.80 (1H, d, J = 15.6 Hz, CHCH); 7.43 (1H, d, J = 15.9 Hz, CHCH); 2.83 (3H, s, CH3). 13C: 179.20 (CO); 152.68 (CN); 139.90 (CHCH); 120.89 (CHCH); 18.16 (CH3). ES+ SM: 297.75 [M+H+]. Recristallisation : hexane/DCM (3:1). Rendement : 65%. PF: 170–172 °C |
| 5p | 3-Cl | 1H: 7.88 (1H, d, J = 15.6 Hz, CHCH); 7.55 (1H, d, J = 15.9 Hz, CHCH); 2.82 (3H, s, CH3). 13C: 179.15 (CO); 152.62 (CN); 139.85 (CHCH); 120.89 (CHCH); 18.16 (CH3). ES+ SM: 297.75 [M+H+]. Recristallisation : hexane/DCM (3:1). Rendement : 82%. PF: 167–169 °C |
| 5q | 4-Cl | 1H: 7.80 (1H, d, J = 15.6 Hz, CHCH); 7.51 (1H, d, J = 15.9 Hz, CHCH); 2.79 (3H, s, CH3). 13C: 180.0 (CO); 152.62 (CN); 139.85 (CHCH); 120.89 (CHCH); 18.10 (CH3). ES+ SM: 297.75 [M+H+].Recristallisation : hexane/DCM (3:1). Rendement : 72%. PF: 173–175 °C |
| 5r | 2,6-di-Cl | 1H: 7.86 (1H, d, J = 16 Hz, CHCH); 7.54 (1H, d, J = 16 Hz, CHCH); 2.79 (3H, s, CH3). 13C: 179.29 (CO); 152.78 (CN); 139.91 (CHCH); 120.89 (CHCH); 18.16 (CH3). ES+ SM: 332 [M+H+]. Recristallisation : acétate d’éthyle. Rendement : 55%. PF: 180–182 °C |
| 5s | 2,4-di-Cl | 1H: 7.86 (1H, d,J= 16 Hz, CHCH); 7.54 (1H, d,J= 16 Hz, CHCH); 2.76 (3H, s, CH3). 13C: 179.29 (CO); 152.78 (CN); 139.91 (CHCH); 120.89 (CHCH); 18.16 (CH3). ES + SM: 332 [M+H+]. Recristallisation : hexane/DCM (3:1). Rendement : 90%. PF: 197–199 °C |
| 5t | 2-Br | 1H: 8.15 (1H, d, J = 15.3 Hz, CHCH); 7.90 (1H, d, J = 15.3 Hz, CHCH); 3.04 (3H, s, CH3). 13C: 178.53 (CO); 152.67 (CN); 138.81 (CHCH); 120.89 (CHCH); 18.14 (CH3). ES+ SM: 342 [M+H+]. Recristallisation : hexane/DCM (3:1). Rendement : 85%. PF: 178–180 °C |
| 5u | 3-Br | 1H: 7.75 (1H, d, J = 15.3 Hz, CHCH); 7.60 (1H, d, J = 15.3 Hz, CHCH); 2.88 (3H, s, CH3). 13C: 179.13 (CO); 152.62 (CN); 139.80 (CHCH); 121.85 (CHCH); 18.13 (CH3). ES+ SM: 342 [M+H+]. Recristallisation : hexane/DCM (3:1). Rendement : 82%. PF: 181–183 °C |
| 5v | 4-Br | 1H: 7.68 (1H, d, J = 15.3 Hz, CHCH); 7.58 (1H, d, J = 15.3 Hz, CHCH); 2.73 (3H, s, CH3). 13C: 179.03 (CO); 152.58 (CN); 139.84 (CHCH); 121.85 (CHCH); 18.13 (CH3). ES+ SM: 342 [M+H+]. Recristallisation : éthanol. Rendement : 84%. PF: 207–209 °C |
| 5w | 4-F | 1H: 7.68 (1H, d, J = 15.3 Hz, CHCH); 7.58 (1H, d, J = 15.3 Hz, CHCH); 2.73 (3H, s, CH3). 13C: 180.03 (CO); 152.58 (CN); 139.90 (CHCH); 121.85 (CHCH); 18.13 (CH3). ES+ SM: 281 [M+H+]. Recristallisation : hexane/DCM (3:1). Rendement : 75%. PF: 192–194 °C |
| 5x | 3-NO2 | 1H: 7.80 (1H, d,J= 15.3 Hz, CHCH); 7.70 (1H, d,J= 15.3 Hz, CHCH); 2.85 (3H, s, CH3). 13C: 178.96 (CO); 152.81 (CN); 134.16 (CHCH); 121.88 (CHCH); 18.13 (CH3). ES + SM: 308 [M+H+]. Recristallisation : éthanol. Rendement : 65%. PF: 219–221 °C |
| 5y | 4-NO2 | 1H: 7.68 (1H, d, J = 15.3 Hz, CHCH); 7.50 (2H, d, J = 15.3 Hz, CHCH); 2.83 (3H, s, CH3). 13C: 178.06 (CO); 153.01 (CN); 134.34 (CHCH); 121.0 (CHCH); 18.20 (CH3). ES+ SM: 308 [M+H+]. Recristallisation : butanol. Rendement : 80%. PF: >260 °C |
3 Résultats et discussion
3.1 Activités antiplasmodiales
Le criblage antiplasmodial de cinq dérivés imidazopyridinyl-arylpropénone a été réalisé selon la technique de Rieckmann [41], suivie du dosage de la production d’antigènes HRP2 par ELISA [42,43] sur des isolats de P. falciparum chloroquino-sensible et chloroquino-résistant. L’analyse des activités antiplasmodiales a été traduite en concentration inhibitrice 50 (CI50) et exprimée en micromoles (μM). Par ailleurs, le niveau d’activité antiplasmodiale des composés hybrides a été apprécié au regard de la classification des chalcones (1,3-diphénylpropénones) antipaludiques établie par Liu et al. [44] (Tableau 2). Les résultats obtenus sur isolat de P. falciparum chloroquino-sensible révèlent que les composés 5k et 5y (CI50 = 35,92 et 24,08 μM) ont des activités antiplasmodiales jugées « modérées », tandis les trois autres (5a, 5n et 5q) présentent de « très bonnes activités antiplasmodiales », entre 8,65 et 6,23 μM suivant la classification du niveau d’activité antiplasmodiale en série des chalcones. Suivant cette même classification sur isolats de P. falciparum chloroquino-résistant, les cinq chalcones à support imidazopyridine possèdent de « très bonnes activités antiplasmodiales », avec des CI50 entre 7,01 et 1,52 μM.
Activités antiplasmodiales in vitro de cinq imidazopyridinyl-arylpropénones vis-à-vis d’isolats chloroquino-sensibles et chloroquino-résistants de P. falciparum.
| Composés | R | Isolats de P. falciparum chloroquino-sensibles | Isolats de P. falciparum chloroquino-résistants | ||
| CI50 (μM) | Niveau d’activité antiplasmodiale* | CI50 (μM) | Niveau d’activité antiplasmodialea | ||
| 5a | H | 8,65 | A | 7,01 | A |
| 5k | 4-OCH3 | 35,92 | C | 6,98 | A |
| 5n | 4-N(CH3)2 | 6,39 | A | 6,09 | A |
| 5q | 4-Cl | 6,23 | A | 1,52 | A |
| 5w | 4-F | 24,08 | C | 6,06 | A |
a Niveau d’activité antiplasmodiale des chalcones selon Liu et al. [44] : A = très bonne activité : CI50 < 10 μM; B = bonne activité : 20 μM > CI50 ≥ 10 μM; C = activité modérée : 50 μM > CI50 ≥ 20 μM; D = faible activité : 100 μM ≥ CI50 ≥ 50 μM; E = très faible activité : CI50 > 100 μM.
De façon surprenante, l’on assiste à une inversion d’efficacité antiplasmodiale des imidazopyridinyl-arylpropénones en fonction du statut sensible ou résistant des isolats de P. falciparum. Alors que lesdits composés devraient être plus performants sur isolats chloroquino-sensibles, ils le sont plutôt sur les isolats de P. falciparum chloroquino-résistants. Une telle performance antiplasmodiale vis-à-vis des isolats chloroquino-résistants de nos chalcones à support imidazopyridine pourrait s’expliquer par une possible spécificité de leur mécanisme d’action plutôt vis-à-vis des facteurs de résistance que de ceux à l’origine de la sensibilité des germes plasmodiaux à la chloroquine. Une autre hypothèse pourrait être leur meilleure sensibilité aux éventuelles modifications conformationnelles des récepteurs-cibles des souches de P. falciparum résistantes.
Au plan pharmacochimique, les performances antiplasmodiales des imidazopyridinyl-arylpropénones sur tout type d’isolats de P. falciparum pourraient être liées au caractère basique de l’imidazopyridine, à l’instar de celui du noyau quinoléine, support hétérocyclique des médicaments antipaludiques tels que la chloroquine et l’amodiaquine. Ce caractère basique, qui pourrait entraîner l’accumulation de la molécule dans la vacuole nutritive du Plasmodium, et auquel s'ajouterait la capacité de complexation des enzymes à fonction thiol de l’arylpropénone, serait à l’origine des performances antiplasmodiales de nos composés hybrides. Par ailleurs, la nature des modulateurs d’activité présents sur l’homocycle benzénique de l’enchaînement arylpropénone est analogue à celle de ceux présents dans les molécules de la plupart des médicaments antipaludiques (OCH3, N(CH3,)2, Cl, F…). Parmi ceux-ci, l’atome de chlore, modulateur de l’activité antiplasmodiale de la chloroquine ou de l’amodiaquine, a de loin été, dans notre série (composé 5q), à l’origine des meilleures performances antiplasmodiales, tant sur isolats chloroquino-sensibles (CI50 = 6,23 μM) que sur isolats chloroquino-résistants (CI50 = 1,52 μM), et ce, comparativement à son dérivé non substitué 5a.
3.2 Activités nématocides
Les activités nématocides vis-à-vis du parasite pathogène vétérinaire H. contortus de dix imidazopyridinyl-arylpropénones ont été déterminées suivant la méthode du développement larvaire de Diehl et al. [45]. Lesdites activités ont par la suite été comparées à celles de deux médicaments anthelminthiques de référence : l’ivermectine et le fenbendazole (Tableau 3). Les résultats nématocides traduits en concentration larvicide 100 (CL100) puis exprimés en micromoles (μM) révèlent que, sur les dix produits testés, quatre (5j, 5n, 5s et 5w) ont de bonnes concentrations larvicides (CL100 = 9,93-0,0015 μM). Celles-ci sont inférieures à la CL100 de l’ivermectine (10,28 μM). Parmi ces composés, deux (5n, 5s) ont révélé des activités nématocides superposables à celles du fenbendazole (CL100 = 0,0017 μM). Les concentrations larvicides des autres produits sont plus fortes (>60 μM) c’est-à-dire supérieures à celle de la 1,3-diphénylpropénone (57,7 μM), dont la CL100 a été utilisée comme limite seuil expérimentale. L’analyse de type relations structure–activité en série des imidazopyridinyl-arylpropénones des résultats montre que le remplacement de l’homocycle benzénique en position 1 de l’enchaînement 1,3-diphénylpropénone par l’hétérocycle imidazopyridine (Fig. 1) s’est avéré insuffisant pour induire les activités nématocides recherchées. En effet, le composé 5a issu de cette modulation a présenté des concentrations nématocides à 60 μM largement supérieures à celles du 1,3-diphénylpropénone (CL100 = 57,7 μM). De même, l’introduction sur l’homocycle benzénique en position 3 de l’enchainement arylpropénone de modulateurs de nature alkyle (composé 5c et 5e), hydroxyle (composé 5g), n’a pas induit de bonnes activités nématocides. En revanche, le remplacement de l’hydroxyle par un dérivé éthéré de type méthoxyle (composé 5j) conduit cette fois à l’apparition d’activités anthelminthiques notables, puisque ce dernier, avec une CL100 de 9,83 μM, a une efficacité pratiquement superposable à celle de l’ivermectine. Le remplacement du même groupe hydroxyle, cette fois par un autre groupement encore plus électrodonneur que lui, en l’occurrence une diméthylamine en position 4 (composé 5n), entraîne paradoxalement une exaltation des activités larvicides. Ce dérivé alkylamine possède effectivement une puissante activité nématocide (CL100 = 0,0016 μM) respectivement superposable à celle du fenbendazole et plus de 6000 fois plus performante que l’ivermectine vis-à-vis de H. contortus. Une telle performance se perd avec la présence d’atomes d’halogènes de type brome (composé 5v) ou chlore (composé 5q). Seule la présence du fluor (composé 5w) et surtout la duplication du chlore (composé 5s) exaltent les activités larvicides. En effet, le composé fluoré 5w avec une CL100 de 0,0071 μM est près de 1500 fois plus performant que l’ivermectine. Quant au dérivé dichloré 5s, non seulement il est plus performant que ces analogues mono-bromé, chloré et fluoré, mais également sa performance est égale à celle du composé 5n ou dérivé diméthylamine.
Activités nématocides in vitro de dix imidazopyridinyl-arylpropénones et des médicaments nématocides vis-à-vis de Haemonchus contortus.
| Composés | R | CL100 (μM) H. contortus |
| 5a | H | >60 |
| 5c | 3-CH3 | >60 |
| 5e | 4-CH(CH3)2 | >60 |
| 5g | 3-OH | >60 |
| 5j | 3-OCH3 | 9,83 |
| 5n | 4-N(CH3)2 | 0,0016 |
| 5q | 4-Cl | >60 |
| 5s | 2,4-diCl | 0,0015 |
| 5v | 4-Br | >60 |
| 5w | 4-F | 0,0071 |
| 1,3-diphénylpropénone | 57,7 | |
| ivermectine | 10,28 | |
| fenbendazole | 0,0017 |
3.2.1 Activités anticandidosiques
Les essais antifongiques ont été réalisés sur une souche clinique de C. albicans « 27506 » fournie par le Centre de diagnostic et de recherche sur le sida et les maladies opportunistes (CeDReS) d’Abidjan. Ce germe a été caractérisé et identifié comme étant résistant au fluconazole, médicament anticandidosique de référence, avec une quantité minimale inhibitrice de 10 μg. La méthode de criblage anticandidosique utilisée est la méthode Bioautographie ou « Agar overlay » [46]. Il s’agit d’une méthode de détermination in vitro par chromatographie sur couche mince des quantités minimales capables d’inhiber (QMI) la prolifération de C. albicans. Lesdites quantités sont exprimées directement en μg. Les résultats anticandidosiques obtenus après évaluation des dix composés précédemment évalués pour leurs activités nématocides sont rassemblés dans le Tableau 4.
Activités anticandidosiques in vitro de dix imidazopyridinyl-arylpropénones vis-à-vis d’une souche clinique résistante au fluconazole de Candida albicans 27506.
| Composés | R | QMI (μg) Candida albicans 27506 |
| 5a | H | 2,5 |
| 5c | 3-CH3 | 2,5 |
| 5e | 4-CH(CH3)2 | 0,31 |
| 5g | 3-OH | 1,25 |
| 5j | 3-OCH3 | >10 |
| 5n | 4-N(CH3)2 | >10 |
| 5q | 4-Cl | >10 |
| 5s | 2,4-diCl | >10 |
| 5v | 4-Br | 1,25 |
| 5w | 4-F | 5 |
| fluconazole | 10 |
Ces résultats montrent que six des hybrides de chalcones ont présenté vis-à-vis de la souche clinique résistante de C. albicans des performances anticandidosiques supérieures à celle du fluconazole. Il s’agit du composé non substitué 5a, des composés porteurs sur l’homocycle benzénique de l’arylpropénone de modulateurs de type méthyle (5c), isopropyle (5e), hydroxyle (5g), brome (5v) et chlore (5w). Les quantités inhibitrices efficaces de ces composés varient entre 5 et 0,31 μg, avec une excellente performance pour le composé 5e (QMI = 0,31 μg) ainsi que pour les composés 5g et 5v (QMI = 1,25 μg). Les quatre autres dérivés, à savoir les composés 5j, 5n, 5q et 5s, n’ont pas induit d'activités anticandidosiques à la limite d’efficacité (QMI > 10 μg) de notre étude. De prime abord, on pourrait croire que la meilleure performance du composé isopropyle 5e (QMI = 0,31 μg) serait liée au degré de lipophilie supplémentaire induit par ledit groupement, qui pourrait être indispensable pour interagir chez C. albicans, sur une éventuelle cible biologique membranaire de nature lipidique, à l’instar de l’ergostérol. Une telle hypothèse est vite abandonnée au regard de la performance du dérivé 2,4-dichlophényle 5s (QMI >10 μg), pourtant plus lipophile et présent dans la molécule de la plupart des azolés antifongiques médicamenteux. De plus le composé hydroxylé 5g (QMI = 1,25 μg), moins lipophile, ne serait pas efficace vis-à-vis de C. albicans. Quoi qu’il en soit, les imidazopyridinyl-arylpropénones s’avèrent être efficaces sur la souche clinique de C. albicans résistante au fluconazole.
4 Conclusion
Le présent travail s'inscrit dans le cadre de l’établissement d’un nouveau profil chimique anti-infectieux pour contribuer à la recherche pharmacochimique contre le paludisme, les helminthoses vétérinaires et les candidoses. Le concept d’élaboration de nouvelles molécules potentiellement actives par juxtaposition de pharmacophores nous a permis de conceptualiser et d’édifier à partir de l’enchaînement arylpropénone des chalcones et de l’hétérocycle imidazo[1,2-a]pyridine une série de nouvelles molécules hybrides, à savoir les imidazopyridinyl-arylpropénones.
Les trois études de relations structure–activité entreprises en fonction de l’agent infectieux (Plasmodium, Haemonchus ou Candida) révèlent que notre stratégie pharmacochimique permet effectivement d’accéder à des molécules anti-infectieuses. En effet, un composé, à savoir le dérivé 5q (CI50 = 1,52 μM), pourrait être retenu pour un développement contre le paludisme à P. falciparum chloroquino-résistant. En ce qui concerne les helminthoses vétérinaires à H. contortus, trois composés nématocides s’avèrent intéressants. Il s’agit des composés 5n, 5s et 5w (CL100 = 0,0071–0,0015 μM). Enfin, vis-à-vis des candidoses à C. albicans pharmacorésistants, trois autres composés méritent d’être retenus : 5e, 5g et 5v (QMI = 1,25–0,31 μg). Au final, et en attendant de connaître la toxicité cellulaire des composés pour avoir l’ordre de grandeur de l’index thérapeutique, et donc l’intérêt des produits, ces résultats nous permettent de valider l’enchaînement fonctionnel arylpropénone vectorisé par un support imidazopyridine comme nouveau pharmacophore d’activités anti-infectieuses pour la mise au point de candidats médicaments antipaludiques, nématocides et anticandidosiques.
4.1 Remerciements
Les auteurs expriment leurs reconnaissances au Centre suisse de recherches scientifiques en Côte d’Ivoire (pour les essais nématocides et anticandidosiques), au laboratoire CEISAM de l’université de Nantes (pour les analyses spectroscopiques) ainsi qu’au Centre de recherche et de lutte contre le paludisme de Côte d’Ivoire (pour la réalisation du criblage antiplasmodial).


