1 Introduction
Les sels de pyrylium constituent en général une vaste classe d'hétérocycles cationiques aromatiques utilisés dans diverses synthèses organiques [1]. Leur synthèse et leurs propriétés chimiques ont fait l'objet d'un grand nombre de travaux, décrits dans des ouvrages de référence [1,2]. La structure générale de ces sels est indiquée sur la Fig. 1. Pour R1 = C6H5CHCH et R3, R5 = C6H5 ou R3 = C6H5CHCH et R1, R5 = C6H5, on obtient les sels de diphényl-4,6 styryl-2 pyrylium et de diphényl-2,6 styryl-4 pyrylium.
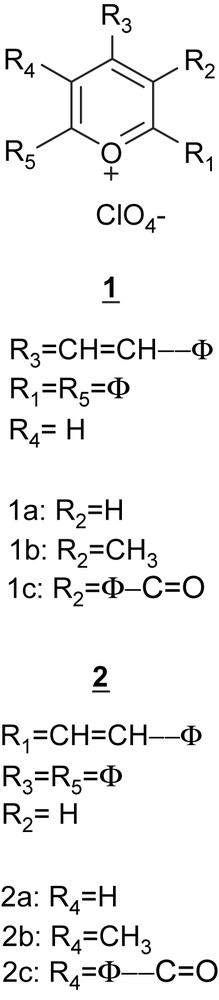
Structure générale des sels de pyrylium.
Outre leur utilité dans les réactions de synthèse organique, les sels de pyrylium ont fait l'objet de recherches variées dans divers domaines de la chimie et des sciences des matériaux. Supuran et al. ont ainsi utilisé des sels de pyrylium pour la modification chimique d'enzymes ribonucléases [3]. Le caractère cationique de ces sels en fait d'excellents accepteurs d'électrons, d'où leur utilisation dans la préparation de différents sensibilisateurs. Des sensibilisateurs utilisables dans les procédés de reprographie électrophorétique basés sur les polymères de polyvinylcarbazole [4] ont ainsi été préparés, de même que des sensibilisateurs servant au transfert photo-induit d'électrons à l'intérieur de cavités de zéolites Y [5]. Les sels de pyrylium ont également été utilisés dans la préparation de colorants laser [6] et dans la mise au point de nouvelles surfaces actives dans le domaine environnemental [7,8]. Citons enfin les travaux récents de Miranda et al., portant sur l'utilisation des sels de pyrylium pour la dégradation photocatalytique des contaminants organiques dans les eaux de rejet industrielles [9,10].
Un certain nombre de travaux dans la littérature ont été consacrés à l'étude du mécanisme de réduction ou de l'oxydation par voie électrochimique des sels de pyrylium [4,11–14]. Ainsi en milieu aqueux, la réduction électrochimique conduit à la formation d'un radical (par capture d'un électron) qui réagit rapidement avec l'eau pour former des produits d'addition. En milieu non aqueux, le radical pyranyle est lui-même réductible et conduit alors à l'anion pyranyle. La présence sur le noyau pyrylium de groupements électroattracteurs et/ou électrodonneurs devrait respectivement favoriser ou défavoriser la réduction du cation pyrylium et du radical pyranyle. Les travaux de Tripathi et al. sur les sels de pyrylium à structure bloquée ont montré que ce n'est pas toujours ce qui est observé [4].
Le présent travail est le premier d'une série qui sera consacrée à l'étude des mécanismes de réduction et d'oxydation des sels de styryl-4 et styryl-2 pyrylium 1 et 2. Cette étude a pour objectif de contribuer à la compréhension des propriétés redox de ces sels. Dans cette première partie, une investigation systématique des propriétés électrochimiques des sels du type 1a et 2a a été effectuée, en prenant en compte différents paramètres additionnels, tels que la gamme de potentiels de balayage, la concentration de l'eau présente dans l'électrolyte support et la dégradation des solutions d'électrolyse.
2 Protocole expérimental
2.1 Produits, solvants et électrolyte support
Les sels de styryl-2 et styryl-4 pyrylium ont été synthétisés selon une méthode générale mise au point par Sib et al. [15]. Cette méthode consiste à faire réagir le perchlorate de triphénylméthyle (trityle) sur un mélange de cétones α,β-éthyléniques. Ces sels ont été identifiés, d'une part, par voie chimique (formation de pyridines et de δ-dicétones éthyléniques) et, d'autre part, par spectroscopies IR et UV–visible.
La réduction et l'oxydation par voie électrochimique des sels de styrylpyrylium ont été conduites dans l'acétonitrile, solvant doué d'un grand pouvoir solubilisant, et inerte vis-à-vis des espèces réagissantes. Il présente l'avantage d'un domaine d'électroactivité suffisamment large pour rendre possible la réduction des sels de styrylpyrylium. Au préalable, nous avons envisagé la possibilité d'une réaction parasite des sels de syrylpyrylium, c'est-à-dire leur hydrolyse. En effet, l'acétonitrile, même soigneusement purifié et séché, contient toujours une certaine quantité d'eau sous forme de traces. Nous avons donc vérifié que, dans l'acétonitrile utilisé pour les électrolyses, il ne se produisait aucune altération des sels de styrylpyrylium, même après plusieurs jours d'abandon. Nous avons utilisé de l'acétonitrile Rectapur (Merck Darmstadt, 99,9%) ne contenant aucune impureté électroactive gênante. La teneur en eau est de 0,02%, valeur confirmée par la méthode de Karl Fischer. Avant toute expérience, la quantité d'acétonitrile devant servir à la préparation de l'électrolyte support est séchée pendant 48 h sur CaCl2, puis distillée deux fois sur CaH2 et, enfin, conservée au dessiccateur.
Le sel de fond utilisé est le tétrabutylammoniumhexafluorophosphate (Bu4NPF6) à 98% (produit Aldrich). Il est d'abord séché à l'étuve, avant dissolution de la quantité correspondante dans 50 cm3 d'acétonitrile pour la préparation de l'électrolyte support, de concentration 0,1 M en Bu4NPF6. Le sel de styrylpyrylium est dissous à une concentration de 10−3 mol l−1 dans l'électrolyte support.
2.2 Cellule, électrodes et potentiostat
La cellule de mesure est une cellule Tacussel CPR3B comportant une double enveloppe, dans laquelle circule l'eau servant à la thermostatisation. Dans cette cellule plongent une électrode de travail, une électrode de référence, une contre-électrode et une arrivée pour un tube adducteur d'azote.
L'électrode de travail est un disque de platine de type EDI Tacussel A35T105 (EM-EDI-Pt-D5), de diamètre 5 mm. Le disque est, en fait, la partie centrale de la face terminale d'un embout cylindrique en téflon démontable, qui s'enfile dans l'axe central de l'électrode EDI. La contre-électrode est un disque de platine (XM 160, diamètre = 10 mm).
L'électrode de référence est une électrode Tacussel RDJ/Ag10 de type XR 830 AG (code 425 669) à deux compartiments. Le système de référence est Ag/Ag+, d'où le remplissage du compartiment supérieur avec une solution de AgNO3 0,01 mol l−1 dans l'acétonitrile. Le compartiment inférieur est rempli avec une solution de Bu4NPF6 0,1 mol l−1 dans l'acétonitrile. La jonction est du type poreux/poreux.
Les courbes de voltamétrie cyclique ont été obtenues à l'aide d'un potentiostat Solartron 1280B, qui permet d'ajuster la tension de l'électrode de travail par rapport à l'électrode de référence. Le potentiostat est piloté par un ordinateur PC/Windows 2000 utilisant les logiciels CorrWare pour Windows. La vitesse de balayage utilisée pour l'obtention des courbes i–E est de 50 mV s−1.
Avant chaque mesure, la cellule de mesure est nettoyée avec un mélange sulfonitrique, puis à l'eau distillée et, enfin, séchée à l'acétone. Elle subit par la suite un léger rinçage à l'acétonitrile. L'électrode de platine EDI est traitée finement par des moyens mécaniques (polissage fin au papier abrasif), électrolytiques ou chimiques, entre chaque mesure, de façon à régénérer l'état de surface initial. Enfin, chaque enregistrement est précédé d'un barbotage d'azote dans la cellule contenant la solution de mesure, ceci afin d'éliminer les traces d'oxygène dissous. Le courant d'azote est maintenu au-dessus de la solution pendant la durée de l'expérience.
3 Résultats expérimentaux
3.1 Étude de l'électrolyte support
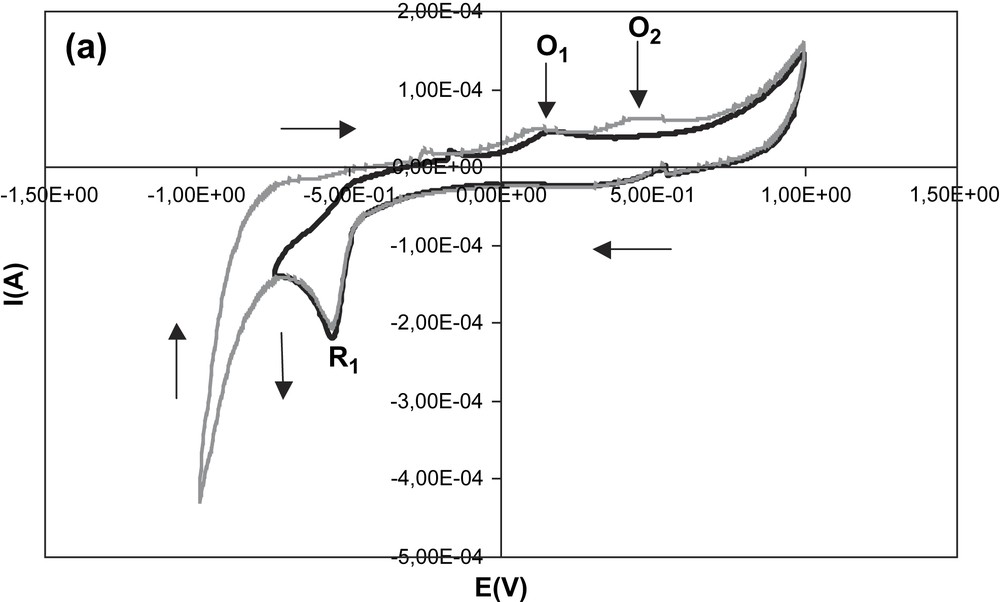
La Fig. 2a montre le voltamogramme enregistré dans l'électrolyte support (Bu4NPF6 0,1 mol l−1 dans l'acétonitrile) ne contenant aucun sel de styrylpyrylium. En partant d'un potentiel initial de 0 V et en limitant l'excursion de potentiel dans la plage −1 V–+1 V, on note l'absence quasi totale de courant intense dans ce domaine de potentiel, comme le montre la Fig. 2b, ce qui traduit le fait qu'aucune impureté électroactive gênante n'a pu être décelée. En dehors de cette plage de potentiel, on distingue différents pics de réduction et d'oxydation imputables aux impuretés résiduelles présentes dans l'électrolyte support. Ainsi, on note un pic de réduction C1 à −1,50 V, suivi d'un pic d'oxydation A1 à −0,91 V et un autre pic de réduction C2 à 0,5 V. Comme on peut le voir, en zone cathodique, les phénomènes gênants sont situés au-delà de −1 V, puisque le courant croît jusqu'à atteindre C1, et le mur de potentiel cathodique est situé à −2 V. En zone anodique, au-delà de +1,5 V, le courant croît substantiellement, sans que l'on puisse déceler un quelconque pic d'oxydation.

Voltamogramme de l'électrolyte support Bu4NPF6 0,1 mol l−1 dans l'acétonitrile. (a) Gamme de potentiel entre −2 V et +2 V. (b) Gamme de potentiel entre −1 V et +1 V.
3.2 Étude du sel de diphényl-2,6 styryl-4 pyrylium
La Fig. 3 montre le voltamogramme cyclique du sel de diphényl-2,6 styryl-4 pyrylium dans l'électrolyte support. Dans la plage de potentiel comprise entre −1 V et +1 V, on observe un premier pic de réduction R1 à −0,55 V environ, suivi en oxydation, lors du balayage retour, d'un pic d'oxydation O1 à 0,17 V environ. Le pic R1 ne peut être attribué qu'à la réduction du sel de diphényl-2,6 styryl-4 pyrylium à l'électrode.
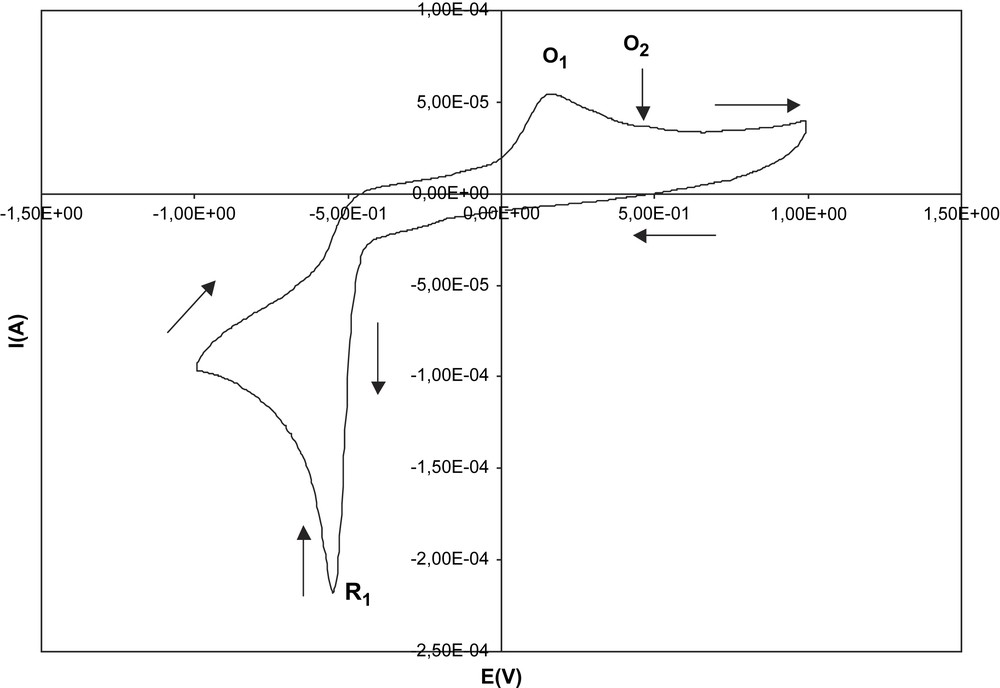
Voltamétrie cyclique effectuée dans l'électrolyte support contenant le sel de diphényl-2,6 styryl-4 pyrylium.
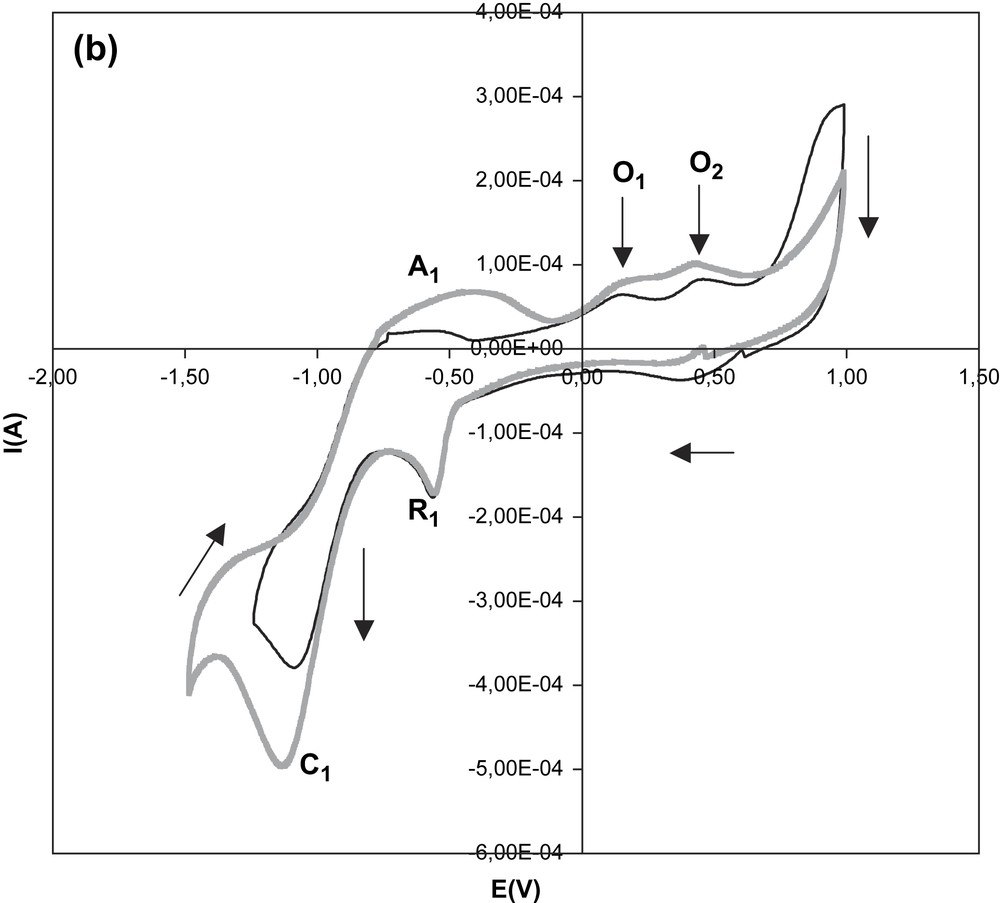
L'influence du potentiel de retour en zone cathodique a été étudiée. Cette influence est illustrée par la Fig. 4, qui est une superposition de voltamogrammes enregistrés correspondant à des potentiels limites de balayage (Ef) respectivement égaux à −0,75 V, −1 V, −1,25 V, −1,5 V, −1,75 V et −2 V. Cette figure rend compte de l'évolution progressive des voltamogrammes avec l'apparition de C1 et A1, ainsi que celle d'un pic supplémentaire d'oxydation O2, comme l'indique le deuxième voltamogramme. Ce pic O2 se situe à un potentiel de 0,45 V environ, tandis que le pic O1 devient plus fin à un potentiel compris entre 0,14 V et 0,17 V. Le pic O2 disparaît de nouveau lorsque la plage de potentiel utilisée est limitée au domaine situé entre −1 V et +1 V.
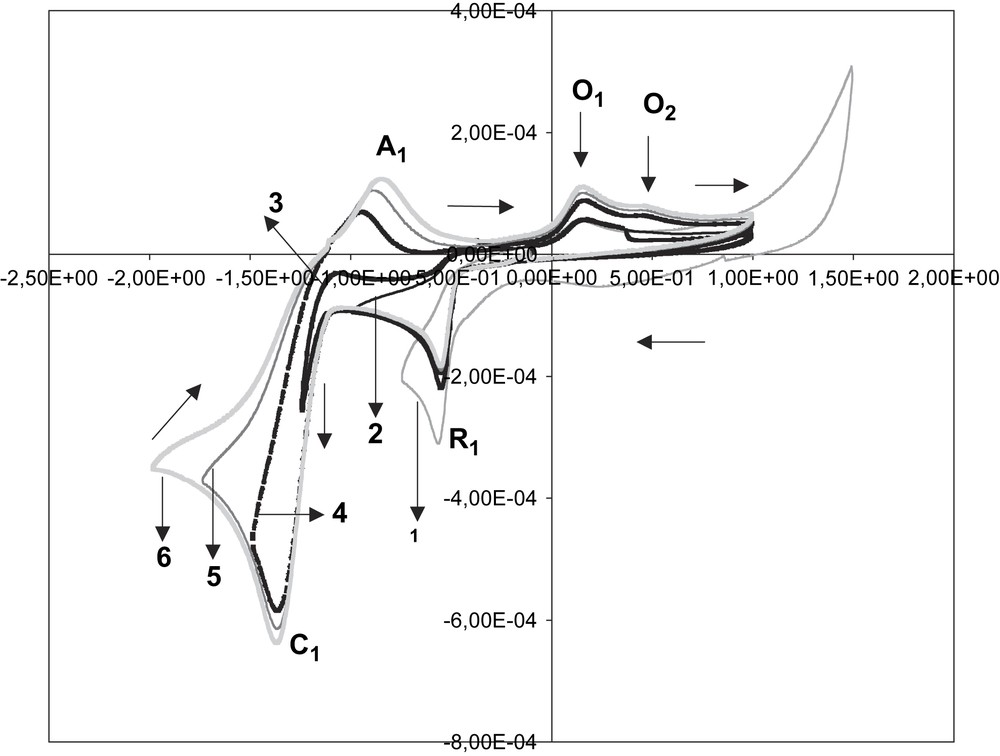
Influence du potentiel limite de balayage en zone cathodique sur les voltamogrammes du sel de diphényl-2,6 styryl-4 pyrylium dans l'électrolyte support. Valeurs de Ef : −0,75 V (1) ; −1 V (2) ; −1,25 V (3) ; −1,5 V (4) ; −1,75 V (5) ; −2 V (6).
L'excursion de potentiel entre 0 et 2,5 V fait apparaître un premier pic d'oxydation O3 à 1,94 V, suivi d'un pic de réduction R3 à 1,74 V (Fig. 5).

Comportement électrochimique en oxydation du sel de diphényl-2,6 styryl-4 pyrylium. Gamme de potentiel entre 0 V et 2,5 V.
Nous avons essayé d'étudier l'influence d'un ajout d'eau sur la solution du sel de diphényl-2,6 styryly-4 pyrylium en cours d'électrolyse. Une solution fraîchement préparée de ce sel a été donc additionnée de 1 ml d'eau distillée. Les voltamogrammes correspondant à des valeurs différentes de Ef (−0,75 V ; −1 V ; −1,25 V ; −1,5 V) sont regroupés sur les Fig. 6a et b. On observe, déjà pour Ef = −1 V, les deux processus d'oxydation distincts dont les pics correspondants sont O1 et O2 : O1 est situé entre 0,1 V et 0,17 V, O2 entre 0,40 V et 0,45 V. Pour Ef inférieur à −1 V, C1 et A1 apparaissent, mais avec une déformation pour le pic d'oxydation A1, qui est mal défini, et un déplacement de potentiel pour le pic de réduction (C1 varie entre −1,10 V et −1,14 V). Pour Ef = −2 V, le voltamogramme est limité par une forte élévation de la valeur absolue de l'intensité du courant (Fig. 6c). Le balayage retour fait apparaître un pic supplémentaire d'oxydation A2 à −1,5 V environ.
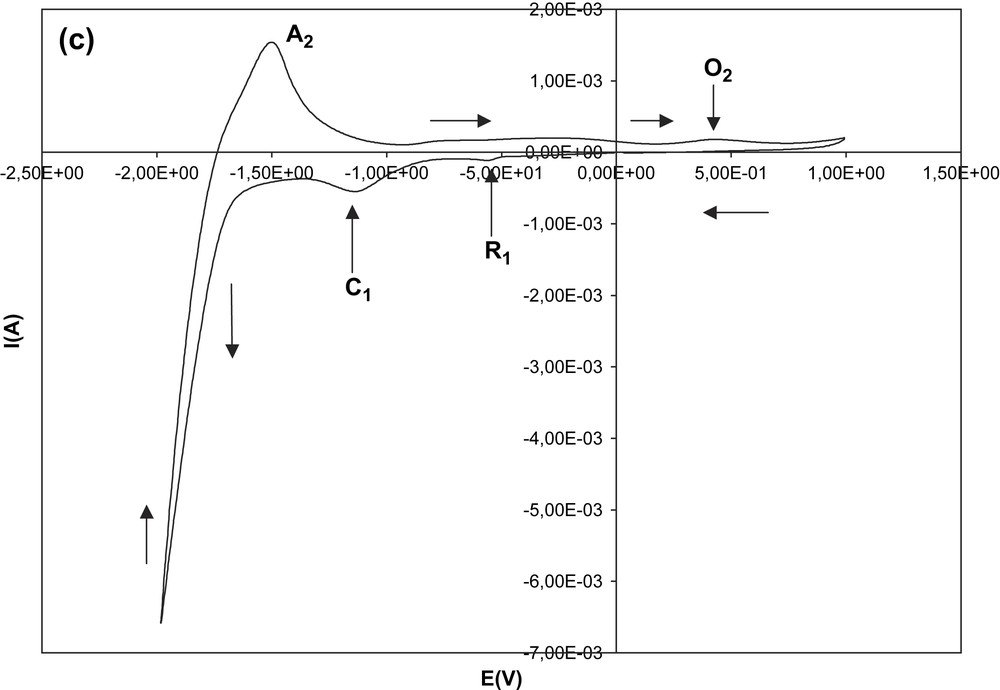
(a) Influence d'un ajout d'eau sur les voltamogrammes du sel de diphényl-2,6 styryl-4 pyrylium dans l'électrolyte support. Valeurs de Ef : −0,75 V (série 1) ; −1 V (série 2). (b) Influence d'un ajout d'eau sur les voltamogrammes du sel de diphényl-2,6 styryl-4 pyrylium dans l'électrolyte support. Valeurs de Ef : −1,25 V(série 1) ; −1,5 V (série 2). (c) Influence d'un ajout d'eau sur les voltamogrammes du sel de diphényl-2,6 styryl-4 pyrylium dans l'électrolyte support. Valeur de Ef : −2 V.
L'influence de l'ajout d'eau sur l'oxydation du sel a également été envisagée. Comme le montre la Fig. 7, le pic d'oxydation n'est plus aussi net.

Influence d'un ajout d'eau sur l'oxydation du sel de diphényl-2,6 styryl-4 pyrylium.
La Fig. 8 montre une série de voltamogrammes réalisés pour illustrer la dégradation de la solution du sel de styryl-4 pyrylium après une première série de micro-électrolyses. Des enregistrements ont donc été effectués à un mois d'intervalle ; entre chaque série, la solution a été conservée au dessiccateur. Au fil du temps, la solution ayant servi à la première série de microélectrolyses passe du jaune à une couleur plus foncée. Outre le pic R1, dont la hauteur a fortement diminué, on observe un pic de réduction supplémentaire R2, situé à −0,81 V environ. Le voltamogramme correspondant au comportement du sel en oxydation ne révèle aucun pic caractéristique après trois mois.
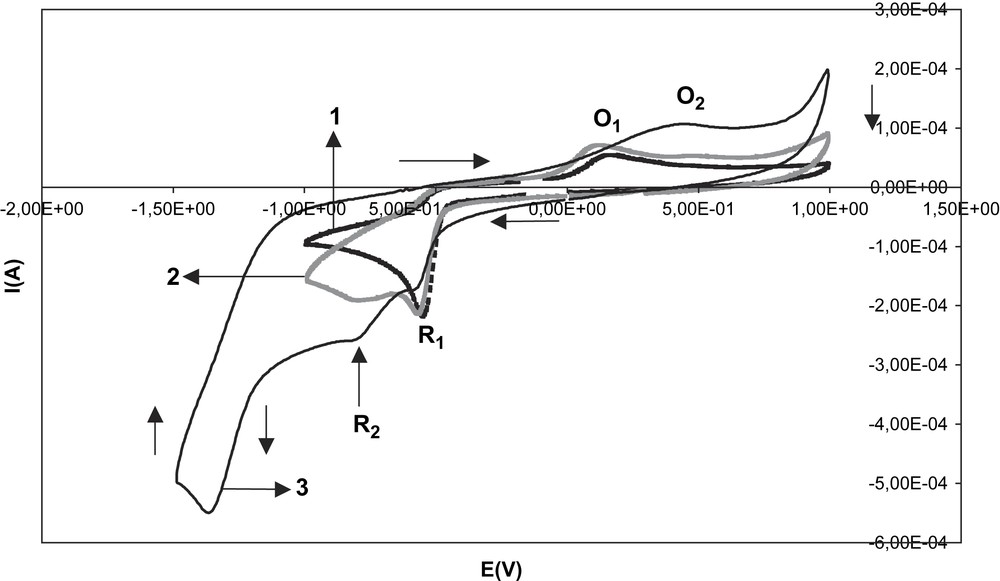
Dégradation de la solution de diphényl-2,6 styryl-4 pyrylium sur plusieurs mois. Série 1 : premier jour. Série 2 : série 1 + un mois. Série 3 : série 1 + deux mois.
3.3 Étude du sel de diphényl-4,6 styryl-2 pyrylium
Sur le voltamogramme de la Fig. 9, on distingue nettement trois pics caractéristiques : R1 à −0,59 V, O1 à 0,1 V et O2 à 0,30 V. L'oxydation du sel de diphényl-4,6 styryly-2 pyrylium est représentée sur la Fig. 10. On distingue nettement les pics d'oxydation O3 (1,85 V) et de réduction R3 (1,7 V). Les différents paramètres suivants ont également été envisagés dans l'étude du sel de diphényl-4,6 styryly-2 pyrylium : l'influence du potentiel de retour en zone cathodique, l'influence d'un ajout d'eau et la dégradation du sel. Les résultats obtenus sont identiques à ceux du sel de diphényl-2,6 styryl-4 pyrylium.
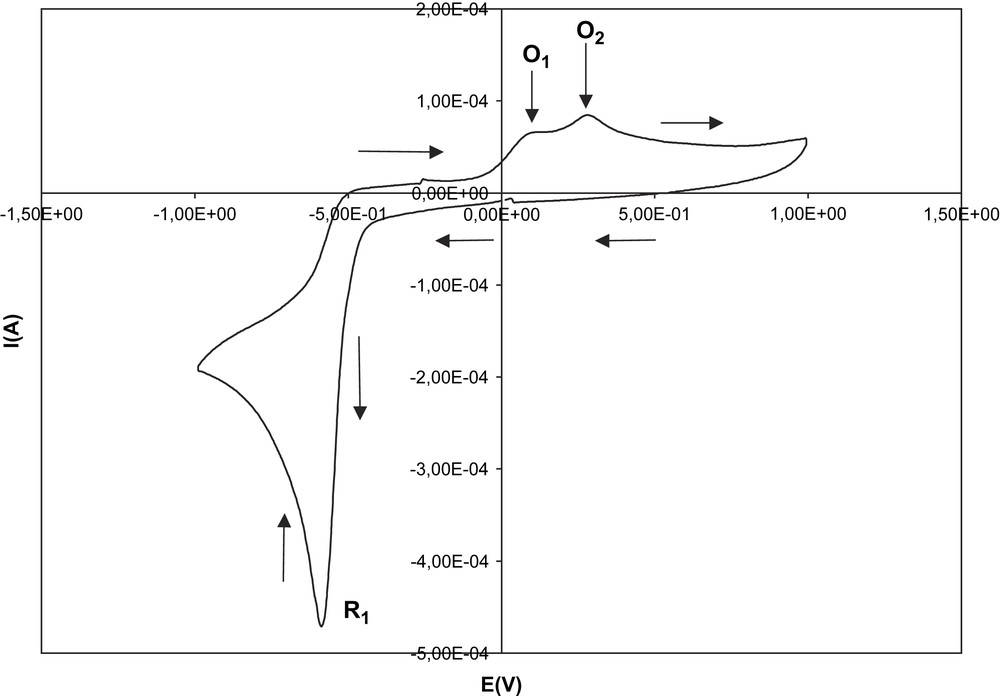
Voltamétrie cyclique effectuée dans l'électrolyte support contenant le sel de diphényl-4,6 styryl-2 pyrylium.
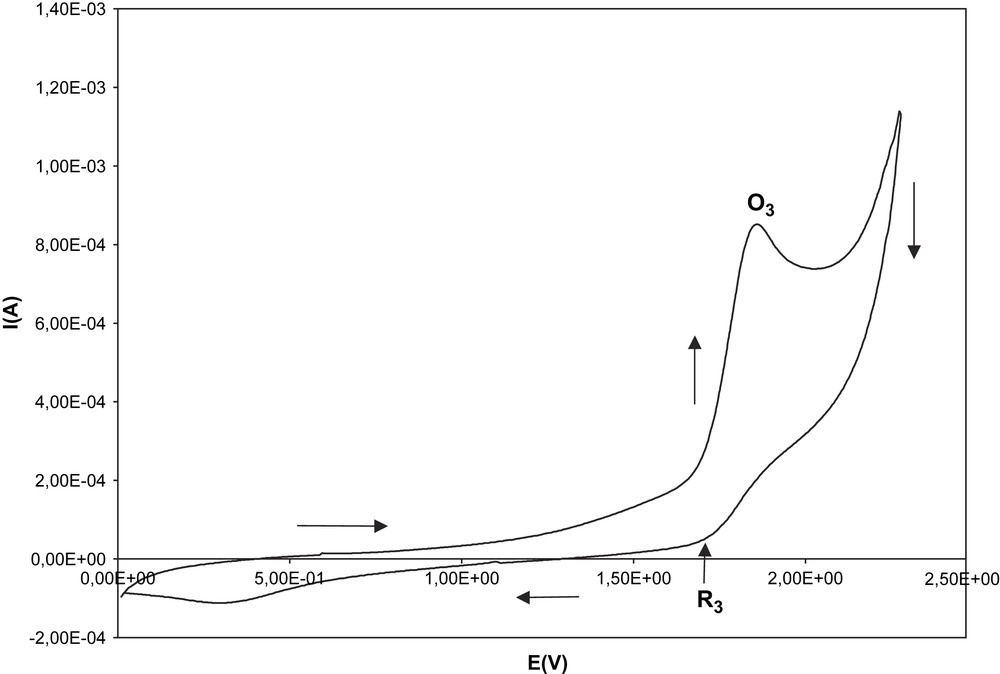
Oxydation du sel de diphényl-4,6 styryl-2 pyrylium dans l'électrolyte support.
4 Discussion
4.1 Étude de l'électrolyte support
Les pics C1, C2, A1 et A2 correspondent au comportement électrochimique de l'électrolyte support (solvant + sel de fond + traces d'eau). En admettant la présence de traces d'eau dans l'électrolyte support, elles sont probablement réduites en C1 ; l'hydrogène adsorbé à la surface du platine serait alors oxydé en A1. Les pics C1 et A1 sont liés, puisque, comme le montre la Fig. 2b, lorsque l'excursion de potentiel n'excède pas −1 V, C1 et A1 n'existent pas. Lorsque la quantité d'eau en solution est plus importante, on observe, comme on l'a précisé ci-dessus, un mur de potentiel en zone cathodique, qui devrait correspondre à la réduction de l'eau, et donc à la formation d'hydrogène moléculaire. Ceci expliquerait l'apparition du pic A2, qui serait lié à l'oxydation de l'hydrogène moléculaire retenu à la surface du platine.
4.2 Réduction et oxydation du sel de diphényl-2,6 styryl-4 pyrylium
4.2.1 Mécanisme de réduction et influence de l'eau sur le comportement du sel
Les pics R1, R2, O1 et O2, ainsi que les pics R3 et O3, sont propres au comportement électrochimique du sel de diphényl-2,6 styryl-4 pyrylium. Les résultats expérimentaux montrent clairement que l'eau ajoutée dans le milieu n'a pas d'influence sur le pic de réduction R1, qui se situe toujours à une valeur de potentiel presque identique. Il en est de même pour chacun des pics O1 et O2. Ces observations tendraient donc à montrer qu'il n'y a pas d'interaction entre le sel de styrylpyrylium et les traces d'eau présente dans l'électrolyte support. Ces observations sont en bon accord avec celles de Letertre [16].
La réduction du sel de diphényl-2,6 styryl-4 pyrylium 1a aurait donc lieu en R1, suivant un processus irréversible au cours duquel un électron est capté par la molécule, ce qui conduirait à la formation d'un radical avec un électron délocalisé représenté par les deux formes mésomères b1 et b2 (Fig. 11). Ce radical est très instable, sa durée de vie étant inférieure à 10−3 s. Selon Hünig et al. [14], b1 réagirait soit sur le sel 1a, soit sur lui-même pour donner le dimère D (Fig. 11, Schéma 1). L'oxydation de ce dimère en O1 donnerait le composé G. Le composé G peut paraître peu probable, du fait des tensions de Baeyer importantes dans le cyclobutane. L'évolution du radical pourrait également se faire selon le schéma 2 de la Fig. 11 pour former le dimère D′. L'écart entre les valeurs des potentiels des pics O1 et R1 tel qu'il est donné par la littérature est [14]. Nos résultats ont donné un écart du même ordre de grandeur .
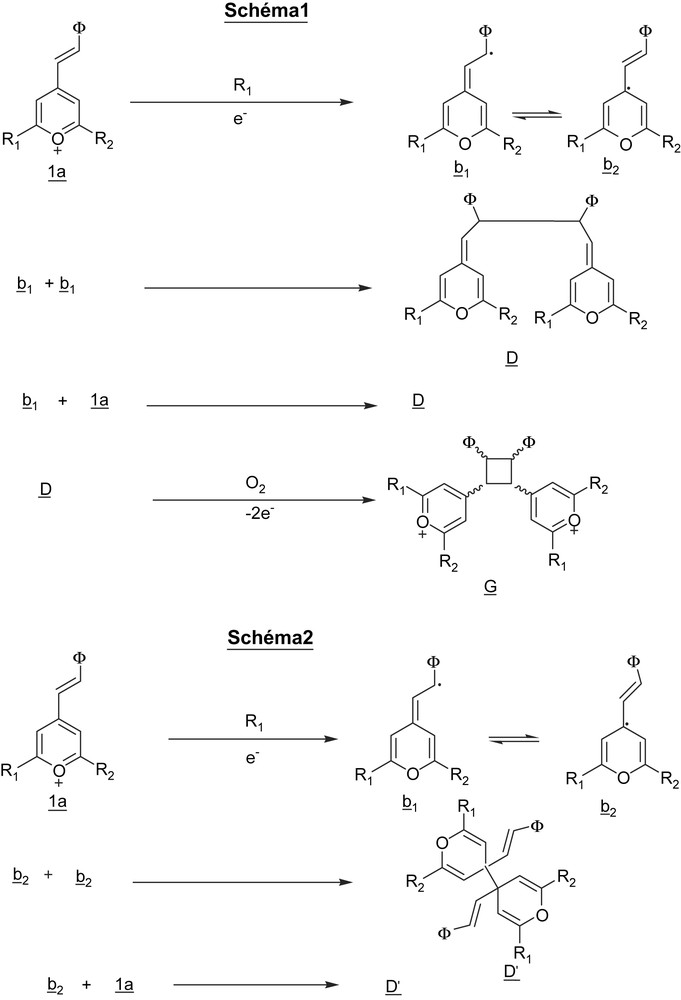
Mécanisme de réduction des sels de styryl-pyrylium. Schéma 1 d'après [14].
Nos mesures ont montré que seul le pic O1 apparaît lorsqu'au cours du balayage, le potentiel en zone cathodique atteint −0,75 V. Cela nous a donc amené à envisager le fait que l'apparition du pic O2 soit liée à l'oxydation d'une espèce que nous appelons F. F serait le résultat d'une série de transformations chimiques et électrochimiques mettant en jeu l'espèce radicalaire obtenue par réduction du sel 1a en R1. Le radical pourrait très bien réagir, dans une réaction parasite éventuellement avec l'eau résiduelle toujours présente dans le milieu, pour donner un composé que nous appelons C, dont la réduction en R2 permettrait d'obtenir F, ce qui expliquerait que, lorsque le balayage de potentiel en zone cathodique n'atteint pas le potentiel de R2, l'oxydation en O2 ne peut avoir lieu. Dans l'étude électrochimique des sels de pyrylium à structure bloquée, Tripathi et al. ont mis également en évidence l'apparition d'un pic supplémentaire d'oxydation dans la zone des potentiels positifs lorsque le balayage aller en zone cathodique atteint un potentiel situé au-delà du potentiel d'apparition de l'anion pyranyle [4]. Ce nouveau pic d'oxydation suit le pic d'oxydation de l'anion pyranyle et se distingue très nettement de celui de l'oxydation de l'ion pyrylium en dication pyrylium. Toutefois, l'attribution de ce pic à une espèce définie n'a pas pu être réalisée.
L'oxydation du sel de diphényl-2,6 styryl-4 pyrylium a montré que l'oxydation est un processus difficile et irréversible. L'oxydation a lieu à un potentiel très positif et l'écart de potentiel entre les pics anodique et cathodique est de .
4.2.2 Dégradation du sel
L'étude menée sur la dégradation de la solution du sel de styryl-4 pyrylium fait bien ressortir l'existence du pic de réduction R2 situé à −0,81 V. La solution étant la même à chaque étude voltamétrique, il faudrait donc envisager, comme on l'a dit ci-dessus, que la microélectrolyse générant le radical soit à l'origine d'une série de transformations chimiques. La solution de 1a se dégrade donc, puisque la concentration de 1a diminue, comme le montrent les voltamogrammes de la Fig. 8, sur lesquels la hauteur du pic R1 est fortement atténuée. Lors de l'électrolyse d'une solution fraîche de 1a, la position rapprochée de ce pic avec le pic R2 ne permet pas de le dissocier clairement de la réduction quantitative de 1a en R1, d'où le pic résultant global obtenu en R1.
4.3 Réduction et oxydation du sel de diphényl-4,6 styryl-2 pyrylium
Toutes les analyses faites ci-dessus concernant la réduction du sel de diphényl-2,6 styryl-4 pyrylium s'appliquent également au sel de diphényly-4,6 styryl-2 pyrylium. L'écart de potentiel entre les pics O1 et R1 est de , valeur identique à celle obtenue par Hünig et al. . [14]. L'oxydation est également un processus irréversible, avec un écart de potentiel . En outre, l'écart de potentiel entre le pic de réduction du diphényl-2,6 styryl-4 pyrylium et celui du diphényly-4,6 styryl-2 pyrylium est identique à la valeur donnée par Hünig, à savoir |ΔE| = 40 mV.
5 Conclusion
Ce travail, qui est une contribution à l'étude des propriétés redox des sels de diphényl-2,6 styryl-4 et diphényl-4,6 styryl-2 pyrylium, a montré que la microélectrolyse de ces sels génère une espèce radicalaire dont la réactivité doit être prise en compte pour expliquer les réactions électrochimiques à l'interface. Le présent travail a montré que la dégradation de la solution initiale de sel de styrylpyrylium ne pourrait s'expliquer que si l'on fait l'hypothèse de la formation d'une nouvelle espèce au sein de la solution initiale, espèce dont la réduction effective a lieu en R2. Cette réduction fait suite à la réduction du sel initial de styrylypyrylium en R1 et pourrait expliquer l'apparition du pic d'oxydation supplémentaire en zone anodique. Au stade actuel de notre étude, nous ne pouvons pas attribuer des espèces définies aux pics en R2 et O2. Notre travail va donc se poursuivre en vue de déterminer la structure de ces espèces. Par ailleurs se pose la question de la stabilité des sels de pyrylium, à savoir s'ils sont suffisamment stables pour justifier l'utilisation qui en est faite, par exemple dans les réactions de décomposition photocatalytique.
Dans les prochains articles, les sels de styrylpyrylium présentant d'autres groupements fonctionnels R2 ou R4 = CH3, OCH3, N(CH3)2, COOH… seront envisagés. La validité des mécanismes de réaction sera établie par coulométrie, simulation et ajustement aux données expérimentales de la voltamétrie cyclique, ce qui permettra de prédire l'effet des substituants présents sur le noyau pyrylium sur les potentiels de réduction et d'oxydation des sels correspondants.


