1 Introduction
De nombreux triterpénoïdes présentent des activités biologiques intéressantes parmi lesquelles des propriétés anti-inflammatoires et anticancéreuses [1,2]. Dans cette vaste famille, les hopanoïdes constituent une série de grand intérêt du fait de leur présence à la fois dans les sédiments (géohopanoïdes) [3,4] et chez les eubactéries (biohopanoïdes) [5,6]. Dans ce dernier cas, ils stabilisent la bicouche lipidique des membranes plasmiques, jouant un rôle comparable aux stérols des eucaryotes [7,8].
La synthèse totale de ces molécules est rendue délicate par la présence de nombreux centres asymétriques. Les hémisynthèses, à partir de composés possédant tous les centres asymétriques du squelette pentacyclique, constituent une bonne alternative. La résine de Dammar commerciale contient 0,3 à 0,6 % en masse de 22-hydroxyhopan-3-one 1, isolable par extraction et cristallisation [9,10], qui constitue le produit de départ de nos réactions. La réduction du groupe carbonyle par réaction de Wolff–Kishner mène au diploptérol 2 avec des rendements quasiment quantitatifs.
D'un point de vue biogénétique, le tétrahymanol de la série gammacérane est étroitement lié au diploptérol 2. Il a été établi que ces deux composés proviennent d'une cyclisation enzymatique du squalène [11]. Le tétrahymanol est utilisé comme biomarqueur de cellules eucaryotes du genre Tetrahymena [12,13] d'où il tire son nom. On le retrouve dans certains sédiments en même temps que des composés de la série hopane et en quantités comparables [14]. Avec sa découverte dans le procaryote Rhodopseudomonas palustris [15] ainsi que dans plusieurs souches appartenant au genre Bradyrhizobium [16] se pose la question de sa spécificité.
Il nous a semblé intéressant de proposer une synthèse chimique de ce composé à partir du diploptérol 2 ; elle constituerait une voie d'accès au tétrahymanol, en alternative à l'isolement par extraction à partir de biomasse. L'étape importante est l'extension du cycle à cinq chaînons des hopanoïdes par réarrangement (Fig. 1).

Transformation de l'hydroxyhopanone 1 en tétrahymanone 3.
2 Résultats et discussion
2.1 Déshydratation du diploptérol
La méthode de déshydratation la plus commune utilise le mélange SOCl2/pyridine [17]. Appliquée au diploptérol 2, elle mène à un mélange de triterpénoïdes (dont principalement le hop-21-ène 4, le hop-22(29)-ène 5 et le hop-17(21)-ène 6). Cette réaction est très sensible aux conditions opératoires, et nous avons entrepris une étude systématique de l'influence de la température.
Trois composés inattendus intéressants ont été isolés après séparation chromatographique sur plaques de silice imprégnée au nitrate d'argent [18] : le hopa-17(21),22(29)-diène 7, le 17α(H)-hop-21-ène 8 et la 17α(H)-trisnorhopanone 9 (Fig. 2).

Composés isolés lors de la déshydratation du diploptérol 2 par le chlorure de thionyle.
Nous remarquons la présence de composés de configuration 17α(H) parmi les produits obtenus. Les hopanoïdes de configuration 17α(H), plus stables thermodynamiquement que leurs isomères de configuration 17β(H), sont majoritairement présents dans les sédiments matures [19]. Les biohopanoïdes présentent en majorité une configuration 17β(H) [5], avec quelques exceptions pour certaines bactéries du sol, appartenant au genre Frankia notamment, qui produisent des hopanoïdes de configuration 17α(H) [20]. L'inversion de configuration de l'atome C-17 a déjà été observée au cours de réactions chimiques [21] ; cependant, elle est inattendue dans les conditions de déshydratation du diploptérol employé.
L'orientation α du proton porté par le C-17 du composé 8 a été déterminée par spectroscopie 2D NOESY. Des couplages ont été observés entre le proton 17α(H) (δ = 2,11 ppm) et les méthyles 18α-CH3 (δ = 0,83 ppm) et 14α-CH3 (δ = 1,04 ppm).
La stéréochimie du composé 9 a été établie par comparaison avec les données de la littérature [22].
Dans le cas du composé 7, le spectre 1H RMN présente deux signaux (δ = 4,77 ppm et δ = 4,88 ppm, 2 × 1H, 2 × s) que nous attribuons à des protons éthyléniques ; cela est confirmé par la présence en 13C RMN de quatre atomes de carbone de type sp2. Une expérience de DEPT (Distortionless Enhancement by Polarization Transfer) à 135 °C révèle la présence de trois carbones quaternaires, le quatrième signal (δ = 113,0 ppm) correspondant, après corrélation, à un CH2 terminal. Le spectre d'absorption UV de ce composé présente trois maximums d'absorption λmax (ε) à 241 μm (15 400), 249 μm (15 600) et 257 μm (9 600), montrant que le système est conjugué.
La proportion relative des six produits de la réaction dépend des conditions utilisées. Afin d'optimiser la production en hop-21-ène 4 désiré, nous avons modifié les conditions réactionnelles. Nous avons fait varier la température (–30, 0 et 20 °C) et le temps de réaction. Les proportions des différents produits sont déterminées par CPG (Tableau 1).
Déshydratation du diploptérol 2 par SOCl2/pyridine : pourcentages relatifs des différents hopanoïdes suivant les conditions réactionnelles
| –30 °C | 0 °C | 20 °C | ||||
| 15 min (%) | 120 min (%) | 15 min (%) | 120 min (%) | 15 min (%) | 120 min (%) | |
| 4 | 20 | 10 | 60 | 40 | 30 | 20 |
| 5 | 70 | 70 | 30 | 40 | 30 | 20 |
| 6 | 1 | 1 | 2 | 3 | 5 | 10 |
| 7 | 1 | 3 | 2 | 3 | 5 | 10 |
| 8 | 4 | 8 | 3 | 7 | 10 | 15 |
| 9 | 4 | 8 | 3 | 7 | 10 | 15 |
| Produits non isolés | 0 | 0 | 0 | 0 | 10 | 10 |
La présence des composés hopa-17(21),22(29)-diène 7 et 17α(H)-trisnorhopanone 9 est particulièrement surprenante du fait qu'ils ne peuvent être obtenus qu'après une étape d'oxydation.
Nous avons émis l'hypothèse selon laquelle SOCl2 (ou l'un de ses sous-produits) serait l'agent oxydant [23] : le chlorure de thionyle réagit sur les alcools [24] et les alcènes [25] en donnant du dioxyde de soufre qui serait responsable de l'oxydation des trois alcènes 4, 5, 6 attendus [26].
Afin de vérifier cette hypothèse, nous avons fait réagir le chlorure de thionyle sur chacun des hopènes 4, 5 et 6. Les résultats sont résumés dans le Tableau 2.
Réaction du chlorure de thionyle sur les hopènes 4, 5 et 6
| Proportion en | |||||
| 7 (%) | 8 (%) | 9 (%) | Autres diènes (%) | Produit de départ (%) | |
| 4 | 10 | 40 | 40 | / | 10 |
| 5 | / | / | 10 | / | 90 |
| 6 | 10 | / | / | 30 (3 diènes) | 60 |
Ces réactions ont été répétées dans l'obscurité et donnent les mêmes résultats, ce qui écarte l'hypothèse d'une réaction photochimique.
Une autre possibilité est la suivante : le dioxyde de soufre formé in situ réagirait avec le chlorure de thionyle pour donner du chlorure de sulfuryle [26] qui jouerait le rôle d'oxydant. Pour vérifier cette hypothèse, nous avons fait réagir le chlorure de sulfuryle, sous atmosphère inerte, sur chacun des hopènes 4, 5 et 6. Les résultats sont résumés dans le Tableau 3 ci-après.
Réaction du chlorure de sulfuryle sur les hopènes 4, 5 et 6
| Produits | |||||
| 7 (%) | 8 (%) | 9 (%) | Autres (%) | Produit de départ (%) | |
| 4 | / | / | 100 | / | / |
| 5 | / | / | / | / | 100 |
| 6 | 20 | / | / | 80 (4 diènes) | / |
Ces résultats confortent l'hypothèse selon laquelle c'est le chlorure de sulfuryle produit in situ qui oxyderait les différents hopènes produits par la déshydratation. Dans d'autres conditions opératoires utilisant du bicarbonate de potassium dans l'anhydride acétique [27], la déshydratation du diploptérol 2 mène exclusivement à un mélange de deux triterpènes (hop-21-ène 4 35 %, et hop-22(29)-ène 5 65 %) en proportion constantes et reproductibles. Notre but étant d'optimiser la production de hop-21-ène 4 à partir du diploptérol 2, nous avons finalement choisi d'additionner le chlorure de thionyle à 0 °C sous atmosphère inerte ; après 15 minutes, le hopène 4 est obtenu avec un rendement de 60 %.
2.2 Réarrangement du hopane-21,22-diol en tétrahymanone
Notre voie de synthèse repose sur un réarrangement pinacolique (Fig. 3).
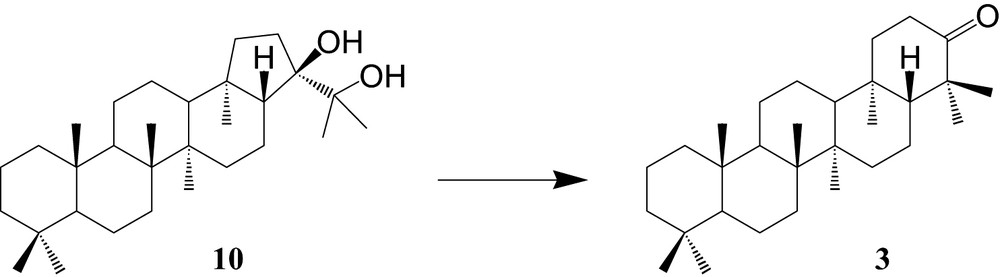
Réarrangement du hopane-21,22-diol 10 en tétrahymanone 3.
2.2.1 Dihydroxylation du hop-21-ène
La dihydroxylation de la double liaison du hop-21-ène 4 n'a pas pu être réalisée dans des conditions classiques (tétroxyde d'osmium en quantité catalytique/N-oxyde de N-méthylmorpholine) à température ambiante. Ce n'est qu'à reflux dans le t-butanol que le diol 10 désiré a pu être obtenu à côté de deux autres produits (Fig. 4), la 17α(H)-trisnorhopan-21-one 9, et un produit de structure originale : la 17-hydroxytrisnorhopan-21-one 11. Cette inertie du substrat est vraisemblablement due à l'encombrement stérique de la double liaison du hop-21-ène 4. La configuration en C-21 du diol a été attribuée par spectroscopie 2D NOESY. Des couplages ont été observés entre le méthyle 18α-CH3 (δ = 0,75 ppm) et les méthyles 22-CH3 (δ = 1,23 ppm et δ = 1,26 ppm) montrant que le carbone 22 est du côté α, le groupement OH porté par le carbone 21 se trouvant du côté β. Cependant, en ce qui concerne le produit nouveau 11, la position du groupement hydroxy en C-17 n'a pas pu être déterminée.
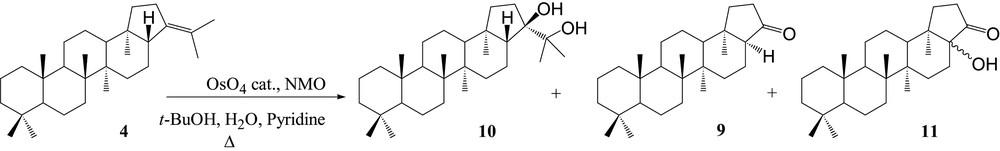
Dihydroxylation du hop-21-ène 4.
Plus le temps de reflux augmente, plus la quantité de réactif diminue mais la proportion diol/trisnorhopan-21-one/17-hydroxytrisnorhopan-21-one reste constante (Tableau 4).
Osmylation du hop-21-ène 4
| Temps de reflux | Rdt en diol 10 (%) | Rdt en trisnorhopan-21-one 9 (%) | Rdt en 17-hydroxytrisnorhopan-21-one 11 (%) |
| 1 jour | 10 | 10 | 5 |
| 3 jours | 35 | 35 | 20 |
2.2.2 Réarrangement du hopane-21,22-diol en tétrahymanone
À notre connaissance, seuls Ageta et al. [28] ont réalisé, en 1966, le réarrangement pinacolique d'un diol possédant le squelette hopane, par action du chlorure de mésyle (MsCl) dans la pyridine, malheureusement sans détailler les conditions réactionnelles, ni préciser le rendement.
En utilisant ce réactif, une première série d'expériences n'a montré, après trois jours à température ambiante, aucune transformation du produit de départ. Nous avons alors tenté, également sans succès, d'effectuer l'agrandissement de cycle à reflux dans la pyridine. Ce n'est qu'en présence d'un catalyseur, la diméthylaminopyridine (DMAP), que la conversion a pu être observée, avec un rendement optimisé de 55% (Tableau 5).
Optimisation du réarrangement du hopane-21,22-diol 10 en tétrahymanone 3
| Conditions de réaction | Température | Rdt en tétrahymanone 6 (%) |
| 1équiv MsCl, pyridine dans CH2Cl2 | 3 jours à T.A. | 0 |
| 1équiv MsCl, pyridine dans CH2Cl2 | 5 h à reflux | 0 |
| 2équiv MsCl, pyridine dans CH2Cl2 | 5 h à reflux | 0 |
| 2équiv MsCl, pyridine, DMAP dans CH2Cl2 | 5 h à reflux | 20 |
| 2équiv MsCl, pyridine, DMAP dans CH2Cl2 | 3 jours à reflux | 55 |
L'analyse du milieu ne met en évidence qu'une seule structure, comme en série stéroïde [29], alors que d'autres molécules correspondant aux différentes possibilités de réarrangement sont envisageables.
Le réarrangement pinacolique en milieu acide du hopane-21,22-diol 10 [29], n'a pas été observé (obtention d'un mélange de composés isomères présentant deux doubles liaisons, d'après une analyse par CPG/SM).
2.3 Autres stratégies de synthèse
À titre comparatif, nous avons testé d'autres voies de synthèse pour effectuer cette transformation.
2.3.1 Réaction d'un acide de Lewis sur les 21α,22α-époxyhopane 12 et 21β,22β-époxyhopane 13
Les deux époxydes isomères sont obtenus par action de l'acide m-chloroperbenzoïque sur le hop-21-ène et séparés par chromatographie. La configuration en C-21 des deux époxydes 12 et 13 a été attribuée après étude des spectres RMN 1H et 13C, et par comparaison avec les spectres de la littérature [30]. Lorsque l'oxygène de l'époxyde (ou de l'alcool) est en position α, les protons du groupement méthyle portés par le carbone 18 sont déblindés (δ = 0,880 ppm pour l'époxyde 12) par rapport au même signal des épimères β (δ = 0,721 ppm pour l'époxyde 13).
Nous n'avons mis en évidence aucun réarrangement de ces époxydes avec les acides de Lewis que nous avons utilisé (BF3-(C2H5O)2O, LiI, AlCl3, SnCl4, AgNO3, TfO3Sc) [31]. Les tentatives d'ouverture des époxydes, en milieu acide ou basique, pour former le hopane-21,22-diol 10 n'ont pas été couronnées de succès.
2.3.2 Action de sel de magnésium sur les halohydrines
Le réarrangement constaté lors de l'action d'organomagnésien sur une halohydrine est bien connu [32 et références citées]. Dans notre cas, la synthèse de bromhydrine est délicate du fait des propriétés oxydantes de la NBS et mène majoritairement quel que soit le solvant (CCl4, THF, DMSO), à l'isolement de 17α(H)-trisnorhopan-21-one 9. L'action du bromure d'isopropylmagnésium, sans chromatographie du milieu réactionnel, ne conduit pas au résultat escompté.
Les différents essais de préparation d'iodhydrine [33] n'ont donné lieu à aucune réaction.
3 Conclusion
Malgré l'échec de certaines stratégies de synthèse envisagées au départ, nous avons réalisé avec succès la transformation chimique, en quatre étapes, du diploptérol en tétrahymanone. Chaque réaction a été étudiée tant du point de vue de l'amélioration des rendements que de l'élucidation des structures des produits secondaires et l'étape clef d'agrandissement de cycle a été optimisée avec un rendement de 55%.
Cette transformation (rendement total de 10%), met en évidence la possibilité d'une voie chimique pour passer de la série hopane à la série gammacérane. Elle permet un accès aisé aux dérivés du tétrahymanol et donne aux géochimistes une alternative pour obtenir cette molécule de biomarqueur.
Les mécanismes de transformations abiotiques d'une série à l'autre dans les sédiments, si elles ont lieu, restent encore à élucider.
4 Partie expérimentale
4.1 Généralités
Tous les solvants ont été distillés avant usage.
Les spectres RMN ont été enregistrés sur un appareil Bruker Avance 400 à 300 K. Le chloroforme (δ = 7,26 ppm) est utilisé comme référence interne pour les spectres 1H (400,17 MHz) et le deutériochloroforme (δ = 77,03 ppm) pour les spectres 13C (100,62 MHz). L'attribution des signaux a été obtenue en utilisant des techniques de RMN à deux dimensions (HSQC, HMBC et NOESY).
Les spectres d'absorption infrarouge ont été obtenus à l'aide d'un spectromètre Bruker Equinox 55 en solution dans le chloroforme.
Les spectres de masse ont été enregistrés, après chromatographie en phase gazeuse, sur un appareil Hewlett Packard HP 5890 séries II (colonne capillaire BPX5 de silice fondue, 0,15 mm × 25 m, 0,25 μm), injecteur splitless, détecteur de masse sélective HP 5971 A (IE, 70 eV) ; l'hélium sert de gaz vecteur (8 psi). La température de four est programmée de 80 à 310 °C avec un gradient de 3,5 °C/min.
4.2 Mélange de hopènes après déshydratation du diploptérol
Le mode opératoire suivant est identique quelle que soit la température de réaction.
Le diploptérol (100 mg) est dissous, sous agitation, dans un mélange chloroforme/pyridine (7,5 ml, 2/1, v/v) et de chlorure de thionyle fraîchement distillé (0,5 ml) sous azote, à la température désirée (–30, 0, ou 20 °C). Le mélange réactionnel est analysé par chromatographie en phase gazeuse toutes les 15 min. Pour cela, un aliquot du mélange réactionnel est neutralisé avec une solution aqueuse d'hydrogénocarbonate de sodium (1 M) jusqu'à pH neutre puis dilué avec de l'éther diéthylique. La phase organique est séchée sur MgSO4, puis évaporée. Les différents hopanoïdes sont séparés par chromatographie sur couche mince de silice imprégnée au nitrate d'argent (10% dans l'acétonitrile) [18] en utilisant comme éluant le mélange cyclohexane/toluène (9/1, v/v) pour donner : 17α(H)-hop-21-ène 8 (Rf = 0,65), hop-21-ène 4 (Rf = 0,55), 17α(H)-trisnorhopan-21-one 9 (Rf = 0,50), hop-17(21)-ène 6 (Rf = 0,41), hopa-17(21),22(29)-diène 7 (Rf = 0,25) et hop-22(29)-ène 5 (Rf = 0,20). Les proportions sont déterminées par chromatographie phase gazeuse.
4.2.1 Hopa-17(21),22(29)-diène 7
RMN 1H : δ = 0,72 (1H, m, 5α-H), 0,78 (1H, m, 1α-H), 0,79 (3H, s, 4β-CH3), 0,82 (3H, s, 10β-CH3), 0,84 (3H, s, 4α-CH3), 0,90 (3H, s, 18α-CH3), 0,94 (3H, s, 8β-CH3), 1,06 (3H, s, 14α-CH3), 1,12 (1H, m, 3α-H), 1,25-1,76 (18H, CH, CH2 du squelette), 1,91 (3H, s, 30-CH3), 2,03 (1H, m, 16α-H), 2,30 (1H, m, 20α-H), 2,40 (1H, m, 20β-H), 2,66 (1H, m, 16β-H), 4,77; 4,88 (2 × 1H, 2 × s, 29-H, 30-H) ; RMN 13C : δ = 15,1 (C-27), 16,2 (C-25), 16,4 (C-26), 18,7 (C-2), 18,7 (C-6), 19,1 (C-28), 21,3 (C-11), 21,3 (C-16), 21,6 (C-24), 23,1 (C-30), 24,1 (C-12), 31,8 (C-15), 32,5 (C-20), 33,3 (C-4), 33,4 (C-7), 33,4 (C-23), 37,5 (C-10), 40,4 (C-1), 41,3 (C-19), 41,6 (C-14), 42,0 (C-8), 42,1 (C-3), 49,4 (C-13), 50,9 (C-9), 51,1 (C-18), 56,3 (C-5), 113,0 (C-29), 131,7 (C-21), 142,1 (C-17), 145,8 (C-22).
4.2.2 17α(H)-hop-21-ène 8
RMN 1H : δ = 0,71 (1H, m, 5α-H), 0,78 (1H, m, 1α-H), 0,80 (3H, s, 4β-CH3), 0,81 (3H, s, 10β-CH3), 0,83 (3H, s, 18α-CH3), 0,85 (3H, s, 4α-CH3), 0,90 (3H, s, 8β-CH3), 0,94 (1H, m, 15α-H), 1,04 (3H, s, 14α-CH3), 1,12–1,56 (18H, CH, CH2 du squelette), 1,60; 1,64 (2 × 3H, 2 × s, 29-CH3, 30-CH3), 1,66 (1H, m, 1β-H), 1,76 (1H, m, 15β-H), 2,11 (1H, m, 17α-H), 2,18 (2H, m, 20-H) ; RMN 13C : δ = 16,0 (C-25), 16,5 (C-26), 18,5 (C-6), 18,7 (C-2), 20,6 (C-27), 20,9 (C-29), 21,4 (C-11), 21,5 (C-30), 21,6 (C-24), 23,0 (C-28), 24,5 (C-12), 25,8 (C-7), 28,4 (C-20), 32,5 (C-15), 33,2 (C-16), 33,3 (C-4), 33,4 (C-23), 37,5 (C-10), 40,3 (C-1), 41,4 (C-19), 41,6 (C-14), 42,1 (C-3 et C-8), 42,7 (C-13), 44,3 (C-18), 49,5 (C-17), 51,0 (C-9), 56,5 (C-5), 122,5 (C-22), 140,4 (C-21).
4.3 Dihydroxylation catalytique du hop-21-ène 4
Un mélange de hop-21-ène 4 (100 mg), d'une solution de tétroxyde d'osmium à 2,5 % en masse dans le t-butanol (300 μl), de N-oxyde de N-méthylmorpholine (40 mg), de pyridine (500 μl) et d'eau (2 ml) dans le t-butanol (20 ml) est porté au reflux. La réaction est suivie par chromatographie sur couche mince jusqu'à la disparition du hop-21-ène 4 (trois jours). Le mélange réactionnel est refroidi à température ambiante et ajouté à une solution aqueuse à 20% de métabisulfite de sodium (Na2S2O5). Après 30 min d'agitation, les solvants sont distillés sous vide. Le résidu solide est ensuite extrait à l'acétate d'éthyle, filtré et évaporé sous vide.
Après séparation par chromatographie sur couche mince (éluant : cyclohexane/acétate d'éthyle, 8/2, v/v) on obtient un mélange de hopane-21,22-diol 10 (40 mg, Rf = 0,18), de 17α(H)-trisnorhopan-21-one 9 (35 mg, Rf = 0,59), et de 17-hydroxytrisnorhopan-21-one 11 (20 mg, Rf = 0,52).
4.3.1 Hopane-21,22-diol 10
RMN 1H : δ = 0,70 (1H, m, 5α-H), 0,75 (3H, s, 18α-CH3), 0,77 (1H, m, 1α-H), 0,79 (3H, s, 4β-CH3), 0,81 (3H, s, 10β-CH3), 0,84 (3H, s, 4α-CH3), 0,94 (3H, s, 14α-CH3), 0,97 (3H, s, 8β-CH3), 1,12-1,65 (22H, CH, CH2 du squelette pentacyclique), 1,23 (3H, s, 22-CH3), 1,26 (3H, s, 22-CH3), 1,9 (1H, m, 20α-H), 1,92 (1H, s, C21-OH), 2,0 (1H, m, 16α-H), 2,45 (1H, s, C22-OH) ; RMN 13C : δ = 15,85 (C-28), 15,87 (C-25), 16,78 (C-26), 17,00 (C-27), 18,68 (C-2), 18,69 (C-6), 20,68 (C-16), 20,86 (C-11), 21,60 (C-24), 24,00 (C-12), 26,22 (C-29), 27,06 (C-30), 33,24 (C-7), 33,36 (C-4), 33,41 (C-23), 34,60 (C-15), 35,97 (C-20), 37,40 (C-10), 39,05 (C-19), 40,33 (C-1), 41,79 (C-14), 41,92 (C-8), 42,10 (C-3), 45,37 (C-18), 50,39 (C-13), 50,58 (C-9), 56,10 (C-5), 65,71 (C-17), 76,06 (C-22), 86,15 (C-21). Le spectre de masse du diol après silylation (bis-(triméthylsilyl)trifluoroacétamide catalysé par 1% de triméthylchlorosilane et pyridine) est le suivant : m/z = 457 (45%, M+ – chaîne latérale silylée), 367 (20%, M+ – chaîne latérale silylée – alcool silylé), 191 (100%, coupure du cycle C), 131 (75%, chaîne latérale silylée).
4.3.2 17-hydroxytrisnorhopan-21-one 11
RMN 1H : δ = 0,70 (1H, m, 5α-H), 0,78 (1H, m, 1α-H), 0,78 (3H, s, 4β-CH3), 0,80 (3H, s, 8β-CH3), 0,81 (3H, s, 10β-CH3), 0,84 (3H, s, 4α-CH3), 1,04 (3H, s, 14α-CH3), 1,06 (3H, s, 18α-CH3), 1,14 (2H, m, 3α-H, 15α-H), 1,22-1,62 (15H, CH, CH2 du squelette pentacyclique), 1,64 (1H, m, 16α-H), 1,67 (1H, m, 19α-H), 1,81 (1H, m, 16β-H), 1,91 (1H, m, 19β-H), 2,21 (1H, m, 20α-H), 2,44 (1H, m, 20β-H) ; RMN 13C : δ = 15,52 (C-27), 15,99 (C-25), 16,16 (C-26), 16,32 (C-28), 18,61 (C-6), 18,68 (C-11 ou C-12), 21,38 (C-2), 21,55 (C-24), 23,39 (C-12 ou C-11), 25,14 (C-16), 27,66 (C-15), 31,51 (C-19), 33,06 (C-20), 33,06 (C-7), 33,27 (C-4), 33,38 (C-23), 37,41 (C-10), 39,60 (C-13), 40,37 (C-1), 40,81 (C-14), 41,97 (C-8), 42,06 (C-3), 45,11 (C-18), 50,67 (C-9), 56,28 (C-5), 79,56 (C-17), 218,67 (C-21) ; IR (Nombre d'ondes, cm−1) : 1460, 1643, 1708, 1740, 3582 ; Spectre de masse (CPG/SM) : m/z = 400 (10%, M+), 385 (10%, M+–CH3), 367 (2%, M+–CH3–H2O), 191 (100%, coupure du cycle C).
4.4 Réarrangement pinacolique du hopane-21,22-diol 10 en tétrahymanone 3
Un mélange de hopan-21,22-diol 10 (100 mg), chlorure de mésyle (500 μl, 2 équiv), pyridine (3 ml) et de DMAP (5% en masse) dans le dichlorométhane (10 ml) est mis à reflux pendant trois jours. Le mélange réactionnel est refroidi à température ambiante, versé dans l'eau (10 ml) puis extrait au dichlorométhane. La phase organique est lavée à l'eau, séchée sur MgSO4 anhydre et évaporée sous vide. Après séparation par chromatographie sur couche mince (éluant : cyclohexane/acétate d'éthyle, 97/3, v/v, deux migrations), on obtient : hopa-17(21),22(29)-diène 7 (30 mg), tétrahymanone 3 (50 mg).
4.4.1 Tétrahymanone 3
RMN 1H : δ = 0,72 (1H, m, 5α-H), 0,77 (1H, m, 1α-H), 0,79 (3H, s, 4β-CH3), 0,82 (3H, s, 10β-CH3), 0,85 (3H, s, 4α-CH3), 0,92 (3H, s, 18α-CH3), 0,97 (3H, s, 8β-CH3), 1,00 (3H, s, 14α-CH3), 1,02 (3H, s, 22α-CH3), 1,07 (3H, s, 22β-CH3), 1,12 (1H, m, 3α-H), 1,25-1,63 (20H, CH, CH2 du squelette pentacyclique), 1,92 (1H, ddd, J19β,19α = 13,1 Hz, J19β,20β = 7,6 Hz, J19β,20α = 4,3 Hz, 19β-H), 2,40 (1H, ddd, J20α,20β = 15,6 Hz, J20α,19α = 7,3 Hz, J20α,19β = 4,5 Hz, 20α-H), 2,50 (1H, ddd, J20β,20α = 15,6 Hz, J20β,19α = 9,6 Hz, J20β,19β = 7,3 Hz, 20β-H) ; Spectre RMN 13C : δ = 15,84 (C-28), 16,02 (C-25), 16,31 (C-27), 16,45 (C-26), 18,68 (C-6), 18,68 (C-2), 19,79 (C-11), 21,10 (C-16), 21,12 (C-29), 21,58 (C-24), 21,76 (C-12), 26,60 (C-30), 32,38 (C-15), 33,05 (C-7), 33,26 (C-4), 33,26 (C-14), 33,40 (C-23), 34,22 (C-20), 36,77 (C-18), 37,35 (C-10), 39,57 (C-19), 40,32 (C-1), 41,66 (C-22), 41,98 (C-8), 42,10 (C-3), 49,57 (C-13), 50,44 (C-9), 54,89 (C-17), 56,17 (C-5), 218,40 (C-21) ; Spectre de masse (CPG/SM) : m/z = 426 (20 %, M+), 411 (10%, M+–CH3), 205 (30%, coupure du cycle C), 191 (100%, coupure du cycle C).
4.5 21,22-époxyhopane
Dans un mortier en agate, broyer le hop-21-ène 4 (12 mg), l'acide 4-chloroperbenzoïque (32 mg) et du carbonate de sodium (19 mg) et mélanger soigneusement pendant trois minutes. Laisser reposer 15 min, puis diluer le milieu réactionnel dans le chloroforme ; laver cette solution à l'eau. Décanter, déshydrater la phase organique sur MgSO4 puis évaporer le solvant.
Les deux isomères sont séparés par CCM sur silice (0,25 mm déposé sur verre) en utilisant comme éluant un mélange cyclohexane/acétate d'éthyle (98/2, v/v, trois migrations). La révélation par aspersion avec une solution de chlorhydrate de berbérine (0,5% en masse dans l'éthanol) fait apparaître deux bandes ; le produit le moins polaire correspond au 21α,22α-époxyhopane (4 mg), l'autre au 21β,22β-époxyhopane (6 mg) majoritaire.
L'attribution des signaux portant la même lettre en exposant peut être interchangée.
4.5.1 21α,22α-époxyhopane 12
RMN 1H : δ = 0,796 (3H, s, 4β-CH3), 0,822 (3H, s, 10β-CH3), 0,850 (3H, s, 4α-CH3), 0,880 (3H, s, 18α-CH3), 0,973 et 0,985 (2 × 3H, s, 8β et 14α-CH3), 1,224 (3H, s, 22-CH3), 1,394 (3H, s, 22-CH3); RMN 13C : δ = 15,33 (C-25), 15,84 (C-28), 16,70 (C-26)e, 16,91 (C-27)e, 18,72 (C-2 et C-6), 20,75 (C-16)c, 20,82 (C-11)c, 21,09 (C-29)f, 21,62 (C-24), 23,33 (C-12), 24,33 (C-30)f, 30,74 (C-20)a, 32,63 (C-15)a, 33,19 (C-7)a, 33,27 (C-4), 33,42 (C-23), 37,42 (C-10), 38,75 (C-19), 40,33 (C-1), 41,68 (C-18)b, 41,99 (C-14)b, 42,11 (C-3), 45,94 (C-8)b, 48,57 (C-13), 50,36 (C-9), 52,49 (C-17), 56,11 (C-5), 58,45 (C-21)d, 72,88 (C-22)d.
4.5.2 21β,22β-époxyhopane 13
RMN 1H : δ = 0,721 (3H, s, 18α-CH3), 0,795 (3H, s, 4β-CH3), 0,824 (3H, s, 10β-CH3), 0,847 (3H, s, 4α-CH3), 0,960 et 0,985 (6H, 2 s, 8β et 14α-CH3), 1,226 (3H, s, 22-CH3), 1,399 (3H, s, 22-CH3); RMN 13C : δ = 14,96 (C-28), 15,93 (C-25), 16,32 (C-26)k, 16,54 (C-27)k, 18,71 (C-2 et C-6), 20,88 (C-16)g, 21,34 (C-11)g, 21,60(C-24), 21,87 (C-29)m, 23,20 (C-12), 23,81 (C-20)m, 23,81 (C-30)i, 27,67 (C-15)i, 33,26 (C-7), 33,26 (C-4), 33,43 (C-23), 37,45 (C-10), 38,67 (C-19), 40,39 (C-1), 41,76 (C-18)h, 41,90 (C-8), 42,14 (C-3), 42,76 (C-14)h, 48,60 (C-13), 50,54 (C-9), 54,54 (C-17), 56,21 (C-5), 64,14 (C-21)j, 73,27 (C-22)j.
5 Remerciements
Ce travail a été financé par une bourse de la fondation de l'École nationale supérieure de chimie de Mulhouse. Les auteurs remercient tout particulièrement le Dr Didier Le Nouen pour les mesures de RMN, le Dr Anna Boulanger pour les spectres de masse et le Dr Luc Delmotte pour les spectres infrarouge. Les auteurs tiennent aussi à remercier les rédacteurs invités et le comité de lecture pour leurs judicieux commentaires.


