1 Introduction
La classification périodique est souvent présentée comme une sorte de charte dictée par la nature, comme si Mendeleev n’avait eu qu’à ouvrir le livre de la nature pour la découvrir, ou que le tableau périodique lui fût révélé dans une vision, comme les tables de la loi reçues par Moïse.
Or ce tableau n’a pas été conçu comme une charte livrant les briques élémentaires de la nature. Il n’est pas davantage une anticipation visionnaire de la physique atomiste. Il est le fruit du patient travail de récapitulation des connaissances empiriques accumulées sur les éléments mené par Mendeleev. Mieux, il s’inscrit dans la longue quête d’une classification naturelle qui occupe plusieurs générations de chimistes au xixe siècle.
Plutôt que de raconter l’histoire du tableau de Mendeleev dans un style héroïque, cet article vise à le resituer dans le contexte de cette longue quête. Le tableau de Mendeleev est l’un des multiples essais de classification proposés au xixe siècle et n’a d’ailleurs pas emporté immédiatement l’adhésion de tous les chimistes. Après avoir dégagé les motivations qui suscitent une fièvre de classification au xixe siècle, on tente de comprendre ce qui singularise Mendeleev en considérant ses raisonnements et ses convictions sur la nature des éléments.
2 Pressions démographique et didactique
Toute classification présuppose une multiplicité d’objets à ordonner. Or la chimie du xixe siècle se trouve confrontée à une croissance rapide de la population des substances simples par suite des progrès de l’analyse. Les substances simples passent de douze à trente-trois à l’époque de Lavoisier tandis que la théorie chimique s’organise autour de la distinction corps simple/corps composé. Puis l’introduction de la pile de Volta au début du xixe siècle permet d’isoler de nouveaux corps simples qui porte leur nombre à cinquante vers 1840. Dans les années 1860, la spectrographie provoque une nouvelle vague de recherches analytiques, si bien qu’on atteint la centaine vers 1900 (Tableau 1).
Chronologie de la découverte des éléments aux xviiie et xixe siècles.
| Avant 1700 | 1700–1800 | 1800–1850 | 1850–1900 |
| Antimoine | Azote | Aluminium | Actinium |
| Argent | Béryllium | Baryum | Argon |
| Arsenic | Bismuth | Bore | Césium |
| Carbone | Chrome | Brome | Dysprosium |
| Cuivre | Cobalt | Cadmium | Gadolinium |
| Étain | Fluor | Calcium | Gallium |
| Fer | Hydrogène | Cérium | Germanium |
| Mercure | Manganèse | Chlore | Hélium |
| Or | Molybdène | Erbium | Holmium |
| Phosphore | Nickel | Iode | Indium |
| Plomb | Oxygène | Lanthane | Krypton |
| Soufre | Platine | Lithium | Néodyme |
| Strontium | Magnésium | Néon | |
| Tellure | Niobium | Polonium | |
| Titane | Osmium | Praséodyme | |
| Tungstène | Palladium | Radium | |
| Uranium | Potassium | Rhodium | |
| Yttrium | Rubidium | Ruthénium | |
| Zinc | Sélénium | Samarium | |
| Zirconium | Silicium | Scandium | |
| Sodium | Thallium | ||
| Tantale | Thullium | ||
| Thorium | Xénon | ||
| Vanadium | Ytterbium |
Un deuxième moteur de la quête de classification au xixe siècle est la pression pédagogique. Avec le développement des cours de sciences expérimentales dans écoles et les facultés (surtout de médecine) se multiplie le nombre des chimistes professeurs. Comment apprendre et enseigner les connaissances sur des dizaines et dizaines de substances ? L’inflation de la population matérielle, qui semble indéfinie, met les professeurs de chimie dans le plus grand embarras. Seront-ils contraints d’égrainer devant leurs étudiants un chapelet de monographies en prenant les corps simples par ordre alphabétique, comme un dictionnaire ? Faut-il faire apprendre de longues listes de propriétés individuelles sans trop chercher à faire comprendre ?
La classification intéresse avant tout les professeurs et auteurs de manuels. Le chimiste suédois Jöns Jacob Berzelius, qui rayonne sur toute l’Europe jusque dans les années 1830, organise son traité en fonction de dichotomies multiples : il distingue les substances en simples et composées et parmi les simples il distingue les pondérables et impondérables ; il commence ainsi par l’étude de quatre substances impondérables (la lumière, la chaleur, les forces électrique et magnétique, qui faisaient partie intégrante de la chimie au début du xixe siècle). Ensuite, il divise les éléments pondérables en deux catégories, inorganique et organique. La première se subdivise à son tour en métaux et non-métaux que Berzelius baptise « métalloïdes » ; enfin les substances organiques se subdivisent également en deux catégories : végétales et animales. En France, le traité de Thenard publié en 1816 sert de modèle à tous les manuels jusqu’à la fin du siècle [1]. Pour classer les corps simples, il sélectionne un caractère unique – le degré d’affinité pour l’oxygène qu’il applique de manière systématique. Ce critère fonctionne assez mal pour ordonner les six non-métaux, mais fait merveille pour les trente-huit métaux que Thenard répartit en six classes suivant qu’ils absorbent ou non l’oxygène, à température élevée ou non, en décomposant l’eau ou non (Tableau 2).
La classification des métaux de Thenard [1].
| Sections | Métaux |
| 1 | Mg, Be, Y, Al, Th, Zr, Si |
| 2 | Ca, Sr, Ba, Li, Na, K |
| 3 | Mn, Zn, Fe, Sn, Cd |
| 4 | (a) As, Mo, Cr, W, Columbium (b) Sb, U, Ce, Co, Ti, Bi, Cu, Te, Ni, Pb |
| 5 | Hg, Os |
| 6 | Ag, Pd, Rh, Pt, Au, Ir. |
Cette classification chimique repose sur le postulat tacitement admis par tous les chimistes : que la nature et la proportion des éléments constituants déterminent les propriétés des corps composés. C’est ce qui permet de se fier aux analogies de comportement et propriétés. Mais, elle privilégie le rôle de l’oxygène malgré la ruine de sa théorie Lavoisienne des acides qui justifiait le nom donné à l’oxygène en 1787 (oxygène = générateur d’acide).
Ce choix arbitraire et peu satisfaisant justifie la quête d’une « classification naturelle », c’est dire prenant en compte l’ensemble des propriétés des corps simples. Ampère, déplorant l’exagération du rôle de l’oxygène, cherche des principes de classification chez les naturalistes, et s’inspire en particulier de Antoine-Laurent de Jussieu. En 1816, il publie un « Essai d’une classification naturelle pour les corps simples » [2] reposant sur « l’ensemble des caractères des corps qu’on se propose de classer » et réunissant dans un même groupe les substances qui présentent les analogies plus nombreuses et les plus essentielles.
Exprimer toutes les analogies, tel est le rêve d’Ampère. Il tente d’abord, en vain, une classification circulaire présentant une série unique avec variation continue des propriétés. Puis il choisit de regrouper les corps simples en trois familles – gazolytes, leucolytes, chroïcolytes – qui se divisent à leur tour en quinze genres lesquels se subdivisent en espèces, de telle sorte que « deux corps placés aux deux extrémités de la chaîne formée par tous les autres se rapprochent et s’unissent mutuellement par des caractères communs » (Tableau 3).
Classification d’Ampère (1816) [2].
| Gazolytes | Leucocytes | Chroicolytes |
| Anthracides : C, H | Argyrides : Ag, Bi, Hg, Pb | Titanides : Ti, Os |
| Borides : B, Si | Calcides : Ca, Sr, Ba, Mg | Cérides : Ce, Mn |
| Chlorides : Cl, F,I | Cassitérides : Sn, Sb, Zn | Chrysides : Au, Pt, Pd, Rh, Ir |
| Thionides : S,N,O | Téphralides : Na, K | Chromides : Cr, W,Columbium, Mo. |
| Arsénides : As, Te, P | Zirconoïdes : Zr, Al, Be, Y | Sirérides : Fe, Cu, Ni, Co, V |
Si cette classification ne suscite pas l’enthousiasme des chimistes professeurs, elle n’est pas pour autant tombée dans l’oubli. Elle est perçue comme imparfaite, impraticable mais « plus philosophique », que la « classification artificielle » de Thenard. Certains chimistes comme Alexandre Baudrimont et Ferdinand Hoefer s’efforcent de l’améliorer. Et vers le milieu du siècle la plupart des manuels français adoptent une classification hybride combinant la classification artificielle des métaux de Thenard avec une classification naturelle des non-métaux empruntée à Jean-Baptiste Dumas [3]. Bien commode, cette solution bâtarde est cependant peu satisfaisante d’un point de vue théorique.
Mendeleev, nommé professeur de chimie à l’université de Saint-Petersbourg en 1860, comme bien d’autres chimistes, entreprend à son tour d’écrire un manuel pour son cours de chimie générale [4]. L’ouvrage intitulé Principes de chimie, paru en 1871, commence par des chapitres sur les substances les plus communes et familières : l’eau, (qui permet d’introduire deux éléments, l’hydrogène et l’oxygène) ; l’air (qui introduit l’azote et ses composés) ; puis le carbone ; le chlorure de sodium ; les halogènes (chlore, brome, etc.), et c’est seulement à la moitié du parcours, au chapitre XV intitulé « Similitude des éléments et loi périodique » qu’est présentée la classification.
Comment Mendeleev échappe-t-il au dilemme classification naturelle ou artificielle ? Comment parvient-il à construire une classification obéissant à un critère unique – le poids atomique des éléments – qui embrasse néanmoins la presque totalité des propriétés et puisse donc prétendre au titre de classification naturelle ? Le secret est la loi périodique.
3 Stratégies pour gérer le multiple
Il y a en effet deux manières possibles de classer la multiplicité indéfinie des corps simples : l’une revient à réduire cette multiplicité à unité d’un élément primordial, l’autres à chercher une loi unique régissant la multiplicité.
L’idée que la diversité des éléments pourrait dériver de l’hydrogène est avancée par William Prout au début du xixe siècle [5]. À l’époque, John Dalton a émis l’hypothèse atomique et choisi conventionnellement l’hydrogène pour unité des poids atomiques : H = 1. Ce choix incite à utiliser le poids atomique pour prouver que tous les autres éléments sont des multiples entiers de celui de l’hydrogène. Quand les chimistes déterminent que le poids atomique du chlore est Cl = 35,5, l’hypothèse est révisée pour accommoder cette décimale. On déclare alors que les poids atomiques sont multiples d’une fraction de l’hydrogène. Ainsi aménagée l’hypothèse échappe aux démentis expérimentaux et elle trouve un appui dans la classification des radicaux organiques puis dans théorie darwinienne de l’évolution qui suggère une origine commune des vivants.
Comme le montre bien Van Spronsen [6], tout au long du siècle cette hypothèse stimule des essais de classification fondés sur le principe des relations arithmétiques entre poids atomiques dont le but est de dégager les structures de parenté entre les éléments. Le premier – contemporain de ceux d’Ampère et de Thenard – est l’essai de Johan Döbereiner, professeur à Iéna, qui identifie des relations arithmétiques remarquables. Il établit une série de triades reposant sur la corrélation entre analogies chimiques et relations des poids atomiques. Br = Cl + ½ ; Na = Li + K/2 ; Se = S + Te/2. L’objectif de réduction de la multiplicité des éléments engage à une quête généalogique centrée sur les liens de parenté. C’est pourquoi elle a permis de repérer bien des « familles » d’éléments à travers les essais successifs de Gmelin, Gladstone, Cooke, Carey Lea, Lenssen, et Dumas. Mais en procédant du local au local on parvient difficilement à dresser un tableau d’ensemble. Seul Alexandre Béguyer de Chancourtois y parvient : en 1862, il propose à l’Académie des sciences en 1862 une « vis tellurique » fondée sur la prise en considération de la loi de Prout. Mais elle mêle corps simples et composés et le graphisme paraît si peu adéquat aux éditeurs des Comptes-rendus de l’Académie des sciences qu’il n’est pas inséré dans la publication. En revanche, un modèle en 3D subsiste à l’École nationale des mines à Paris.
Si l’hypothèse de Prout stimule les entreprises de classification, elle focalise néanmoins sur la recherche de parentés locales plutôt que d’une loi d’ensemble. Tel est du moins le jugement que porte Mendeleev pour souligner le contraste avec sa propre démarche.
Contrairement aux chimistes français qui se contentent d’une solution bâtarde, Mendeleev cherche une loi de la nature autant qu’une classification commode. Or les lois naturelles, dit-il, ne souffrent pas d’exception. Une loi peut être confirmée seulement quand toutes les conséquences que l’on en peut tirer ont subi la sanction expérimentale.
Mendeleev n’est pas le seul à procéder de la sorte. Deux autres chimistes – John Alexander Newlands et William Odling suivent la même voie dans les années 1860 et Van Spronsen répertorie même cinq candidats au titre d’inventeur du système périodique ! Comme Mendeleev, ils adoptent les poids atomiques fondés sur la loi d’Avogadro-Ampère qui révèlent mieux des régularités. C’est au premier congrès international de chimie à Karlsruhe en 1860 [7], que Mendeleev a pris connaissance de ce système de poids atomiques vigoureusement défendu par Stanislao Cannizzaro et il désigne souvent ce congrès comme le facteur essentiel qui l’a mené à la loi périodique [8].
Mendeleev entrevoit le motif de la périodicité en comparant les éléments les plus dissemblables. Au lieu de chercher des analogies, il cherche les contrastes et découvre ainsi une régularité dans les poids atomiques :
| Li = 7 | Na = 23 | K = 39 | Rb = 85,4 | Cs = 133 |
| F = 19 | Cl = 35,5 | Br = 80 | Te = 127 |
Telle est la charpente de sa table. Ensuite il maille peu à peu un réseau en disposant les métaux alcalino-terreux. Il avance en tâtonnant et compare cette démarche à un jeu de patience, un solitaire chimique. Cette démarche procédant à partir des extrêmes et des éléments les plus légers le conduit en 1869 à énoncer la loi périodique : « Les propriétés des corps simples et composés dépendent d’une fonction périodique des poids atomiques des éléments pour la seule raison que ces propriétés sont elles-mêmes les propriétés des éléments dont ces corps dérivent » (Fig. 1).
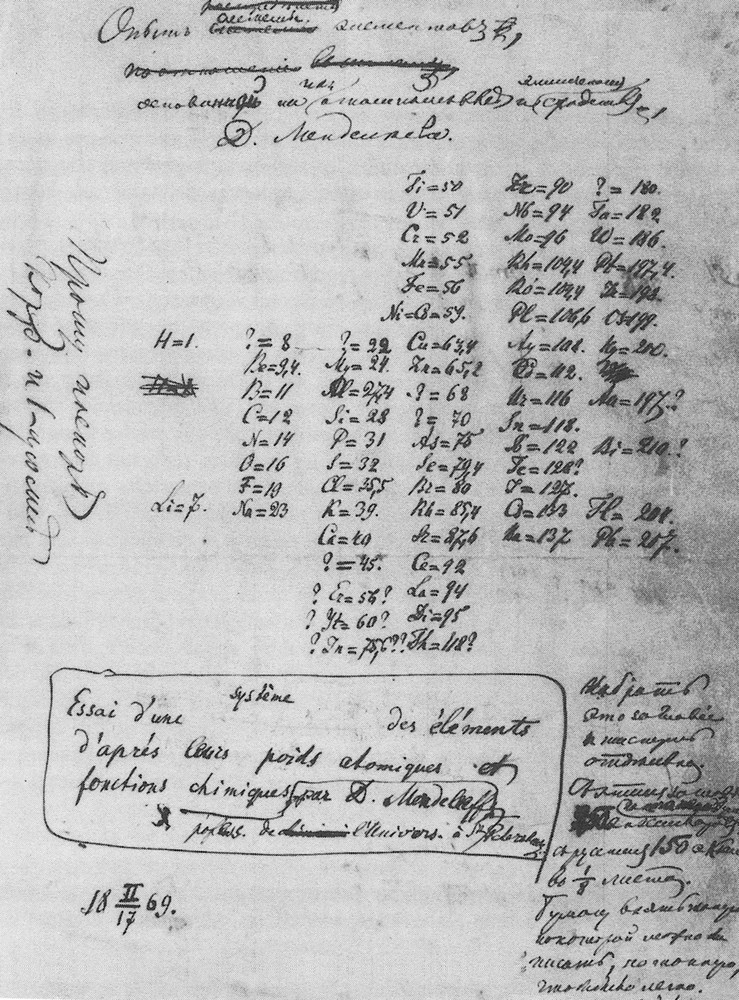
Manuscrit du tableau périodique par Mendeleev.
4 Les credo de Mendeleev
L’énoncé de la loi périodique engage trois postulats, solidaires les uns des autres.
Le premier est épistémologique : Mendeleev a foi dans la constance et la généralité des lois de la nature. À ses yeux, la science a pour objet de rechercher les lois auxquelles obéissent les phénomènes de la nature, d’en tirer toutes les conséquences et de se mettre en devoir de soumettre ces conséquences à l’épreuve de l’expérience. C’est pourquoi, dès qu’il entrevoit le motif de la périodicité, il met en œuvre toutes les conséquences possibles : prévision d’éléments inconnus, corrections de poids atomiques pour parvenir à énoncer une loi générale. D’où l’inversion du tellure et de l’iode, et les fameuses prédictions de l’eka-aluminium, de l’eka-bore, et de l’eka-silicium, pour lesquels il laisse des cases vides en donnant approximativement leur poids atomique et leurs propriétés. Mendeleev avoue certes que la loi périodique ne régit pas parfaitement les individualités, mais il estime qu’on trouvera la raison des écarts lorsqu’on connaîtra la cause de la loi périodique, qu’il espère trouver dans une mécanique chimique (en rêvant du Newton de la chimie !).
Le deuxième credo est philosophique. Mendeleev a foi dans l’individualité des éléments et considère leur pluralité comme irréductible. Il est très hostile à la recherche d’un élément originaire d’où dériveraient tous les autres. Il y voit la résurgence de l’ambition alchimique de transmutation des éléments. D’où ses protestations contre les multiples récupérations de la loi périodique au service de l’hypothèse de Prout. Pour Mendeleev, l’individualité des éléments chimiques est l’une des trois lois fondamentales qui gouvernent le monde.
« Kant pensait qu’il existe dans l’Univers deux objets qui provoquent l’admiration et la vénération des hommes : ‘la loi morale au dedans et le ciel stellaire ai dessus de nous’. En approfondissant la nature des éléments et la loi périodique, il faut ajouter une troisième objet : ‘la nature des individus élémentaires qui s’exprime partout autour de nous’, attendu que, sans ces individus, nous ne pourrions pas nous faire une idée du ciel stellaire et que la notion d ‘atomes révèle, à la fois la singularité des individualités, la réitération infinie des individus, et leur sujétion à l’ordre harmonique de la nature’ [9]. »
Une troisième décision – aussi fondamentale que négligée – concerne la définition claire et distincte de l’objet à classer. La plupart des devanciers de Mendeleev, s’appuyant sur la notion commune (consacrée par Lavoisier) d’élément chimique comme substance indécomposée, traitaient les notions de corps simples et d’éléments comme interchangeables. Mendeleev, en revanche, établit une distinction :
« Quels que soient les changements des propriétés des corps simples à l’état libre, quelque chose demeure constant, et quand les éléments forment des composés, ce quelque chose a une valeur matérielle et détermine les caractéristiques des composés qui comprennent les éléments en question. […] La valeur du poids atomique, par l’essence même de la matière, est un nombre qui n’est pas déterminé par l’état de division du corps simple mais par la partie matérielle qui est commune au corps simple et à ses composés. Le poids atomique n’appartient ni au charbon, ni au diamant mais au carbone [10]. »
La distinction entre élément et corps simple passait pour superflue dans une chimie de l’analyse, axée sur le va-et-vient entre simple et composé. Elle devient pertinente lorsqu’il s’agit de mettre de l’ordre, de trouver une loi générale qui permette de découvrir des analogies de comportement pour gérer multiplicité sans cesse croissante des corps simples. Quoiqu’elle paraisse assez intuitive, voire triviale, sur l’exemple du carbone connu à l’époque sous la forme de trois corps simples, cette distinction engage des hypothèses théoriques : elle est sous-tendue par l’hypothèse d’Avogadro qui distingue atomes et molécules. Le corps simple est à l’élément ce que la molécule est à l’atome. De là dérivent les définitions scolaires actuelles : un corps simple est un ensemble de molécules formées d’atomes de même espèce ; un corps composé est un ensemble de molécules formées d’atomes d’espèces différentes. Mendeleev procède à partir d’un réseau de concepts de base–atome/molécule, élément/corps simple. Il s’appuie sur la théorie atomique en vigueur dans la chimie de son époque, mais il estime que l’individualité réside dans les éléments chimiques plutôt qu’ailleurs. Comme la plupart de ses contemporains, y compris les champions de la notation atomique, Mendeleev ne se prononce pas sur la question de l’existence physique des atomes. Seule importe la distinction entre atomes et molécules. L’élément est relié à l’atome mais ne se confond pas avec lui. Atome et molécule sont des unités de structure de la matière en général. Mais l’élément est une entité individuelle abstraite, qui ne peut être saisie que par l’esprit. L’élément ne se voit pas, ne se touche pas, ne s’isole pas au terme d’une analyse en laboratoire comme le corps simple résidu d’analyse sur lequel Lavoisier avait bâti la chimie. Georges Urbain qui, avec Paneth [11], est l’un des rares chimistes à avoir réfléchi sur le statut de cette notion, lui prête un « caractère idéologique », au sens où ce n’est qu’une idée, une vue de l’esprit [12].
5 Les paris de Mendeleev
Mendeleev a donc choisi de situer l’explication de l’individualité des substances chimiques dans une notion éminemment abstraite, d’élément. C’est grâce à ce pas dans l’abstraction qu’il a pu prévoir des éléments inconnus. Les corps simples, eux, n’existent que pour autant qu’ils ont été isolés concrètement et ne peuvent donc faire l’objet de prévisions. Les prévisions de Mendeleev furent rapidement confirmées : en 1875 Lecoq de Boisbaudran isole le gallium qui prend la place de l’eka-aluminium ; en 1879 Nilsen découvre le scandium qui occupe la case laissée pour l’eka-bore ; enfin en 1886, Winkler isole l’eka-silicium baptisé germanium. Contrairement à ce qu’on pourrait croire, ces découvertes successives ont peut-être fait de Mendeleev une star internationale mais n’ont pas imposé le système périodique. En France, les manuels de chimie conservent la classification bâtarde mais commode avec sa division entre métaux et non-métaux jusqu’à la fin du siècle. Quelques chimistes présentent le système de Mendeleev dans leur cours surtout parce qu’il conforte leur choix de la notation atomique fondée sur la distinction entre atome et molécule. Mais ils ne considèrent pas pour autant le système de Mendeleev comme « la solution » au problème de la classification des éléments.
Mendeleev, qui a vécu jusqu’en 1906, réaffirme son pari sur les éléments et défend leur individualité face aux multiples découvertes susceptibles de l’ébranler. Un premier trouble provient de la multiplication des terres rares. Cinq seulement étaient connues en 1869 et Mendeleev avait bien du mal à les caser. Avec leurs masses atomiques et propriétés très voisines, les terres rares défient l’individualité prêtée aux éléments chimiques. Mendeleev se trouve fort embarrassé quand on en isole de nouvelles dans les années 1880-90 et ne sait où les disposer. Un deuxième choc plus sérieux provient de la découverte de l’hélium et de l’argon en 1895, deux éléments non prévus dont l’inertie chimique défie à nouveau l’individualité chère à Mendeleev. Lorsque William Ramsay et Lord Rayleigh leur attribuent un poids atomique He = 4 et A = 40, le système périodique se trouve en danger car il n’y a pas de place pour l’argon entre le potassium et le calcium. Mendeleev doute alors de l’élémentarité de l’argon et suggère que ce pourrait être une forme d’azote trivalent. Il n’accepte pas avec enthousiasme l’ouverture d’un nouveau groupe 0 proposée par Ramsay et Rayleigh. D’autant que cela introduit une nouvelle inversion de l’ordre des poids atomiques croissants entre l’argon et le potassium. Une entorse de plus à la généralité de la loi périodique !
Troisième défi : la découverte des électrons et de la radioactivité. Au retour d’une visite au laboratoire des Curie en 1900, Mendeleev tente une explication de la radioactivité pour sauver l’individualité des éléments. Il y parvient en faisant de l’éther – qui joue un rôle fondamental en électrodynamique – un élément chimique un peu spécial [13]. Fort de la confirmation de ses prévisions d’éléments inconnus, Mendeleev s’enhardit à prévoir l’existence d’un élément au poids atomique voisin de 0 (mais non impondérable) qui serait l’éther. Comme il est supposé chimiquement inerte, il le situe au sommet du groupe 0 en prévoyant l’existence d’un élément intermédiaire entre l’éther et l’hélium qu’il assimile au coronium (plus ou moins identifié par les spectrographes). Mendeleev fait alors l’hypothèse que le rayonnement radioactif pourrait être dû à un phénomène d’accumulation des atomes très légers d’éther autour des atomes les plus lourds qui provoquerait une perturbation locale dans le flux d’éther. L’enjeu est grandiose : il s’agit tout à la fois de sauver l’individualité des éléments en péril, de confirmer le rôle heuristique du tableau périodique, et d’unifier la mécanique, l’électrodynamique et la chimie.
6 Conclusion
Mendeleev ne fut pas prophète, il n’a pas anticipé la structure atomique, et il a refusé de sacrifier l’individualité des éléments chimiques, fondée sur leur poids atomique. Il n’est même pas le seul inventeur du système périodique dans la mesure où la construction des séries d’analogues et l’idée même de périodicité procèdent du travail collectif de nombreux chimistes.
Toutefois il n’est pas absurde de désigner le tableau périodique comme le « tableau de Mendeleev », bien que le tableau actuel ne ressemble guère au sien. Cette personnalisation se justifie non pas comme une marque de révérence à l’égard d’un génie qui aurait en quelque sorte « prophétisé » les découvertes du xxe siècle, mais parce qu’il a « élu » l’élément comme concept propre à ordonner la chimie. Un pari qui a été renouvelé au début du xxe siècle avec la découverte des isotopes qui prennent place dans la même case et réaffirment la prégnance de l’élément sur les variations de l’atome.
Ironie de l’histoire : c’est seulement lorsque change le critère de classement (du poids atomique au numéro atomique) que le système périodique de Mendeleev est unanimement adopté. Car en dépit des confirmations expérimentales des prévisions d’éléments inconnus dans les années 1880, le système périodique ne fit pas l’événement. D’une certaine manière le tableau de Mendeleev fut réinventé lors de la découverte des isotopes et il continue d’être réinventé par les chimistes, toujours en quête d’une classification parfaite. Loin, en effet, d’être un monument figé pour l’éternité, le tableau périodique a été sans cesse repensé, redessiné tout au long du xxe siècle. À l’occasion du centième anniversaire de la classification de Mendeleev, plus de 700 représentations graphiques différentes ont été répertoriées [14]… qui appellent, à leur tour, une classification des classifications.


