1. Introduction
La chiralité moléculaire est l’un des concepts les plus puissants du XXe siècle de par sa portée et ses applications [1], cette caractéristique de la nature intègre tous les processus régulateurs de développement et impacte un vaste domaine d’application : santé (médicaments et vitamines), agroalimentaire (arômes, additifs alimentaires), agronomie (contrôle des insectes, herbicides, fongicides), cosmétiques (parfums, produits de beauté). Les huiles essentielles, substances complexes volatiles, lipophiles, odoriférantes, sont riches de centaines de molécules organiques issues du métabolisme secondaire des plantes, elles sont particulièrement concernées par cette propriété de la nature. Ces molécules variées sont largement impliquées dans les interactions de la plante avec son environnement (protection, communication, réserve énergétique …). Leurs composants, essentiellement des terpènes (monoterpènes, sesquiterpènes, diterpènes) et leurs dérivés oxygénés (alcools, aldéhydes, esters, cétones, phénols …) sont majoritairement des molécules chirales [2, 3].
Le retour vers une consommation « naturelle » amène un nouvel élan au développement de produits à base de plantes [4], spécialement dans les industries de la beauté et du bien-être [5]. Le marché des huiles essentielles connaît une croissance importante, il a dépassé 7,51 milliards USD en 2018 et devrait parvenir à un taux de croissance annuel de 9% entre 2019 et 2026 [6]. Ces concentrés de plantes aromatiques affichent toutes les vertus : anti-inflammatoires, anti-infectieuses, immunomodulatrices, bronchodilatatrices, antivirales, anti-déprime, relaxantes. La demande de substances « naturelles » pour soulager des affections physiques et/ou psychologiques, s’est accentuée avec la pandémie de SARS-CoV-2, que ce soit, pour renforcer l’immunité, en intégration dans les protocoles de soin [7, 8] ou pour traiter l’anosmie souvent conséquente à la maladie [9, 10, 11]. La mise au point d’un protocole de stimulation olfactive [12, 13] à base d’huiles essentielles a permis à plus d’un tiers des hyposmiques de présenter un mieux-être et de retrouver leur odorat. Ces derniers mois, de nombreux travaux de recherche explorent le potentiel antiviral des huiles essentielles [14, 15, 16, 17, 18, 19, 20, 21, 22].
On doit l’origine de la chimie du chiral aux travaux de Louis Pasteur [23] sur la dissymétrie moléculaire, cependant, la littérature francophone de l’aromathérapie [24, 25, 26, 27, 28] n’intègre pas cet aspect structural des molécules, restreignant fortement la compréhension des mécanismes intervenant sur l’activité moléculaire. La classification chimique des huiles essentielles repose sur une approche basée sur un classement par groupes fonctionnels [29], avec une répartition générale un peu réductrice où le facteur d’attribution de l’activité thérapeutique est basé sur une fonction de la molécule (alcool, cétone, éther, ester, oxyde …). Ensuite, la précision du chimiotype (ou chemotype) permet de désigner l’entité chimique distincte prépondérante pour une même espèce végétale. Cette notion de race chimique [30] s’est imposée depuis 1975 et a été normalisée en 2006 au sein de l’Union Européenne avec l’adoption du règlement REACH.1 Depuis quelques années, de nombreuses insuffisances conceptuelles de la classification des familles moléculaires, en lien avec la stéréochimie des molécules sont signalées [31, 32], elles ciblent également l’efficacité et/ou la toxicité liée à certaines fonctions et la polyvalence des HE qui aurait plusieurs niveaux d’action en synergie.
Dans cette mise au point, le concept de la chiralité moléculaire, son importance et ses enjeux sont introduits, la configuration des principales molécules composant les HE est présentée en soulignant l’impact du profil stéréochimique sur l’activité biologique de quelques huiles essentielles. L’article est complété par la présentation de l’activité pharmacologique des énantiomères du linalol, une molécule chirale présente naturellement dans la quasi-totalité des huiles essentielles. Au-delà du chimiotype, l’importance de la signature chirale naturelle sera démontrée avec les configurations moléculaires précises et leurs implications sur l’activité biologique et les propriétés olfactives …Vers un énantiotype des huiles essentielles ?
2. La chiralité moléculaire, qu’est-ce que c’est ?
La chiralité vient du grec « kheir » qui signifie main, c’est la propriété d’un objet non superposable à son image dans un miroir, comme une main droite et une main gauche et qui se traduit par une absence de symétrie. L’image de la main droite dans un miroir correspond à la main gauche et réciproquement, cependant, les deux mains ne peuvent se superposer ou, plus simplement, un gant droit ne pourra être enfilé que par une main droite. De manière analogue, quand deux molécules en trois dimensions, symétriques par rapport à un axe sont dites chirales, cela se traduit par une absence de centre de symétrie ou de plan de symétrie (Figure 1).
Chiralité moléculaire.
La nature constitue le plus important réservoir chiral, ainsi, seule la (−)-morphine, isolée de pavot à opium (Papaver somniferum) [33] possède une activité analgésique, son isomère de synthèse (+) en est dépourvu, tous les acides 𝛼-aminés possèdent la même configuration (S) à l’exception de la cystéine, et, à l’état naturel, les sucres existent sous la forme d’un unique énantiomère. Par ailleurs, du fait de leur forme en hélice et aussi par leur composition, l’ADN et l’ARN sont des molécules chirales [34, 35].
Les deux formes d’une molécule chirale sont des énantiomères et peuvent avoir des activités biologiques très différentes car elles interagissent sur des récepteurs différents. Plusieurs cas de figure peuvent être rencontrés qui sont définis comme suit :
- l’eutomère ; c’est l’énantiomère dont l’activité biologique est la plus forte ou dont l’affinité relative de liaison à un récepteur biologique ou une enzyme est la meilleure.
- le distomere ; c’est l’énantiomère inactif, moins actif, ou possédant une activité tout autre que l’activité recherchée et/ou pouvant s’avérer porteur d’une toxicité différente.
2.1. Enantiomères et médicaments
Le phénomène est crucial pour les médicaments [36] avec des énantiomères d’activités biologiques très différents où l’un peut être bénéfique et l’autre très toxique (Figure 2). On peut citer la Dopa où l’énantiomère (S) soigne la maladie de Parkinson alors que l’énantiomère (R) est un poison, ou encore, l’Ethambutol, où l’énantiomère (S) est un anti-tuberculinique alors que l’énantiomère (R) cause la cécité. Un des plus gros scandales pharmaceutiques de tous les temps, est lié à l’affaire du Thalidomide qui fut à l’origine d’une prise de conscience de l’importance de la chiralité dans la toxicité des molécules présentes dans les médicaments. Prescrite aux femmes enceintes au début des années soixante pour soulager les nausées, le Thalidomide a défrayé la chronique en causant des ravages irréversibles sur le développement du fœtus. On estime entre 10 000 et 20 000 le nombre des victimes de ce médicament qui sont nées avec des malformations. En fait, seul l’énantiomère (R) est sédatif l’autre (S) est tératogène.
Activité biologique des énantiomères de médicaments.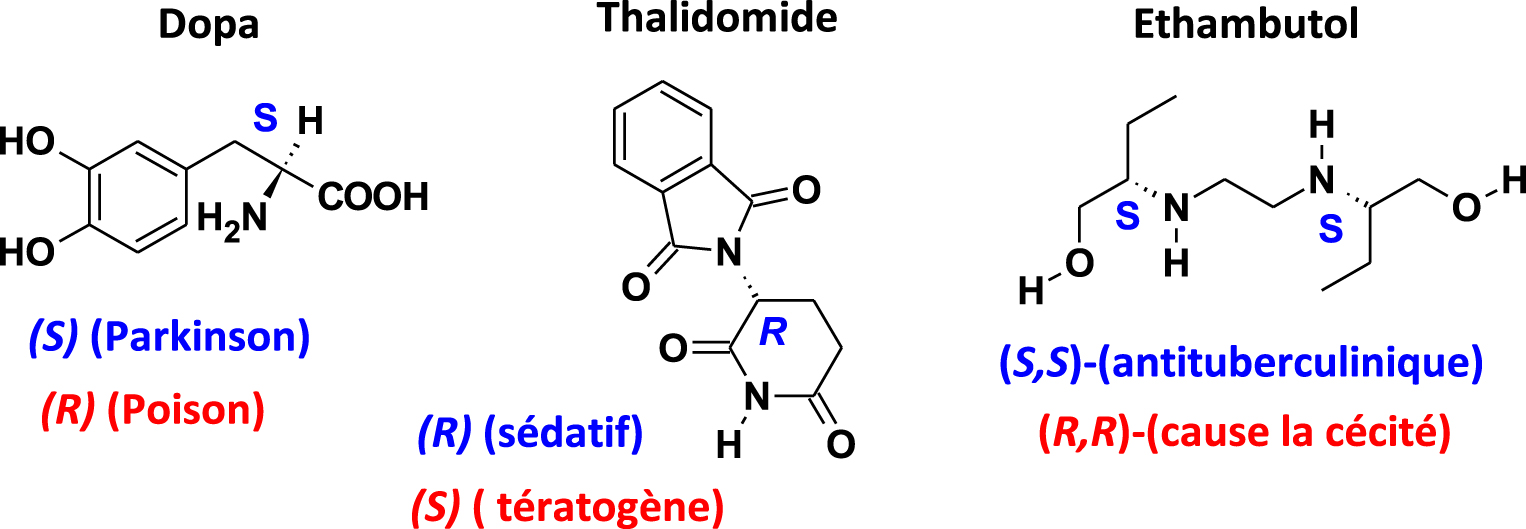
Depuis 1990, l’autorisation de mise sur le marché de nouveaux médicaments de synthèse est soumise à une réglementation très stricte [37, 38], l’activité de chacun des énantiomères d’une nouvelle molécule chirale doit être évaluée. Ces restrictions ont conduit à l’émergence de la chimie du chiral qui connaît un essor considérable, face à une chimie organique de synthèse traditionnelle qui produit des mélanges racémiques (deux énantiomères en égale quantité).
Aujourd’hui, on estime qu’environ 50% des médicaments possèdent une structure chirale et de nombreux principes actifs thérapeutiques présentant un ou plusieurs centres de chiralité sont aujourd’hui encore utilisés sous forme de mélanges racémiques. L’utilisation d’un énantiomère à la place du mélange racémique n’est intéressante que lorsque « l’autre » énantiomère influence défavorablement le rapport bénéfice-risque du mélange racémique. Les propriétés pharmacodynamiques et pharmacocinétiques des deux énantiomères doivent être évaluées. Pour cela, la séparation des premiers mg d’énantiomères purs pour réaliser les premiers tests d’activité et de toxicité est souvent réalisée par chromatographie sur support chiral [39, 40]. Les stratégies de synthèse d’un énantiomère unique interviennent dans un second temps si son activité est reconnue, pour y accéder selon le besoin par catalyse asymétrique ou par dédoublement de racémiques. Le développement de la catalyse asymétrique [41] qui consiste à utiliser un catalyseur chiral (complexe organométallique, biocatalyseur ou organocatalyseur), a permis de réaliser de nombreuses synthèses industrielles de médicaments énantiopurs. On constate un impact de « l’atropoisomérie », (chiralité de type axiale dû au blocage de la rotation autour d’une liaison simple) sur la découverte des médicaments ou des produits naturels [42, 43]. Ce type d’énantiomères présentent des caractéristiques intéressantes, montrant que la chiralité conformationnelle devrait être traitée avec autant d’intérêt que la chiralité centrée sur l’atome.
Cette année, la catalyse asymétrique est une nouvelle fois mise à l’honneur avec le Prix Nobel 2021 pour récompenser l’organocatalyse. Cet important champ de recherche, qui permet de créer des molécules droites et gauche en respectant les principes de chimie verte, avait déjà fait l’objet du Prix Nobel de chimie 2001 [44], via les catalyseurs organométalliques.
3. Reconnaître une molécule chirale
De manière simple, on peut dire qu’une molécule est chirale si elle présente au moins un centre d’asymétrie, qui est, le plus souvent, un atome de carbone (noté C*) lié à quatre atomes ou groupes d’atomes différents (Figure 3).
Centre de chiralité.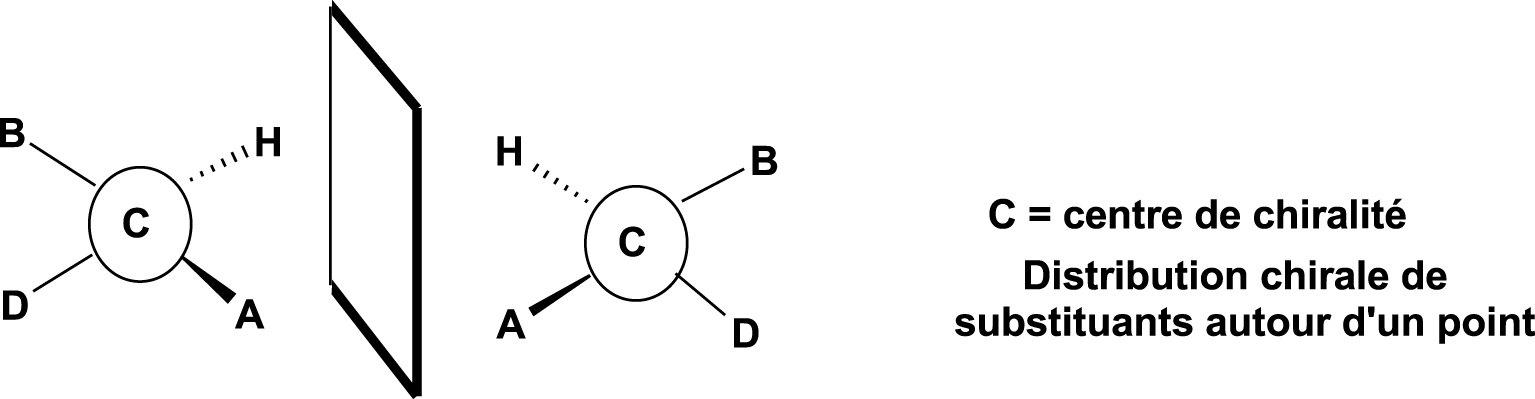
Une molécule possédant n C∗ peut exister au maximum sous 2n isomères stériques que l’on appelle des stéréoisomères, constitués d’énantiomères, de diastéréoisomères et d’isomères de conformation. Seuls les énantiomères sont images miroirs, contiennent des centres chiraux et ne sont pas superposables. Les diastéréoisomères sont des stéréoisomères qui ne sont pas des images miroirs, leurs propriétés physico-chimiques sont différentes (énergie potentielle, moment dipolaire, point de fusion, d’ébullition, indice de réfraction) [1].
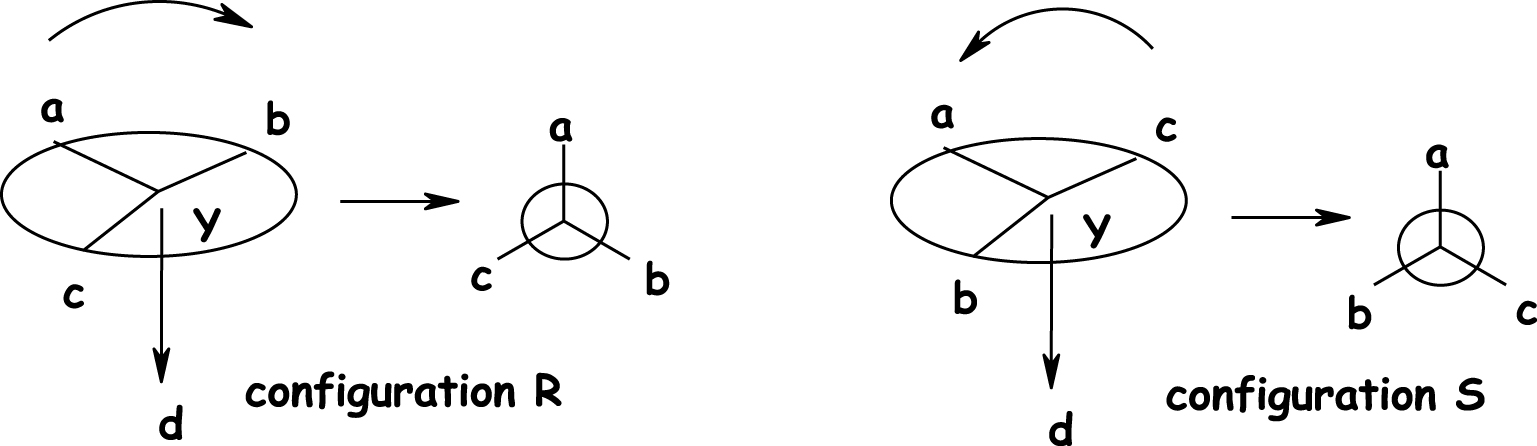
La nomenclature absolue de Cahn, Ingold et Prelog (CIP) [1] permet de désigner les énantiomères et de les nommer séparément. Cet arrangement spatial de la molécule, c’est la configuration absolue, elle repose sur un ensemble de règles de classement des quatre coordinats attachés au centre chiral, selon une séquence spécifique par ordre de priorité applicables à tous types de molécules, sur la base de critères définis. Les quatre substituants a, b, c, d du carbone asymétrique sont classés par ordre de priorité. En se plaçant dans l’axe de la liaison carbone — substituant minoritaire, on regarde le sens de rotation de la molécule en suivant l’ordre a > b > d ; si la molécule tourne vers la droite, la configuration est R (Rectus), si c’est vers la gauche la configuration est S (Sinister) (Figure 4). Avec des géométries spatiales opposées, ils interagissent différemment avec leur environnement. La chiralité centrale est l’élément stéréogène le plus fréquent, pourtant d’autres éléments induisent la chiralité moléculaire comme l’axe de chiralité (chiralité axiale), le plan de chiralité (chiralité planaire) ou encore l’hélicité (chiralité hélicoïdale).
4. Molécules chirales et activité biologique des huiles essentielles
Une même espèce de plante peut synthétiser des proportions variables de terpènes chiraux et les raisons de ce phénomène ne sont pas très claires, même si les conséquences de cette chiralité sont très importantes pour tous les organismes vivants. Les énantiomères d’une molécule chirale ne réagissent pas avec les mêmes récepteurs, eux même chiraux, n’induisant pas nécessairement la même activité biologique, et cette propriété est d’une importance fondamentale [45]. C’est un élément déterminant dans le contrôle de la naturalité des huiles essentielles et pour la détection de contrefaçons.
En olfaction, par exemple, c’est la liaison de la molécule odorante chirale avec le récepteur chiral qui déclenchera la série d’événements moléculaires qui constituent la transduction du signal sensitif par la cellule sensorielle et in fine la reconnaissance par le cerveau de l’odeur caractéristique [46]. L’odorat est devenu un axe de recherche central depuis la découverte de la plus grande famille de gènes impliquée dans la production de protéines capables de détecter des odeurs qui a été récompensée par le Prix Nobel 2004 de Médecine [47]. Ces travaux montrent que chaque récepteur olfactif est activé spécifiquement par les caractéristiques structurales des molécules.
Ainsi, le seuil de détection olfactif peut différer fortement entre deux énantiomères d’une même molécule [48]. C’est le cas par exemple, du limonène, de la carvone ou du linalol présents en abondance dans les huiles essentielles d’agrumes. Leurs énantiomères ont des fragrances très différentes, le (S)-(−)-Limonène a l’odeur de citron alors que le (R)-(+)-Limonène sent l’orange ; l’énantiomère (R)-(−)-Carvone sent la menthe verte alors que le (S)-(+)-Carvone sent le cumin. Pour les énantiomères du linalol, le (S)-(+)-Linalol a une odeur douce, florale, aux fragrances d’agrumes et le (R)-(−)-Linalol a un arôme boisé rappelant la lavande (Figure 5). Par ailleurs, très fréquemment, le nez humain ne détecte pas de la même façon deux énantiomères. Pour la forme (R)-Linalol, sa une note fleurie puissante est perçue dès la concentration de 0,8 ppb,2 alors qu’il faut atteindre 7,4 ppb pour apprécier la senteur beaucoup moins intense de la forme (S)-Linalol [49].
Arômes des énantiomères limonène, carvone et linalol.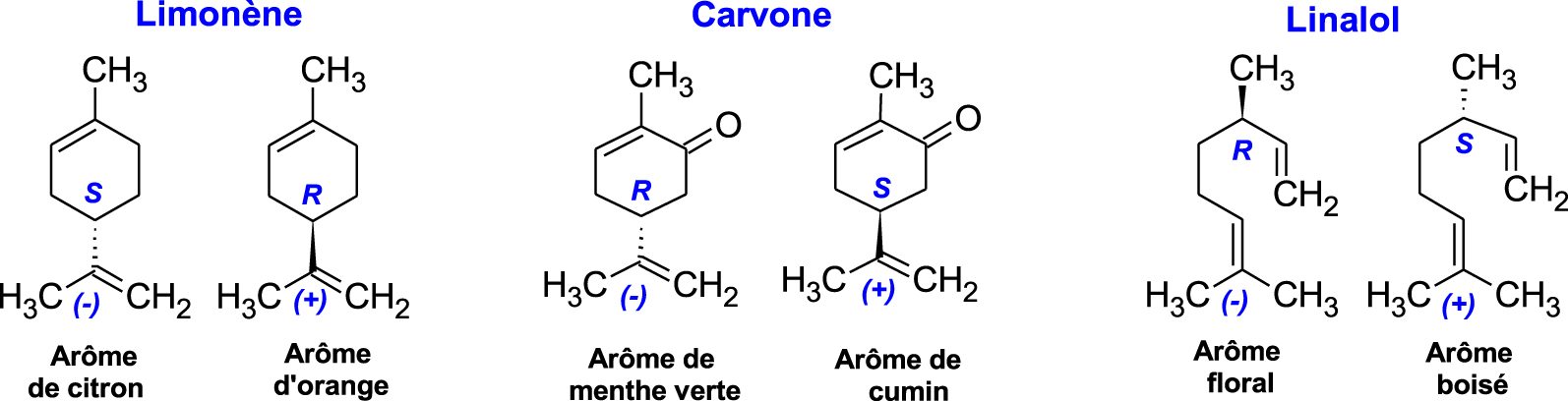
Avec trois carbones asymétriques (3C∗) dans la molécule, la famille des menthes compte 8 stéréoisomères (23). Dans la nature, le plus courant est l’énantiomère (1R,2S,5R)-(−)-Menthol,[(1R,2S,5R)-5-méthyl-2-(propan-2-yl)cyclohexanol], c’est le seul qui possède les propriétés anti-inflammatoires, antivirales, anesthésiques, pesticides et désinfectantes ; il appartient à la famille des monoterpénols et se trouve naturellement dans l’HE de menthe poivrée (Mentha piperita). Le menthol japonais contient également un léger pourcentage de (+)-Néomenthol [(1S,2S,5R)-2-Isopropyl-5-methylcyclohexanol] (Figure 6). L’analyse chirale d’échantillons d’huile essentielle montrant la présence de l’énantiomère (1S,2SR,5S)-(+)-Menthol est une preuve d’adultération.
Diastéréoisomères et énantiomères dans la famille des menthes.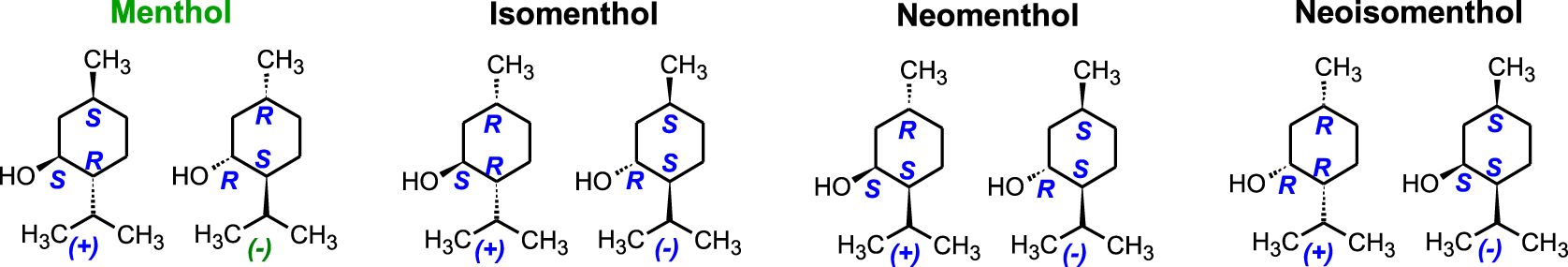
L’exemple de l’HE de rose, l’une des plus précieuses de l’aromathérapie, très appréciée par les parfumeurs, est particulièrement intéressant. Parmi ses principales composants on trouve le citronellol [3,7-dimethyloct-6-en-1-ol] et les oxydes de rose [4-methyl-2-(2-methylprop-1-enyl)oxane] qui ont des profils énantiomériques très spécifiques [50]. L’oxyde de rose, molécule star de nombreux parfums prestigieux, possède plusieurs diastéréoisomères dus à une isomérie endo/exo (position du substituant sur/sous le cycle) et à la présence de deux carbones asymétriques (Figure 7).
Diastéréoisomères et énantiomères des composants de l’HE de rose.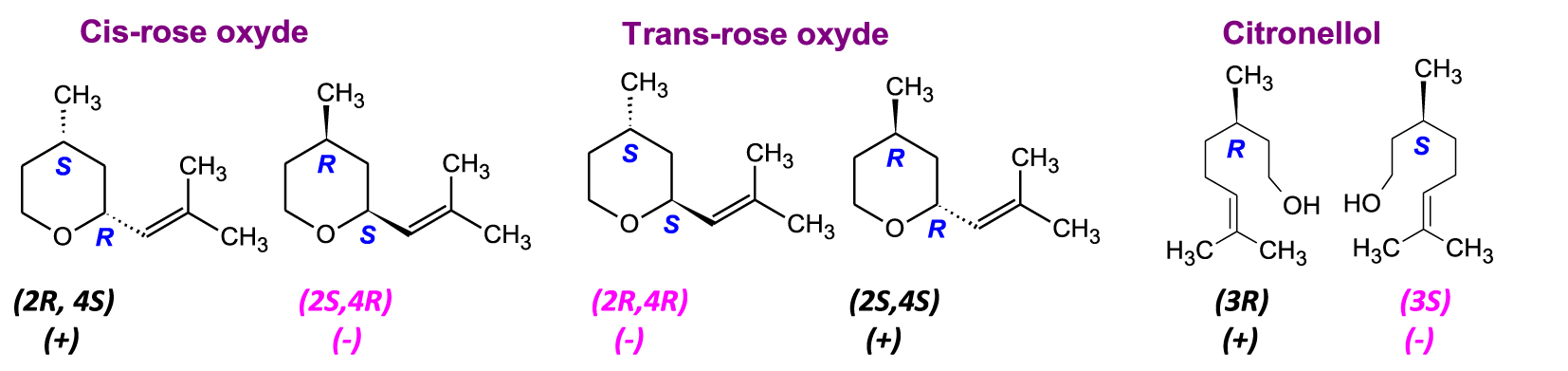
L’autre composant principal de l’huile de rose qui mérite d’être cité est le citronellol, présent à plus de 50% sous sa forme énantiomérique (S)-(−)-Citronellol. Son odeur florale de rose rappelle celle de l’huile de géranium alors que l’arôme du (R)-(+)-Citronellol est semblable à l’huile de citronnelle. Leurs seuils olfactifs sont proches entre 40–50 ppb pour l’énantiomère (S) et 50 ppb pour le (R) [51, 52].
Dans l’HE de rose de Bulgarie et de Turquie, les énantiomères lévogyres (2S,4R)-(−)-cis-oxyde de rose et (2R,4R)-(−)-trans-oxyde de rose sont retrouvés avec une pureté énantiomérique élevée (>99,5%) [53, 54], la présence des énantiomères (+)-cis et (+)-trans-oxydes de rose permet une identification « non naturelle » de cette huile essentielle. A l’inverse, les deux énantiomères dextrogyres (2R,4S)-(+)-cis-oxyde de rose et (2S,4S)-(+)-trans-oxyde de rose sont détectés avec une haute pureté énantiomérique dans l’HE de Mélisse officinale (Melissa officinalis) et s’avèrent être des indicateurs d’authenticité de cette huile essentielle. Les arômes et les seuils olfactifs de ces quatre énantiomères [55, 56, 57] sont intéressants, ils sont décrits comme suit :
- (4R,2S)-(−)-cis-oxyde de rose possède une note vert floral nette, légère, rose verte, diffusive, forte, il a été décrit comme puissant fruité, son seuil olfactif de 0,5 ppb est très faible, c’est le seul énantiomère responsable du parfum typique de la rose.
- (4S,2R)-(+)-cis-oxyde de rose, avec une note florale, vert foin, terreux, lourd et un seuil olfactif de 50 ppb est inodore.
- (4R,2R)-(−)-trans-oxyde de rose a une note verte, mentholée, fruitée, son seuil olfactif est de 160 ppb.
- (4S,2S)-(+)-trans-oxyde de rose, avec une note verte végétale, florale fruitée, rose aux herbes, agrumes (écorce amère), son seuil olfactif est de 80 ppb.
La perception des arômes est un mécanisme très complexe qui intègre de nombreux facteurs tels que la structure moléculaire, la concentration, le milieu de libération, le mécanisme d’olfaction mais également les différences génétiques dans l’expression des récepteurs d’odeur. La bibliographie scientifique est très riche sur la relation structure-odeur des molécules chirales [58, 59, 60, 61, 62, 63, 64, 65, 66, 67] et sur l’impact de la configuration absolue sur le seuil d’olfaction des énantiomères. L’exemple le plus marquant est celui de la Nootkatone [68, 69], une cétone sesquiterpénoïde dont l’énantiomère dextrogyre (4R,4aS,6R)-(+)-Nootkatone possède une forte odeur de pamplemousse et un seuil olfactif de 800 ppb, tandis que l’énantiomère lévogyre (4S,4aR,6S)-(−)-Nootkatone a une senteur fortement fraîche, verte, boisée, épicée et un seuil olfactif de 600 000 ppb soit 750 fois supérieur !
La composition énantiomérique des molécules d’une HE constitue sa carte d’identité, elle permet de préciser son origine et son activité biologique. La majorité des molécules composant les HE existent sous la forme d’un énantiomère majoritaire ou parfois en mélange des deux. Pour une même espèce de plante, il existe dans la nature une forte variabilité énantiomérique de la concentration des constituants des HE due à divers facteurs tels que l’environnement, les facteurs génétiques, les conditions de croissance, de récolte et les techniques de distillation. La chiralité est un aspect fondamental de la nature, même si le phénomène est complexe et parfois difficile à identifier [70].
5. Structure des principales molécules chirales composant les huiles essentielles
La classification des HE par famille biochimique constitue un préalable pour comprendre leurs propriétés thérapeutiques et les utiliser au mieux en toute sécurité. La chimie seule ne suffit pas pour expliquer l’ensemble des propriétés, ni toutes les toxicités potentielles des HE. L’activité biochimique des molécules principales étudiées individuellement contribue à clarifier l’action thérapeutique notamment selon les énantiomères majoritaires pour lesquelles la reconnaissance avec un substrat se fait sur la base du modèle clef-serrure. Cependant, l’action de l’HE recueillie dans son intégralité après une distillation douce, complète, non fractionnée, s’avère souvent plus importante et peut différer de celle des principes actifs pris isolément.
Les principales molécules chimiques composant les HE sont des hydrocarbures terpéniques et sesquiterpéniques, alcools et esters, aldéhydes, cétones, phénols, éthers et peroxydes ; la majorité de ces molécules sont chirales et existent sous forme d’énantiomères ou de diastéréoisomères. Nous présenterons les formes énantiomères de quelques molécules chirales importantes composant les hydrocarbures terpéniques et sesquiterpéniques les plus fréquemment retrouvées dans les HE (Tableau 1).
Hydrocarbures terpéniques et sesquiterpéniques et leurs chiralités
| Acycliques | Nba | Monocycliques | Nb | Bicycliques | Nb | |
|---|---|---|---|---|---|---|
| C∗ | C∗ | C∗ | ||||
| Monoterpènes et monoterpénoides | Acétate de linalyle | 1 | 𝛼-terpinéol | 1 | Sabinène | 2 |
| Acétate de lavandulyle | 1 | Terpinène-4-ol | 1 | 𝛼-pinène | 2 | |
| Carvone | 1 | 𝛽-pinène | 2 | |||
| Camphre | 2 | |||||
| Camphène | 2 | |||||
| Sesquiterpènes et sesquiterpénoides | (Z),(E)-Nérolidol | 1 | Germacrène D | 1 | (E)-𝛽-caryophyllène | 2 |
a Nombre de C∗: carbone asymétrique dans la molécule.
La stéréochimie des énantiomères de l’ensemble des structures moléculaires du Tableau 1 est détaillées dans la Figure 8. Pour les molécules ayant un seul carbone asymétrique, les deux formes énantiomères sont représentées avec : 𝛼-terpinéol, terpinène-4-ol, carvone, acétate de lavandulyle, acétate de linalyle, germacrène D. Dans le cas des molécules avec deux carbones asymétriques ; quatre stéréo-isomères sont possibles, parfois moins, en cas de pont dans la molécule. En effet, la géométrie d’un des atomes de carbone fixe celle de l’autre carbone et on aura uniquement deux énantiomères, c’est le cas pour : camphre, camphène, 𝛼-pinène, 𝛽-pinène, sabinène.
Eléments de chiralité des structures terpéniques et sesquiterpéniques.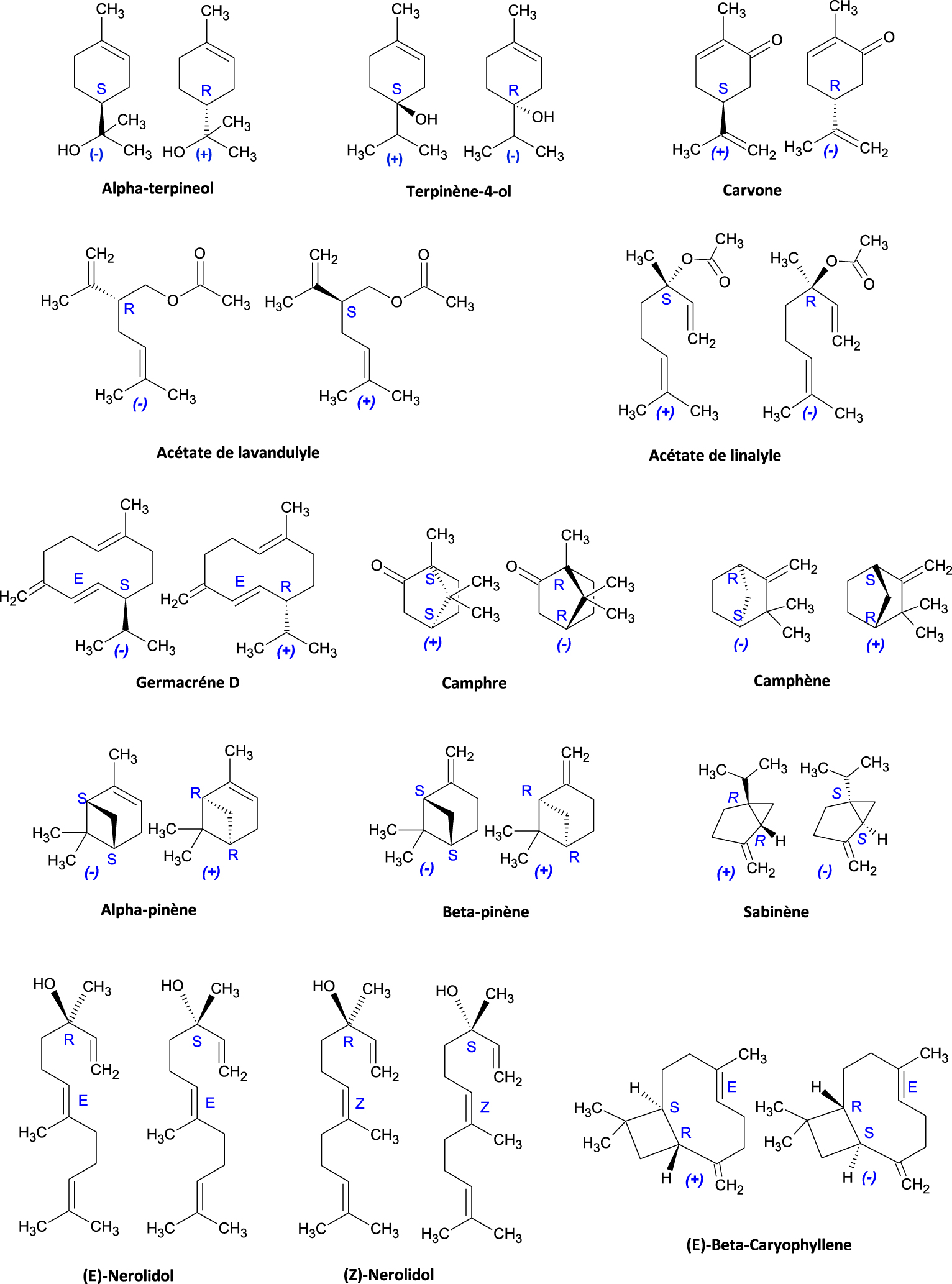
En plus de leur carbone asymétrique, le Nérolidol et le 𝛽-caryophyllène ont une double liaison (oléfines) avec des conformations Z∕E (cis/trans), éléments stéréogènes non chirotopes ; cela donne quatre stéréoisomères possibles pour (Z,E)-Nérolidol, dont deux paires d’énantiomères [(E)-(R), (E)-(S)] et [(Z)-(R), (Z)-(S)]. Dans le cas du 𝛽-caryophyllène, seuls les deux énantiomères de la forme E (ou trans) sont présentés (Figure 8).
6. Profil énantiomérique de quelques huiles essentielles
Même si la composition des HE est largement déterminée par la génétique, les facteurs climatiques, géographiques et saisonniers [71], il est admis qu’à partir d’une source spécifique et dans les mêmes conditions de traitement la composition énantiomérique des molécules principales d’une HE subira peu de variations, permettant de vérifier son authenticité. Certaines espèces produisent les molécules sous forme d’un énantiomère unique alors que d’autres produisent les deux, soit en mélanges enrichis en l’un ou l’autre des énantiomères ou encore sous forme racémique (les deux énantiomères 50/50).
Le Tableau 2 réunit le profil énantiomérique de quelques huiles essentielles choisies qui incluent les molécules chirales présentées précédemment comme : l’arbre à thé, la menthe verte, la lavande fine, la lavande aspic, le lavandin, le néroli, le petit grain bigarade, l’orange amère, l’orange douce, le citron, et la sauge sclarée. La distribution énantiomérique de chaque HE est limitée aux 3 ou 4 molécules chirales principales dont l’abondance est >1% et aux molécules ayant un intérêt d’authentification (<1%) ; les molécules non chirales seront également citées. Les structures des énantiomères des divers hydrocarbures terpéniques et sesquiterpéniques concernés sont représentées en Figure 8 et l’impact de la chiralité des molécules sur l’activité biologique de l’HE est signalée.
L’analyse du Tableau 2 montre que toutes les huiles essentielles décrites sont majoritairement composées de molécules chirales avec des profils énantiomériques constitués d’un énantiomère très majoritaire.
L’huile essentielle d’arbre à thé (Melaleuca alternifolia) est la première dont le profil énantiomérique est désormais imposé par la réglementation, elle a longtemps fait l’objet d’adultérations récurrentes, soit par mélange avec d’autre HE (pin, eucalyptus globulus, camphre …) ou par l’ajout de composants adultérants [72]. Cette huile essentielle peut présenter jusqu’à sept chimiotypes différents [73, 74], pourtant, c’est le type terpinène-4-ol auquel on attribue les meilleures qualités thérapeutiques, qui a fait l’objet d’études sur sa sécurité [75, 76].
La version de la norme ISO 4730:2004 pour ce chimiotype établissait un minimum de 35% Terpinène-4-ol, 14% de 𝛾-Terpinène et 6% de 𝛼-Terpinène [77]. La nouvelle version, l’ISO 4730:2017, est plus stricte, elle intègre une analyse énantiomérique chirale par chromatrographie gazeuse avec des rapports d’énantiomères de (+)-Terpinène-4-ol/(−)-Terpinène-4-ol qui varient entre 63,3-69,8/36,7-30,2 et pour le (+)-𝛼-Terpinéol/(−)-𝛼-Terpinéol entre 74,2–79,5/25,8–20,5 dans l’authentique HE d’arbre à thé [78]. Ce profil énantiomérique permet de détecter les adultérations les plus fréquentes de cette HE (Tableau 2, entrée 1).
Dans l’HE de menthe verte (Mentha spicata var. crispa), l’énantiomère (R)-(−)-Carvone, présent à plus de 87%, a un effet antispasmodique plus puissant que la (S)-(+)-Carvone. Ces effets, décrits à la fois pour la (R)-(−)-Carvone et l’huile de menthe verte sont expliqués comme un mode d’action de type CCB [79] (Inhibiteurs des canaux calciques). Le (S)-(−)-Limonène y est présent à 98,8% et les données pharmacologiques indiquent que cet énantiomère pourrait également être utilisé en aromathérapie comme agent anxiolytique [80].
Profil énantiomérique des composants majoritaires de quelques HE
| Huile essentielle | Molécules principales | %a | Profil énantiomérique des composants chiraux majoritaires | %b |
|---|---|---|---|---|
| Arbre à thé [81, 82] (Melaleuca alternifolia) | Terpinène-4-ol | 30–48 | (S)-(+)-Terpinène-4-ol | 74,2–79,5 |
| 𝛾-Terpinène | 10–28 | Non chirale | — | |
| 𝛼-Terpinène | 5,0–13 | Non chirale | — | |
| 𝛼-Terpinéol | 1.5–8.0 | (R)-(+)-𝛼-Terpinéol | 63,3–69,8 | |
| 𝛼-Pinène | 1.5–6 | (R,R)-(+)-𝛼-Pinène | 86–91 | |
| Menthe verte [83, 84, 85] (Mentha spicata) | Carvone | >40 | (R)-(−)-Carvone | 87,9 |
| Limonène | >20 | (S)-(−)-Limonene | 98,8 | |
| 1,8-Cinéole | 17 | Non chirale | — | |
| 𝛽-Pinène | >2 | (S,S)-(−)-𝛽-Pinène | >52.1 | |
| Lavande fine [86] (Lavandula angustifolia) | Acétate de linalyle | 37–48 | (R)-(−)-Acétate de linalyle | >99 |
| Linalol | 19–32 | (R)-(−)-Linalol | >98 | |
| 𝛽-Caryophyllène | 3,7–6,3 | (R,S)-(−)-(E)-𝛽-Caryophyllène | >99 | |
| Acétate de lavandulylea | 2–11 | (R)-(−)-Acétate de lavandulyle | >99 | |
| Lavande aspic [87] (Lavandula latifolia) | Linalol | 34–50 | (R)-(−)-Linalol | 95 |
| 1,8-Cinéole | 16–39 | Non chirale | — | |
| Camphre | 8–16 | (R,R)-(+)-Camphre | 95 | |
| 𝛼-Terpinéol | 0,2–2 | (R)-(+)-𝛼-Terpinéol | 56 | |
| Limonène | 0,5–3 | (R)-(+)-Limonène | 95 | |
| Lavandin abrial [86] (Lavandula hybrida var. abrial) | Linalol | 33–41 | (R)-(−)-Linalol | >95 |
| Acétate de Linalyle | 23–32 | (R)-(−)-acétate de Linalyle | >95 | |
| Camphre | 9–11 | (R,R)-(+)-Camphre | >99 | |
| 1,8-Cinéole | 6–10 | Non chirale | — | |
| (E)-𝛽-Caryophyllène | 1–2 | (R,S)-(−)-(E)-𝛽-Caryophyllène | >95 | |
| Néroli [88, 89] (Citrus aurantium var. amara) fleurs | Linalol | 43–54 | (R)-(−)-Linalol | >70 |
| Limonène | 6–10 | (R)-(+)-Limonène | >95 | |
| Acétate de linalyle | 3,5–8,6 | (R)-(−)-Acétate de Linalyle | >95 | |
| E-Nérolidol | 2–6 | (S)-(+)-(E)-Nérolidol | >98 | |
| 𝛽-Pinène | 3–5 | (S,S)-(−)-𝛽-Pinène | >99 | |
| Petit grain bigarade [88, 89] (Citrus aurantium amara) feuilles | Acétate de linalyle | 40–80 | (R)-(−)-Acétate de linalyle | >97 |
| Linalol | 15–35 | (R)-(−)-Linalol | >80 | |
| 𝛼-Terpinéol | 3–10 | (R)-(+)-𝛼-Terpinéol | >72 | |
| Orange amère [90, 91] (Citrus aurantium L var. amara) fruits | Limonène | 91–96 | (R)-(+)-limonène | >99 |
| 𝛼-terpinéol | <3 | (R)-(+)-𝛼-terpinéol | >93 | |
| Acétate de linalyle | <1,5 | (R)-(−)-Acétate de linalyle | >99 | |
| 𝛽-Myrcène | 1–2 | Non chirale | — | |
| 𝛼-Pinène | <1 | (R,R)-(+)-𝛼-Pinène | >89 | |
| Linalol | <1 | (R)-(−)-Linalol | >89 | |
| Orange douce [92, 93, 94] (Citrus sinensis L.) | Limonène | >96 | (R)-(+)-Limonène | >99 |
| Linalol | <1 | (S)-(+)-Linalol | >87 | |
| 𝛽-Myrcène | Non chirale | — | ||
| 𝛼-Pinène | <1 | (R,R)-(+)-𝛼-Pinène | >99 | |
| Citron [95, 91] (Citrus limon) | Limonène | 60–70 | (R)-(+)-Limonène | >98 |
| 𝛽-Pinène | 10–19 | (S,S)-(−)-𝛽-Pinène | >93 | |
| 𝛾-Terpinène | 7–9 | Non chirale | — | |
| Sabinène | 1,4–2,3 | (S,S)-(−)-Sabinène | >85 | |
| 𝛼-Pinène | 1,5–1,9 | (S,S)-(−)-𝛼-Pinène | >68 | |
| Sauge Sclarée [96] (Salvia sclarea) | Acétate de linalyle | 46,6 | (R)-(−)-Acétate de linalyle | >99 |
| Linalol | 17,1 | (R)-(−)-Linalol | >72 | |
| Germacrene D | 11,8 | (S)-(−)-Germacrène D | 99,8 | |
| (E)-ß-Caryophyllene | 4,9 | np | — |
a Pourcentage des composants majoritaires. b Pourcentage en énantiomère majoritaire (pour HE d’arbre à thé ce sont les marges en énantiomère majoritaire exigées par la norme ISO 4730:2017). np: non précisé.
La distribution énantiomérique des HE de lavande est intéressante, les énantiomères (R)-(−)-Acétate de linalyle et (R)-(−)-Linalol prédominent dans la lavande fine et le lavandin hybride avec un excès énantiomérique >95%. Pour la lavande aspic, le (R)-(−)-Linalol est également majoritaire à 95% avec un énantiomère (R,R)-(+)-Camphre présent à 95%. Ces marqueurs moléculaires peuvent être utilisés pour l’authenticité de ces huiles essentielles. Le lavandin abrial issu de l’hybridation naturelle entre la lavande vraie et la lavande aspic possède une composition équilibrée, avec des profils énantiomériques également élevés, analogues à ceux de la lavande vraie (esters) et de la lavande aspic (camphre).
Le genre Citrus est parmi les huiles essentielles naturelles les plus populaires et représente la plus grande partie des arômes naturels commerciaux et parfums [97] et les profils énantiomériques des citrus présentés dans le Tableau 2 sont intéressants.
Les huiles de néroli (Citrus aurantium amara leaf) et de petit grain bigarade (Citrus aurantium ssp. aurantium (fe)) [88, 89] sont produites à partir de parties morphologiques différentes du Bigaradier, l’huile de néroli est issue de la distillation des fleurs fraîches et l’huile de petit grain de la distillation des feuilles et brindilles. On constate pourtant des différences dans la distribution des énantiomères des molécules d’𝛼-pinène et du limonène entre ces deux HE et également avec l’huile essentielle d’orange amère (Citrus aurantium L var. amara), issue du zeste du fruit du même arbre.
L’huile de néroli est riche en (S,S)-(−)-𝛼-Pinène alors que dans l’huile de petit grain c’est le (R,R)-(+)-𝛼-Pinène qui domine. Le (R)-(+)-Limonène est l’énantiomère dominant dans les deux huiles même si dans l’huile de néroli on trouve le (S)-(−)-Limonène en plus faible quantité que dans l’huile de petit grain. Le (S)-(−)-𝛽-Pinène est retrouvé dans les deux huiles avec une pureté énantiomérique élevée.
L’énantiomère (S)-(+)-(E)-Nérolidol est présent entre 2–6% avec une haute pureté énantiomérique (>98%) dans l’HE de néroli ; c’est un composé sensoriel important qui impacte les propriétés olfactives (doux, léger, fleuri) et un indicateur d’authenticité de cette HE [88, 89]. Les propriétés olfactives de ses autres stéréoisomères ont des caractéristiques différentes qui sont répertoriées [98] ; le R-(−)-(E)-Nérolidol a une odeur agréable, boisée, chaude, de moisi ; pour le conformère (S)-(+)-(Z)-Nérolidol c’est une odeur d’écorce ligneuse, verte et fraîche ; et celle du (R)-(−)-(Z)-Nérolidol est intense, fleurie, douce et fraîche.
L’huile essentielle d’orange amère (Citrus aurantium L var. amara), issue du zeste du fruit du bigaradier présente un excès énantiomérique très élevé pour trois composants, le (R)-(+)-Limonène (>99%), (R,R)-(+)-𝛼-pinène avec ee > 92 %, (S)-(−)-𝛽-Pinène avec ee > 97 %. On retrouve le (R)-(+)-Limonène comme énantiomère unique (>99%), dans l’orange douce (Citrus sinensis), le citron (Citrus limon) ainsi que dans le Neroli (>95%).
Le linalol y est présent (<1%) sous des formes d’énantiomères différents dans les HE d’orange douce et d’orange amère. Dans l’orange douce, le (S)-(+)-Linalol est présent à plus de 82% alors que dans l’orange amère c’est le (R)-(−)-Linalol à plus 89%. Le ratio des énantiomères du linalol permet de déterminer des fraudes par l’ajout d’HE d’orange douce, moins précieuse, à l’HE d’orange amère plus chère [91].
De nombreux travaux attestent des propriétés relaxantes des HE d’agrumes pour leur richesse en (R)-(+)-Limonène. L’orange amère (Citrus aurantium L var. amara) soulage l’anxiété chez les patients après administration ou inhalation [99, 100]. L’inhalation d’huile d’orange douce (Citrus sinensis) réduit le niveau d’anxiété et améliore l’humeur des malades chez les dentistes [101]. L’étude de l’activité biologique du limonène sur le système nerveux autonome humain montre que l’inhalation du (R)-(+)-Limonène a un effet sur l’élévation de la tension artérielle systolique, la vigilance et la nervosité, alors que le (S)-(−)-Limonène n’augmente que la tension artérielle systolique et n’a pas aucun effet sur d’autres paramètres psychologiques [102].
L’HE de sauge sclarée, composée majoritairement des énantiomères (R)-(−)-Acétate de linalyle (>99%) et (R)-(−)-linalol (>72%) apporte notamment un effet spasmolytique et sédatif [103] qui pourrait être un agent thérapeutique pour les patients souffrant de dépression.
On peut constater que le profil énantiomérique des huiles essentielles est lié à une activité pharmacologique spécifique différenciée selon les énantiomères, qui conforte l’importance de l’identification du profil énantiomérique des HE.
7. Analyse chirale et identification des huiles essentielles
L’identification et la quantification des composants chimiques des HE sont fondamentales et les difficultés d’analyses déjà complexes sont significativement accrues en présence d’une discrimination chirale. Les énantiomères possèdent des propriétés physico-chimiques identiques, mêmes masses moléculaires, mêmes solubilités, mêmes points de fusion et d’ébullition, ce qui les rend difficiles à séparer et à identifier. Les énantiomères se différencient par leur comportement vis-à-vis de la lumière polarisée, l’un la dévie vers la droite et l’autre vers la gauche. D’ailleurs, le pouvoir rotatoire global de l’HE a longtemps été le seul élément, de la fiche technique, permettant une évaluation de la qualité chirale globale.
Pour garantir l’authenticité des lots d’huile essentielle et en déterminer les propriétés thérapeutiques, deux catégories de contrôles sont exigés :
(1) Caractéristiques physico-chimiques incluant les contrôles organoleptiques et les constantes physiques :
- Contrôles organoleptiques : à partir d’une aromathèque, constituée d’huiles essentielles certifiées, on contrôle la couleur, l’odeur et dans certains cas, la saveur des huiles essentielles analysées.
- Étude des constantes physiques à température donnée : densité, solubilité dans l’alcool, points de fusion et d’ébullition, points de congélation, pouvoir rotatoire sur la lumière polarisée, indice de réfraction.
(2) Méthodes d’identification chromatographiques, chiroptiques et spectroscopiques :
Les différentes approches combinant la séparation chromatographique et des méthodes permettent d’évaluer les excès énantiomériques des molécules chirales pour parvenir à une identification précise [104, 105, 106, 107] comme :
- Techniques chiroptiques : Polarimétrie, dispersion optique rotatoire, dichroïsme circulaire.
- Analyses isotopiques : permettent de tracer l’origine par la mesure de la distribution isotopique dans les composés naturels (rapports 13C/14C , teneur en 14C ou 18O/17O).
- Sectroscopies Infra-rouge et la Résonance Magnétique Nucléaire à haute résolution (400–700 MHz et multinoyaux) avec agents de déplacement chiraux.
- Diffraction de rayons X.
7.1. Analyse chromatographique chirale
L’analyse chromatographique chirale met à profit le très haut pouvoir de résolution de la chromatographie pour la séparation des énantiomères en utilisant des phases stationnaires chirales (PSC) synthétiques très performantes utilisées en phase gazeuse, liquide ou supercritique. C’est la méthode la plus utilisée pour évaluer l’excès énantiomérique des principales molécules des HE. Le mécanisme de reconnaissance sur une phase stationnaire chirale est basé sur les différentes forces d’interactions des énantiomères avec un sélecteur chiral fixé sur une phase stationnaire permettant la formation de complexes diastéréoisomères élués à des vitesses différentes en impliquant souvent plusieurs techniques complémentaires.
La difficulté de séparer des mélanges aussi complexes que les HE a mené les chimistes à utiliser des approches mixtes combinant plusieurs méthodes pour optimiser l’identification. La chromatographie liquide haute performance (CLHP) chirale avec détection polarimétrique permet de distinguer facilement les deux énantiomères en mesurant leurs pics positifs et négatifs et de les quantifier précisément [108]. Une autre méthode, la chromatographie en phase gazeuse multidimensionnelle énantiosélective [109, 110, 111] (énantio-MDGC) s’est imposée, elle est privilégiée pour un large éventail d’applications dont la séparation d’énantiomères extrêmement chevauchants et pour les analyses des composés à l’état de trace comme dans le cas des huiles essentielles.
D’autres types de couplages sont utilisés, avec l’objectif d’améliorer l’analyse en associant soit deux techniques chromatographiques, soit en couplant deux techniques spectroscopiques. Ces dernières années, le couplage d’une technique chromatographique d’individualisation des composés avec une technique spectroscopique d’identification s’est développé. Les plus courants sont les couplages de :
- chromatographie en phase gazeuse- spectrométrie de masse (CPG-SM),
- chromatographie liquide haute performance-spectrométrie de masse (CLHP-SM),
- chromatographie liquide haute performance-spectrométrie de masse (CLHP-RMN 1H).
L’identification des constituants est possible par comparaison des données spectrales avec celles de produits de référence contenus dans des bibliothèques de spectres.
8. Règlementation et contrôle de qualité des HE
La réglementation [112] des HE fait l’objet d’une surveillance constante avec des réévaluations périodiques. Pour le législateur, cela implique une surveillance attentive de leur composition en raison des risques potentiels qu’elles génèrent. Les HE sont soumises à plusieurs régimes juridiques selon leur utilisation : cosmétique, complément alimentaire, médicament ou biocide ; c’est leur destination qui détermine la réglementation applicable et les exigences auxquelles le produit doit répondre.
La commercialisation des HE est encadrée par plusieurs normes ; elles ne garantissent pas leur pureté absolue mais un niveau minimal de qualité. On peut citer les normes, AFNOR (Association Française de Normalisation), ISO (International Organization for Standarzization) et CEN (Comité Européen de Normalisation). L’huile essentielle est définie par la norme NF EN ISO 9235 (2014) qui précise les matières premières aromatiques naturelles. Les normes sont très strictes, elles doivent offrir une traçabilité depuis la récolte de la plante, du mode d’extraction jusqu’au contrôle de qualité du produit final. La forte variabilité de la composition chimique des huiles essentielles (facteurs physiologiques, environnementaux) est l’une des principales limites à leur qualité, leur sécurité et leur efficacité.
Le profil énantiomérique des HE est encadré par la norme internationale ISO 22972:2004 (fr) qui spécifie une méthode générale d’analyse en phase gazeuse sur colonne capillaire chirale et détermine l’excès énantiomérique des composés chiraux qui la composent. Récemment, la norme ISO 4730:2017 qui spécifiait les caractéristiques de l’HE d’arbre à thé, type terpinéne-4 ol, a fait l’objet d’un amendement (ISO 4730:2017 et addendum ISO 4730/A1:2018) [113], cette restriction précise le profil énantiomérique exigé pour le terpinèn-4-ol (correspondant à 67–71% de (S)(+)-Terpinèn-4-ol et 29–33% de (R)-(−)-Terpinén-4-ol). Ces nouvelles caractéristiques visent à garantir son authenticité, sa qualité pour une utilisation en toute sécurité, elles attestent de l’importance de l’ajout du critère de distribution énantiomérique pour l’HE d’arbre à thé.
On peut confirmer l’absence d’adultération d’une HE grâce à son profil énantiomérique. 0n citera deux exemples, le cas de la mélisse (Melissa officinalis) et celui de la bergamote (Citrus aurantium). L’HE de mélisse (Melissa officinalis) est l’une des plantes médicinales officinales les plus chères, en raison du faible rendement en huile. La majorité de l’huile de mélisse vendue sur le marché est adultérée mais il est possible de s’assurer de la composition de cette huile par le profil énantiomérique du citronellal qui la compose. L’huile de mélisse pure contient majoritairement l’énantiomère (R)-(+)-Citronellal (98%) par rapport au (S)-(−)-Citronellal avec uniquement 2%. Une adultération souvent utilisée est l’ajout d’huiles essentielles riches en citronellal, moins coûteuses, comme huile Cymbopogon winterianus (citronnelle) ou d’Eucalyptus citriodora, la proportion des énantiomères peut changer jusque [(+)/(−)] à [90% /10%]. L’HE de bergamote (Citrus aurantium) possède une composition très particulière, l’huile doit contenir uniquement les énantiomères (R)-(−)-Linalool et (R)-(−)-Acétate de linalyle, présence qui se vérifie facilement par chromatographie chirale.
9. Le chimiotype Linalol, une molécule incontournable des HE
Le linalol (3, 7-dimethylocta-1, 6-dien-3-ol) est un alcool tertiaire, ce monoterpénol est présent naturellement dans la quasi totalité des huiles essentielles, en concentration plus ou moins importante. Il est composé de deux molécules énantiomères présentes, en différentes proportions, dans les plantes. Les énantiomères présentés dans la Figure 5 possèdent des senteurs différentes, le (S)-(+)-Linalol (coriandrol) possède un parfum doux, très différent de celui de l’arôme boisé du (R)-(−)-Linalol [116] et leurs seuils de détection olfactifs sont différents. La rotation spécifique des énantiomères rapportée dans la littérature [117] est [𝛼]D = −20 et + 19.
Le linalol est répertorié comme un agent déodorant/parfumant, son origine est synthétique dans de nombreux produits cosmétiques (60–90%) [118]. Il fait partie des allergènes les plus ciblés de notre environnement [119, 120], pourtant, les résultats de recherches montrent que c’est la forme oxydée de cette molécule qui provoquerait des allergies. Le linalol est considéré comme un pré-haptènes dans la mesure où son oxydation par l’oxygène de l’air conduit à formation d’hydroperoxydes [121], qui potentialisent son effet allergisant.
Le linalol est le composant majeur d’un grand nombre d’huiles essentielles en proportion très variable et avec des profils énantiomériques très spécifiques pour chacune d’elle. L’énantiomère (R)-(−)-Linalol est le plus courant dans la nature mais la distribution énantiomérique des formes (R)-(−) et (S)-(+)-Linalol et celles de l’acétate de linalyle sont des indicateurs utiles de contrôle de la pureté de plusieurs huiles essentielles comme pour les HE de lavande, de bergamote ou de coriandre [122].
Une étude sur la distribution énantiomérique des énantiomères du linalol de plusieurs huiles essentielles a été menée [123, 124], les principaux résultats sont réunis dans le Tableau 3. On constate que l’énantiomère (R)-(−)-Linalol est très majoritaire dans des HE comme le Bois de Ho, Cinnamomum camphora CT linalol (>98%), le Bois de rose [125] Aniba rosaeodora (>90%), le Basilic [126] (Ocimum basilicum) (>99%), la Menthe Citronnée Mentha citrata (>86%) ou la Lavande vraie (Lavandula officinalis) (>97%). L’énantiomère (S)-(+)-Linalol est retrouvé avec des excès énantiomériques très important dans les HE d’Orange douce Citrus sinensis (>94%), de Coriandre Coriandrum sativum (>88%), de Gingembre Rosko Zingiber roseum racines/rhizomes (90.9%), le Faux Poivre (P. du Timut) Zanthoxylum armatum (>92%), la Cannelle indienne Cinnamomum tamala (>99%). Dans le cas de l’HE de coriandre, si le profil énantiomérique présente moins de 81% de (S)-(+)-Linalol, l’HE doit être considérée comme frelatée. Pour d’autres HE les deux énantiomères sont présents dans des rapports égaux ou presque, comme l’origan, la rose, le géranium, le lemongrass, le citron et le pamplemousse.
Distribution énantiomèrique du linalol dans quelques HE
| (R)-(−)-linalol majoritaire | % | (S)-(+)-linalol majoritaire | % | Mélange des énantiomères | % |
|---|---|---|---|---|---|
| HE Bois de Ho, Cinnamomum camphora CT linalol | >98 | HE Orange douce, Citrus sinensis (83.8%) | >94 | HE Origan commun Origanum vulgare | 44.5% (R) |
| 55.5% (S) | |||||
| HE Bois de rose, Aniba rosaeodora | >90 | HE Coriandre Coriandrum sativum a | 88–90 | HE Rose de Damas Rosa damascena | 56.2% (R) |
| 43.8% (S) | |||||
| HE Basilic, (Ocimum basilicum) | >99% | HE Gingembre Rosko Zingiber roseum racines/rhizomes | >90,9 | HE de lemongrass Cymbopogon flexuosus | 41.6% (R) |
| 58.4% (S) | |||||
| HE Menthe bergamote ou Citronnée Mentha citrata | 86–88 | HE Faux Poivre (P. du Timut) Zanthoxylum armatum, feuille | 92 | HE géranium Pelargonium graveolens | 50.7% (R) |
| 49.3% (S) | |||||
| HE Lavande vraie (Lavandula officinalis) | >97 | HE Cannelle indienne Cinnamomum tamala | >99 | HE citron (Citrus lime) | Proches du racémique |
| avec >99% | HE pamplemousse (Citrus paradisi) | [114, 115] |
9.1. Activité biologique des énantiomères du linalol
L’influence de la chiralité de la molécule de linalol sur ses propriétés biologiques a fait l’objet de nombreux travaux [127]. Son utilisation dans les systèmes d’administration de médicaments a été étudiée [128] en 2018 et confirme que ses multiples bénéfices [anti-inflammatoire, antimicrobien, antihyperlipidémique, antidépresseur, neuroprotecteur et propriétés anticancéreuses], dépendent principalement du type d’énantiomère, étant donné que le (R)-(−)-Linalol et le (S)-(+)-Linalol sont chimiquement distincts.
L’inhalation de linalol à un groupe d’humains exposés à un stress provoque des réponses physiologiques selon l’énantiomère de la molécule : le (S)-(+)-Linalol agit comme un agent activateur de la pression artérielle et de la fréquence cardiaque alors que le (R)-(−)-Linalol a un effet contraire sur la fréquence cardiaque. D’autres résultats considèrent cet énantiomère plutôt comme un agent anti-stress [129, 130]. L’huile essentielle de lavande composée de plus de 97% de (R)-(−)-Linalol se comporte de la même manière, bien que l’effet de relaxation puisse être également influencé par son arôme caractéristique [131, 132]. Chez l’homme, l’inhalation d’huile essentielle de lavande, composée de (R)-(−)-Linalool, provoque une sédation, une relaxation, une réduction de l’agressivité [133]. L’étude montre que cet effet est dépendant de la configuration de la molécule, mais aussi des tâches assignées aux sujets. L’inhalation de (R)-(−)-Linalol après avoir écouté des sons environnementaux produit un effet sédatif associé à une diminution notable des ondes bêta (ondes cérébrales de 14Hz, correspondant aux activités courantes), tandis qu’après un travail mental, l’inhalation de (R)-(−)-Linalol conduirait plutôt à un état d’agitation et de vigilance ainsi qu’à une augmentation des ondes bêta.
Dans un autre essai, le (S)-(+)-Linalol a eu un effet stimulant sur la fréquence cardiaque, tandis que (R)-(−)-Linalol avait un effet de sédation sur la fréquence cardiaque [134]. Au Brésil, l’HE de bois de rose (Aniba rosaeodora) dont la teneur en (R)-(−)-Linalol est proche de 90%, est utilisée en médecine traditionnelle en tant que sédatif, anticonvulsivant et antidépresseur [135]. Ces vertus apaisantes des HE seraient donc liées à la présence majoritaire de l’énantiomère (R)-(−)-Linalol.
Le linalol est une molécule précieuse, à fort potentiel thérapeutique, ses énantiomères constituent des marqueurs dans l’appréciation des saveurs, des parfums mais plus spécialement comme élément de contrôle de l’authenticité des huiles essentielles. Le profil énantiomérique ou « l’énantiotype » constitue un critère fiable d’évaluation de l’origine et de la qualité de l’huile essentielle.
10. Conclusion
Dans cette mise au point, l’importance de la chiralité moléculaire, son impact sur le profil des huiles essentielles ainsi que sur leur activité biologique ont été présentés. La signature chirale naturelle des HE « énantiotype » s’inscrit dans la continuité du chimiotype et fournit des indications précieuses quant aux énantiomères uniques ou multiples au sein d’une même espèce, qui peut servir d’empreinte digitale lorsque l’authentification est un problème.
L’élucidation systématique de la distribution énantiomérique des huiles essentielles apporte une indication fiable et une meilleure visibilité sur les espèces et leurs origines. La connaissance de l’abondance relative de la composition énantiomérique correcte des composés principaux devrait intégrer le processus de normalisation des HE. L’énantiotype peut constituer la meilleure option face aux réglementations diverses de plusieurs pays concernant le statut de substances « naturelles » par rapport aux « non naturelles ».
La configuration de la molécule est un élément clé du contrôle de son interaction avec son récepteur que l’on peut imaginer comme une clé déverrouillant une serrure et, par conséquent, les réponses biologiques et thérapeutiques qui peuvent en résulter. L’insertion de cet aspect stéréochimique fondamental à l’aromathérapie scientifique s’impose, pour une utilisation plus sécuritaire des HE et une meilleure compréhension des mécanismes intervenant sur l’évaluation de l’activité pharmacologique.
1 Registration, Evaluation, Authorization and restriction of CHemicals (REACH).
2 Valeur du seuil de perception olfactive ppb : partie par billion, le billion étant le milliard en volume.



 CC-BY 4.0
CC-BY 4.0