Abridged English version
1 Introduction
The majority of international scientists agree that anthropogenic emissions of CO2 have contributed to an increase in atmospheric CO2 concentration and are responsible for current and future climate change [3]. Several mitigation techniques are currently being investigated, including geological CO2 sequestration in deep saline aquifers or depleted oil reservoirs [1,2,4,5]. The efficiency of such CO2 sequestration relies on slow water velocities in the host formation, CO2 dissolution and a possible trapping of CO2 by mineral transformations [7,9–11]. The containment capacity of the host-rock is a key parameter for the safety assessment of the system; this includes the evaluation of its future evolution due to the physical and chemical processes resulting from the massive injection of CO2 [8].
During the several phases of the sequestration, the host-rock, the cap-rock and the borehole seals will be in contact with a supercritical CO2 phase (CO2(sc)), containing various amounts of dissolved water. However, the reactivity of the rock minerals in CO2(sc) fluids is totally unknown. This study aims at experimentally evaluating the existence and magnitude of such reactions, with both a mixed CO2/H2O fluid and an anhydrous CO2(sc) phase. This differs greatly from previous mineral trapping studies, in which the dissolved CO2 was the main reactant.
2 Experimental method
The experiments were carried out using a selection of minerals (from the Museum of Mineralogy, ‘École des mines de Paris’), consistent with the scope of our study, and whose reactivity has been demonstrated for dissolved CO2 [7,9]: phlogopite, glauconite, anorthite, forsterite, dolomite and portlandite (synthetic portlandite, as an analogue of cement phases). All minerals were crushed to provide fresh surfaces of the pure minerals.
The batch reactor consists of a six-pit titanium cell within an autoclave (Fig. 1). The fluid was maintained at constant temperature and pressure. Three sets of experiments were carried out (S1, S2, and S3, see Table 1) using different initial fluid compositions: H2O/CO2 for S1, anhydrous CO2(sc) for S2 and S3; however, as portlandite reaction in experiment S2 produces water, the fluid composition evolves in this case from anhydrous CO2(sc) to mixed H2O/CO2 (see Fig. 2 for the position of each experiment in the phase diagram). The physical conditions are given in Table 2.

Coupe schématique du montage expérimental. La cellule comporte six puits périphériques d'une contenance voisine de 1 cm3 et un puits central d'injection.
Schematic section of the experimental device. The cell consists of six 1-cm3 peripheral pits and a central injection pit.
Réactifs initiaux pour les trois séries S1, S2, S3. Nous avons placé au fond des puits périphériques environ 0,5 cm3 de matériel minéral, préalablement réduit en poudre et étuvé. Le tableau précise les masses correspondantes pour chaque minéral et la fraction molaire du CO2 pour le fluide initial injecté. Le symbole * indique que l'espèce n'est pas présente dans la cellule
Initial reactants for experiments S1, S2, and S3. For each experiment, approximately 0.5 cm3 of separate (crushed and dehydrated) minerals have been placed in the five peripheral pits. The corresponding mass of mineral and CO2 mass fraction of initial fluids are given in the table. * stands for minerals that were not included in the experiment
| S1 | S2 | S3 | |
| Anorthite | 0,8 g | 0,8 g | 0,8 g |
| Forstérite | * | * | 1 g |
| Phlogopite | 0,8 g | 0,8 g | 0,8 g |
| Glauconite | 0,8 g | 0,8 g | 0,8 g |
| Dolomite | 0,9 g | 0,9 g | 0,9 g |
| Portlandite | 0,7 g | 0,7 g | * |
| Fluide réactionnel | CO2/H2O (MCO2 = 0,4) | CO2(sc) (MCO2 = 1) | CO2(sc) (MCO2 = 1) |
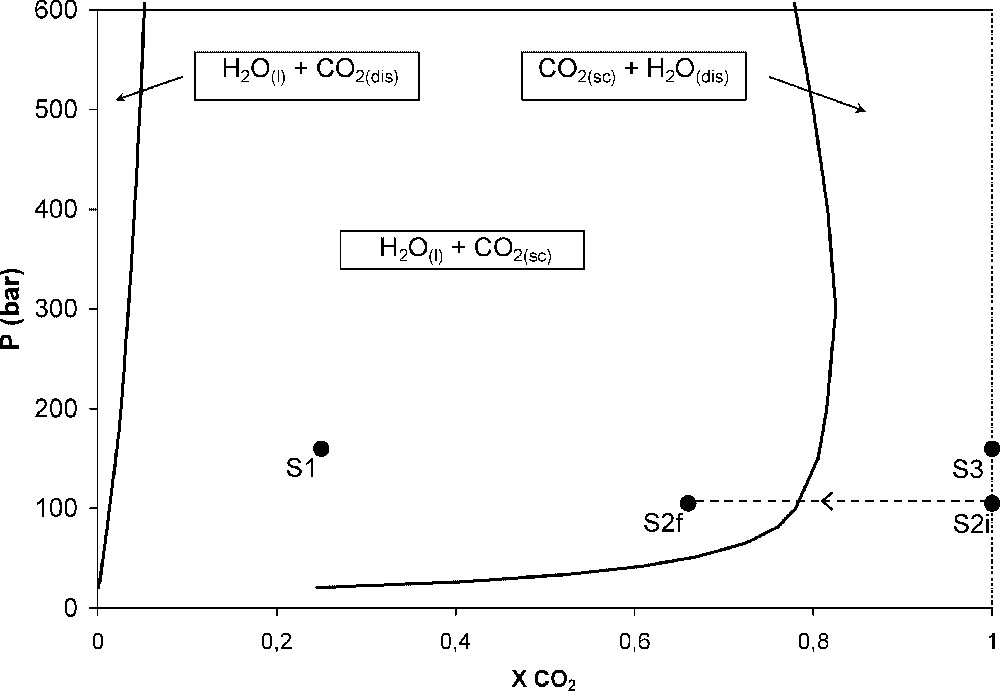
Diagramme de phase du mélange H2O/CO2 à 200 °C [12,13] ; la zone centrale est biphasique, les zones extérieures sont monophasiques (H2O liquide ou CO2 supercritique, respectivement) avec une fraction complémentaire dissoute (CO2 dissous ou H2O dissous, respectivement). Les points représentent les compositions estimées des trois séries d'expériences : S1, S2 et S3. La ligne pointillée entre S2i (initial) et S2f (final) traduit l'évolution de la composition du fluide causée par la carbonatation de la portlandite au cours de l'expérience S2. Masquer
Diagramme de phase du mélange H2O/CO2 à 200 °C [12,13] ; la zone centrale est biphasique, les zones extérieures sont monophasiques (H2O liquide ou CO2 supercritique, respectivement) avec une fraction complémentaire dissoute (CO2 dissous ou H2O dissous, respectivement). Les points ... Lire la suite
Phase diagram for H2O/CO2 at 200 °C [12,13]; in the central area, the fluid is two-phase, in the outer areas the fluid is single-phase (liquid H2O or CO2, respectively), with a complementary dissolved fraction (dissolved CO2 or H2O, respectively). The bullets represent the estimated composition in the three experiments: S1, S2 and S3. The dashed line, from the initial S2i to the final S2f, stands for the evolution of the composition of the fluid due to the portlandite carbonation during experiment S2. Masquer
Phase diagram for H2O/CO2 at 200 °C [12,13]; in the central area, the fluid is two-phase, in the outer areas the fluid is single-phase (liquid H2O or CO2, respectively), with a complementary dissolved fraction (dissolved CO2 or H2O, respectively). The ... Lire la suite
Conditions expérimentales pour les trois séries S1, S2 et S3
Conditions for the three experiments S1, S2, and S3
| Expérience no. | Pression (bar) | Température (°C) | Fluide initial injecté | Présence de portlandite | Durée de l'expérience (j) |
| S1 | 160 | 200 | CO2(sc)–H2O | Oui | 45 |
| S2 | 105 | 200 | CO2(sc) | Oui | 60 |
| S3 | 160 | 200 | CO2(sc) | Non | 45 |
Reacted materials were analysed by X-ray diffraction (XRD) and scanning electron microscopy (SEM) coupled to an energy-dispersion spectrometer (EDS)
3 Results
The experimental results are displayed and discussed for portlandite and anorthite reaction, although other reactions were also observed.
Portlandite: For experiment S1, with a mixed H2O/CO2 fluid, portlandite reacts completely to form rhombohedral calcite crystals (Fig. 3a). For experiment S2, with an initially anhydrous CO2(sc) fluid, portlandite is almost completely carbonated, mainly into rhombohedral calcite and hexagonal aragonite (Fig. 3b). This reaction has an important impact on the fluid composition, as water is produced as the CO2 is consumed:

Photographies au microscope électronique à balayage (MEB) de la portlandite après réaction. (a) Expérience S1, H2O/CO2 : la portlandite est entièrement recristallisée en calcite rhomboédrique. (b) Expérience S2, CO2 anhydre : recristallisation presque complète de la portlandite en calcite rhomboédrique et en aragonite hexagonale.
Scanning electron microscopy (SEM) pictures of portlandite after reaction. (a) Experiment S1, H2O/CO2: the mineral is completely recrystallized into rhombohedral calcite. (b) Experiment S2, anhydrous CO2: the portlandite is almost totally recrystallized into rhombohedral calcite and hexagonal aragonite.
Anorthite: for experiment S1, in the presence of water, the anorthite displayed evidence of dissolution associated with massive secondary mineral precipitations: mainly clays (smectites) and calcite (Fig. 4a), and to a lesser extent aragonite (Fig. 4b) and tridymite (Fig. 4c). Experiment S2, initial anhydrous CO2(sc) fluid with an increasing proportion of water from the reaction of portlandite, displays similar results; in this case, the secondary clay precipitation formed a layer on the anorthite surface, or small sheaves (Fig. 5).

Photographies MEB des cristallisations secondaires associées à l'anorthite dans l'expérience S1, H2O/CO2. (a) Un monocristal de calcite s'est développé sur un tapis de minéraux argileux (smectites) ; l'aspect irrégulier des faces est dû à une croissance différentielle des plans du cristal. (b) Amas de cristaux d'aragonite recouvert partiellement par des argiles. (c) Lépidosphère de tridymite en plaquettes ; on aperçoit bien à la surface de l'anorthite la croissance des argiles par épitaxie.
SEM pictures of anorthite S1 after reaction. (a) A calcite monocrystal grows on a clayey layer (smectites); the faces are irregular due to a differential growth of the crystal planes. (b) Cluster of aragonite crystals partly covered in clays. (c) A lepidosphere of tridymite tablets; the surface of the anorthite and epitaxial clay growth are clearly visible.

Photographie MEB de minéraux argileux (smectites) développés en sphérule à la surface de l'anorthite dans l'expérience S2.
SEM picture of clayey material (smectites) growing as a spherule on the anorthite surface in experiment S2.
In experiment S3, despite the lack of water in the anhydrous CO2(sc) fluid, evidence of mineral reactions was detected, like the creation of a peculiar facies on the anorthite surface: initially smooth surfaces (Fig. 6a) are covered in dissolution patterns associated with early secondary crystallization: pseudo-rhombohedra (carbonates) and crescent-shaped figures related to epitaxial clay precipitation (Fig. 6b). However, these secondary crystals are too small (<1 μm) to permit EDS analysis. Eventually, large (10 μm) secondary crystals can be seen covering the anorthite surface, mainly consisting of radial-growth fibrous calcite (Fig. 6c).



Photographies MEB de l'anorthite après réaction, expérience S3, CO2(sc) anhydre. (a) La majorité des surfaces de l'anorthite avant expérience sont des cassures conchoïdales fraîches issues du broyage : la surface présente un faciès lisse. (b) Vue caractéristique de la surface de l'anorthite après expérience : on aperçoit de petits minéraux pseudo-rhomboédriques (carbonates) et de nombreuses figures en croissant, interprétées comme une mise en place d'un tapis d'argiles épitaxiales. (c) Calcite fibreuse à croissance radiale plaquée à la surface de l'anorthite. Masquer
Photographies MEB de l'anorthite après réaction, expérience S3, CO2(sc) anhydre. (a) La majorité des surfaces de l'anorthite avant expérience sont des cassures conchoïdales fraîches issues du broyage : la surface présente un faciès lisse. (b) Vue caractéristique de la surface ... Lire la suite
SEM pictures of anorthite after reaction, experiment S3, anhydrous CO2(sc). (a) Before reaction, the anorthite surfaces are mainly due to conchoidal fracture during the crushing: the surface displays a smooth facies. (b) Typical view of the anorthite after reaction: tiny pseudo-rhombohedral crystals (carbonates) are visible, along with many crescent-shaped figures, believed to be the early stage of epitaxial clay covering development. (c) Fibrous calcite, with radial growth, on the anorthite surface.
4 Discussion and conclusion
The experiments carried out in this study showed an effective reactivity of portlandite and anorthite in a mixed H2O/CO2(sc) fluid, consistent with previous studies [7,9]. However, they also highlighted a less expected reactivity of the minerals in an anhydrous CO2(sc) fluid: anorthite was transformed to display a partial dissolution patterns associated with the early precipitation of secondary clays and carbonates. Additionally, the kinetics are quite fast (at 200 °C), as these results were obtained after only 45 days of reaction. Portlandite reactivity is even faster, with a total transformation into calcite and aragonite over the same time period. Forsterite and phlogopite displayed behaviours similar to the anorthite. Further work has to be done to clearly identify the secondary minerals and quantify the kinetics.
These results prove that mineral reactivity in CO2(sc) fluids needs to be considered for CO2 sequestration studies. A small additional mineral trapping effect can be expected from this process, but to a smaller extent than from the dissolved CO2 reaction due to the differing kinetics. However, minerals/CO2(sc) reactions might potentially degrade the cap-rock sealing properties: indeed, the strong reactivity of portlandite suggests potential reactions with cement structures around the borehole, and a possible creation of short-cuts or increased porosity. The properties of the cap-rock itself might be altered: due to its lower density, the CO2(sc) is bound to flow upwards to the cap-rock. Its lower viscosity might then enable it to migrate through the cap-rock; eventually, local reactions could occur (e.g., fracture opening or de-clogging), which could decrease the sealing properties of the cap-rock.
1 Introduction
Il est aujourd'hui admis que les activités anthropiques modernes – en particulier la combustion de matière organique fossile – sont à l'origine de l'augmentation de la teneur en CO2 dans l'atmosphère. Cette tendance, en constante accélération, contribue pour une large part au réchauffement climatique global de la terre [3]. Parmi les différentes solutions techniques envisagées pour réduire les émissions de gaz à effet de serre, la séquestration géologique du CO2 sous forme supercritique (CO2(sc)) dans des réservoirs épuisés ou dans des aquifères salins profonds est une solution séduisante : réduction immédiate des émissions, grands volumes disponibles, large répartition géographique de ces formations [6]. L'efficacité de la séquestration dépend tout d'abord du faible taux de transfert des aquifères, de la solubilisation du CO2 et de son possible piégeage par minéralisation sous forme de carbonates. Différentes études ont montré l'existence de tels milieux [1,2,4,5] et les réactions de piégeage minéral commencent à être caractérisées [7,9–11]. Par ailleurs, il faut démontrer la sûreté du système, qui repose sur la capacité initiale de confinement des réservoirs et sur leur bonne tenue dans le temps face aux modifications physiques et chimiques induites par un apport massif de CO2 [8].
Pendant les différentes phases de la séquestration, l'aquifère, sa couverture et les matériaux de scellement des puits pourront être directement exposés à une phase CO2(sc) contenant une fraction plus ou moins importante d'eau dissoute. Or, la réactivité des minéraux de l'encaissant vis-à-vis du solvant CO2(sc) est, à ce jour, largement méconnue. C'est dans un tel contexte que nous avons mis en place des expériences visant à caractériser cette réactivité ; le système expérimental a été simplifié pour observer cette réactivité sur des minéraux purs en présence ou non d'une phase aqueuse. Notre étude se distingue en ce point des autres travaux, plus orientés vers la compréhension du piégeage minéral de CO2 au cours de sa dissolution, et dans lesquelles la fraction dissoute du CO2 joue le rôle prépondérant.
2 Méthode expérimentale
2.1 Réactifs initiaux
Nous avons choisi de travailler sur une sélection de minéraux purs couramment présents à l'état naturel dans les milieux géologiques et dont la réactivité vis-à-vis du CO2(sc) est fortement suspectée [7,9]. Les phases minérales retenues sont ainsi : le phlogopite, la glauconite, l'anorthite, la forstérite et la dolomite. Nous avons ajouté à cette liste la portlandite : ce minéral, habituellement absent des formations sédimentaires, est l'un des composants des ciments (ou un analogue de phases plus complexes de silicates de calcium hydratés) utilisés pour les puits d'injection et leur scellement. Tous les minéraux testés sont purs et proviennent de la collection du musée de Minéralogie de l'École des mines de Paris, à l'exception de la portlandite, commerciale, de synthèse. Les minéraux ont été broyés pour augmenter la surface de contact avec le fluide et pour créer des sites particulièrement réactifs au niveau des cassures fraîches. En outre, les poudres ont été placées en étuve pour déshydrater la charge minérale et contrôler au mieux la quantité d'eau initiale du système.
2.2 Protocole expérimental
Les expériences ont été conduites dans une cellule en titane comportant un puits central pour l'injection des fluides (CO2(sc) pur ou mélange H2O–CO2(sc)) et cinq puits périphériques pour recevoir les solides ne contenant qu'une phase minérale au chargement. Une fois refermée, la cellule est placée en autoclave et reliée à une presse chauffante assurant l'injection et la mise en pression du fluide réactionnel (Fig. 1).
Trois séries d'expériences, S1, S2, S3 ont été conduites à partir d'assemblages minéraux différents et de fluides réactionnels à rapports CO2/H2O distincts (Tableau 1).
Les expériences ont été menées dans des conditions proches de celles attendues pour un stockage de CO2 dans un aquifère profond (Tableau 2). La pression dans les cellules a été imposée à 105 bar pour la série S2 et à 160 bar pour les séries S1 et S3. Cependant, la température de 200 °C, volontairement plus haute que celles des aquifères profonds, a été choisie afin d'accélérer les cinétiques de réaction. Deux fluides réactifs initiaux ont été injectés : un mélange CO2(sc)–H2O dans la cellule S1 et du CO2(sc) pur dans la cellule S3. L'expérience S2 constitue un cas intermédiaire. Le fluide est initialement anhydre, composé de CO2(sc) pur ; nous verrons cependant que les réactions mettant en jeu la portlandite libèrent de l'eau dans des quantités suffisantes pour perturber l'état du système. En revanche, pour S3, les minéraux hydratés (phlogopite et glauconite) ne semblent pas avoir réagi ; par ailleurs, la quantité d'eau de constitution libérée par une éventuelle réactivité très limitée des phases hydratées serait infime. Aussi considérerons-nous que le fluide S3 est resté anhydre au cours de l'expérience. Nous disposons ainsi de milieux réactifs présentant trois degrés de saturation en eau différents (Fig. 2).
Deux techniques principales ont permis d'analyser le produit des réactions : une fraction du matériel a été réservée pour observation en microscopie électronique à balayage (MEB) couplée à un spectromètre de dispersion d'énergie (EDS) ; l'autre partie a été analysée par diffraction des rayons X.
3 Résultats
La majorité des minéraux testés ont réagi au cours des expériences. Nous avons choisi de concentrer la présentation des résultats sur deux des minéraux seulement : la portlandite et l'anorthite.
3.1 Carbonatation de la portlandite
La portlandite, présente dans les cellules S1 et S2, a été massivement recristallisée en carbonate de calcium. Pour S1, l'analyse en diffraction des rayons X révèle que toute la portlandite a réagi pour former de la calcite. Celle-ci se présente sous la forme de cristaux rhomboédriques de quelques micromètres de côté (Fig. 3a). Pour S2, en l'absence d'eau, le diffractogramme de rayons X indique une recristallisation presque complète en calcite (90%), accompagnée d'aragonite (10%). Ces phases néoformées se présentent sous la forme de petits minéraux d'un micromètre de côté, rhomboédriques pour la calcite et hexagonaux pour l'aragonite (Fig. 3b).
Cette réaction de carbonatation a une influence importante sur la composition du fluide réactionnel, car elle libère autant d'eau qu'elle ne consomme de CO2 :
Ainsi, pour l'expérience S2, le fluide initial CO2(sc) pur s'enrichit en eau au cours du temps, avant de devenir biphasique (une phase CO2(sc) saturée en eau et une phase H2O liquide saturée en CO2 dissous) (Fig. 2). Or, les différents puits de la cellule sont en contact ; aussi les autres minéraux de la série S2 ont-ils réagi avec un fluide contenant des quantités croissantes d'eau (Fig. 2).
3.2 Réactivité de l'anorthite
L'anorthite présente une réactivité forte, marquée par de nombreuses cristallisations secondaires. Le comportement observé diffère selon le milieu réactionnel.
Pour l'expérience S1, en présence d'eau liquide, nous avons observé sur l'anorthite de nombreux indices de corrosion, associés à une précipitation massive de minéraux secondaires. Le cortège des phases néoformées se compose majoritairement d'argiles (smectites) et de calcite et, dans une moindre mesure, d'aragonite et de tridymite. La nature de ces minéraux a été confirmée par analyse en sonde EDS. Notons cependant que ces espèces, présentes en trop faibles quantités, n'apparaissent pas dans les diffractogrammes de rayons X. Les argiles tapissent entièrement certaines faces des grains d'anorthite (Fig. 4a). La calcite apparaît majoritairement sous la forme de rhomboèdres d'une dizaine de micromètres de côté. L'aspect irrégulier des faces est dû à une croissance préférentielle de certains plans cristallins. La calcite a également précipité en petits rhomboèdres de 1 à 2 μm de côté, parfaitement bien cristallisés. L'aragonite, présente en plus faible quantité, apparaît en amas de cristaux hexagonaux de 1 μm de côté, recouverts partiellement par des argiles (Fig. 4b). Enfin, nous avons observé localement la présence de tridymite, qui s'est développée en lépidosphères formées de plaquettes de 1 μm de côté (Fig. 4c).
Dans l'expérience S2, au contact d'un fluide CO2(sc) initialement pur, l'anorthite a développé une réactivité assez voisine de celle de S1, bien que moins marquée, malgré une présence d'eau limitée provenant de la carbonatation de la portlandite. Elle se manifeste par l'apparition de nombreuses figures de dissolution et de phases néoformées : essentiellement des minéraux argileux, ainsi que, dans une moindre mesure, du carbonate de calcium. Ces argiles (smectites) présentent une structure typique en nid d'abeilles et forment des tapis à la surface des grains ou constituent des sphérules de quelques micromètres de diamètre (Fig. 5). Le carbonate de calcium est peu présent et semble avoir été affecté par une dissolution secondaire au cours de l'expérience.
Pour l'expérience S3, dans un fluide CO2(sc) anhydre, la réactivité de l'anorthite se caractérise par l'apparition d'un faciès de surface particulier sur l'ensemble des grains. Les faces, initialement lisses (Fig. 6a), sont recouvertes de nombreuses figures interprétées comme des traces de dissolution associées à des amorces de cristallisations secondaires. On aperçoit notamment de petits minéraux pseudo-rhomboédriques pouvant être attribués à des carbonates, ainsi que de nombreuses formes en croissant, évoquant l'ébauche d'un tapis argileux (Fig. 6b). La taille de ces formes, inférieure au micromètre, ne permet pas leur analyse par EDS ; aussi leur nature précise n'est-elle pas connue dans cette étude. En revanche, nous avons observé et pu analyser par EDS, sur ces surfaces réactives, une cristallisation secondaire plus conséquente, se présentant en plaquage d'une dizaine de micromètres de diamètre (Fig. 6c) : cette phase est constituée de calcite fibreuse à croissance radiale.
4 Discussion, conclusion
4.1 Réactivité du solvant CO2(sc)
Les expériences ont mis en évidence une réactivité réelle de l'anorthite et de la portlandite vis-à-vis du CO2(sc). Les observations effectuées en présence d'eau (fluide biphasique, expérience S1) rejoignent les conclusions d'études antérieures sur le piégeage minéral : dissolution du silicate et précipitation de carbonates et de minéraux argileux [7,9]. En revanche, l'expérience S3, en milieu anhydre, offre des résultats entièrement nouveaux : le CO2(sc) se comporte comme un solvant agressif, dissolvant l'anorthite et induisant la cristallisation de calcite secondaire et ce, même en l'absence d'eau. En outre, les cinétiques dans ce solvant ne sont pas négligeables : 45 jours de contact entre l'anorthite et le CO2 suffisent à amorcer significativement les réactions, bien qu'il faille relativiser ce point en considérant que les cinétiques ont été favorisées par la température du système expérimental (200 °C), significativement supérieure à celle des réservoirs typiques pour la séquestration (60–100 °C). À cet égard, il apparaît nécessaire, pour la suite de nos travaux, d'effectuer des expériences similaires à des températures plus basses, pour caractériser l'effet du facteur thermique sur les cinétiques de réactions, voire sur les chemins réactionnels dans notre système.
Pour la portlandite, l'altération est plus spectaculaire encore, puisque l'attaque par CO2(sc) anhydre permet la carbonatation presque complète du minéral initial en 45 jours. Enfin, une réactivité significative a également été mise en évidence pour le phlogopite à des faibles concentrations en eau et pour la forstérite, en présence de CO2(sc) anhydre.
Certains points demandent toutefois des compléments d'information : nature plus précise des argiles secondaires, signification de la nature fibreuse de la calcite associée à l'anorthite, quantification des cinétiques.
4.2 Implications pour la séquestration
Les résultats de cette étude incitent à considérer avec attention les conséquences inhérentes à l'existence d'une phase CO2(sc) au moment de l'injection et avant sa dissolution dans l'eau interstitielle.
L'étude de la réactivité des minéraux en contact avec le CO2(sc) démontre l'existence d'un mécanisme de piégeage minéral, favorable à la séquestration, complémentaire à la réactivité du CO2 dissous. Cependant, ce mécanisme de piégeage devrait rester secondaire, en raison de cinétiques plus lentes.
En revanche, ce type de réaction pourrait poser un problème pour l'étanchéité des barrières. La forte réactivité de la portlandite indique que les propriétés structurales et hydrodynamiques des têtes de puits (en contact avec de grandes quantités de CO2 anhydre durant les phases d'injection) pourraient ainsi être fortement altérées (ouverture de la porosité, création de chemins préférentiels, etc.). L'étanchéité du toit des gisements pourrait aussi être altérée : après son injection dans la formation, le CO2(sc) va migrer vers le toit de la formation par effet densitaire. Par sa plus faible viscosité, le CO2(sc) pourrait migrer dans la roche couverture, où des réactions locales pourraient en modifier les propriétés (par exemple, ouverture ou décolmatage de micro-fractures) et ainsi remettre en cause l'étanchéité de la formation.
Remerciements
Les auteurs remercient EDF Recherche et Développement pour son soutien financier au montage des expériences et pour la mise à disposition de ses moyens analytiques. Le montage expérimental a été mis au point par le Centre d'énergétique et procédés de l'École des mines de Paris. Les auteurs remercient également MM. Bertrand Fritz et Jean Dubessy pour leurs remarques et commentaires, qui ont permis de préciser certains points et d'améliorer la qualité de l'article. Ils remercient enfin M. Ghislain de Marsily pour ses encouragements et l'attention qu'il a portée à l'étude depuis ses premiers stades.


