Abridged English version
Disturbance impacts on ecosystems have usually been studied using the community structure and the species diversity. Disturbance may be described as any discrete event that both disorganises the structure of ecosystem, community or population and modifies food supplies, substrate availability or physical environment. At the community level, according to the Intermediate Disturbance Hypothesis (IDH), the maximum diversity should be reached for an intermediate frequency and intensity of disturbance; this hypothesis has been supported by many studies, especially for the phytoplanktonic community in lakes. However, disturbances may affect each level of organisation, from individual to ecosystem and landscape. The landscape is defined at any scale as a mosaic of homogeneous units connected in space by exchanges of matter, energy and information. Here the effects of a human-induced hydrodynamic disturbance on planktonic algae, Asterionella formosa Hassal, have been studied at the landscape scale for the first time. For this purpose, we focused on the morphological modifications and on the architectural diversity of this diatom in order to determine the influence of disturbance on biodiversity at the population level.
This study is carried out at the landscape scale, along a series of nine reservoirs located in two Mediterranean regulated rivers, the Durance River and its main tributary, the Verdon River. The hydrodynamic conditions are estimated by the mean annual residence time in each reservoir. For algae, these nine reservoirs are monthly investigated for a period of 18 months, from January 1999 to June 2000, except during winter and spring (every two weeks). A total of 207 algal samples is analysed in order to determine biotic descriptors of A. formosa: cell abundance (), cell length (μm) and architecture. Diatom architecture is based on three characteristics: (1) unicellular or colonial forms, (2) configuration of the colony: stellate or no, (3) colony size: cell number per colony. Structural responses of A. formosa population to hydrodynamic disturbances is synthesised using biodiversity indices, which we named architectural indices. These indices are determined from number of architectural types according to the Shannon–Weaver indices; each type is defined as the number of associated cells.
A correspondence analysis of the morphometric, geographic, hydrodynamic and management characteristics allows us to distinguish three groups of reservoirs: groups 1, 2 and, 3 are respectively characterised by low, intermediate and high levels of hydrodynamic disturbance, according to the phytoplankton requirements.
A fuzzy correspondence analysis is conducted on A. formosa abundance, cell length, architectural types and architectural indices. This allows us to find the same classification of the reservoirs. The diatom, A. formosa, responds to the hydrodynamic disturbance at the landscape scale.
Cell abundances are significantly affected by the hydrodynamic disturbance (G-test: p⪡0.001). The group 3 is characterised by the lower mean abundances and the maximum abundance is associated with intermediate levels of disturbance (group 2). Hydrodynamic disturbances control the A. formosa ability to grow in reservoirs.
The cell lengths vary significantly from one reservoirs group to another (G-test: p⪡0.001): a cell-size reduction occurs at group 3 compared to group 2.
Colonial forms are dominant in all three groups. Architectural modifications are noticed at the Durance–Verdon complex scale (G-test: p⪡0.001): there is a marked decrease in both relative abundance of cells in stellate colonies and cell number per colony with increasing hydrodynamic disturbance.
Architectural indices show biodiversity variations in response to disturbance: A. formosa population presents the stronger diversity and the most stable structure at intermediate levels of hydrodynamic disturbance.
At the Durance–Verdon complex scale, Asterionella formosa is present in the phytoplankton of all reservoirs, but this species takes various growth forms in response to the hydrodynamic conditions. A high level of hydrodynamic disturbance involves a change in architecture pattern of these algae: a decrease in cell and colony size. The morphological plasticity appears to be related to strong resilience ability for this species; A. formosa takes advantage of its genotype abilities to stay in the euphotic zone whatever the hydrodynamic conditions. The phenotypic plasticity of planktonic algae implies an increase in complexity of aquatic systems. The architectural indices show that diversity at population level can be modified by hydrodynamic conditions. At the intermediate disturbance, the architectural diversity is maximal. The diatom population is then characterised by the coexistence of two categories of architectural types: the ‘colonisers’ with the small colonies (2–4 cells), and the ‘competitors’ with the large colonies (5–8 cells). It could be useful to take into account the morphological plasticity of algae as a tool for evaluating biodiversity and resilience ability of each species.
1 Introduction
La prise en compte de la diversité biologique est actuellement un objectif majeur de la recherche en écologie [1]. La diversité biologique, appelée biodiversité depuis la conférence de Rio en 1992, est définie comme la variété des espèces vivantes dans la biosphère [2]. La variabilité temporelle et spatiale du milieu joue un rôle primordial sur la distribution des organismes, leurs interactions et leurs adaptations [3] et, par conséquent, sur la biodiversité.
La perte de biodiversité peut réduire la capacité des écosystèmes à répondre aux perturbations de l'environnement. Selon l'hypothèse diversité–stabilité, l'aptitude des systèmes écologiques à réagir à des perturbations s'accroı̂t régulièrement lorsque la richesse spécifique augmente, la multiplicité des proies, des prédateurs et des réseaux trophiques permettant d'amortir les fluctuations environnementales [4]. Une perturbation peut être définie comme tout événement, relativement discret dans le temps, désorganisant la structure de l'écosystème, de la communauté, ou de la population, modifiant les ressources, la disponibilité du substrat ou l'environnement physique [5]. La perturbation peut donc affecter chaque niveau d'organisation, de l'individu au paysage ; un paysage est défini à n'importe quelle échelle comme une mosaı̈que d'entités spatiales homogènes, connectées par des flux de matière, d'énergie et d'information [6]. Les travaux théoriques sur les perturbations ont surtout porté sur la structure de la communauté [5,7]. D'après l'Intermediate Disturbance Hypothesis (IDH), le maximum de diversité est atteint au niveau communautaire pour une perturbation intermédiaire en fréquence et en intensité [8]. Dans les écosystèmes aquatiques, l'influence du brassage des eaux, considéré comme une perturbation hydrodynamique, sur la communauté phytoplanctonique a été étudiée dans différents lacs en conditions naturelles [9,10] ou expérimentales [11–14] ; il apparaı̂t que l'intensité et la fréquence de la perturbation influence la richesse spécifique.
Cependant, les conséquences et les mécanismes de perturbation sont différents à chaque niveau d'organisation [15]. La réponse du système écologique aux perturbations peut dépendre de la composition spécifique des peuplements et de leurs caractéristiques biologiques ou morphologiques. Il a été montré en rivière régulée que des variations de débit n'engendrent pas de modifications de la composition spécifique de la communauté algale épilithique, mais entraı̂nent des transformations architecturales des diatomées en place [16].
Actuellement, les modifications morphologiques des algues ont surtout été envisagées comme des réponses populationnelles à la variabilité de l'environnement, en tant que stratégie adaptative de survie. La plasticité phénotypique est définie comme la capacité d'un seul génotype à produire plus d'une forme alternative de morphologie, d'un état physiologique et/ou d'un comportement en réponse aux conditions environnementales [17]. La plasticité représente une diversité de réponses adaptatives potentielles. La succession des générations de certaines algues phytoplanctoniques est caractérisée par un polyphénisme saisonnier. Les facteurs abiotiques, tels que la température de l'eau, la disponibilité des nutriments et la lumière, sont souvent désignés comme les facteurs déterminant cette variabilité morphologique. Les facteurs biotiques, comme le zooplancton, les poissons zooplanctonophages, peuvent induire des modifications morphologiques ; le polyphénisme a pu être interprété, chez certaines Chlorophycées et Dinophycées, comme un mécanisme de défense contre la prédation [18–21]. Peu d'études ont été menées sur les effets des conditions hydrodynamiques sur la morphologie des algues. Récemment, il a été démontré chez une Dinophycée marine que la variation de la taille et du nombre des cornes est directement liée aux conditions de turbulence du milieu environnant [22].
Pour la première fois, nous analysons à l'échelle du paysage les modifications morphologiques d'une algue phytoplanctonique, Asterionella formosa Hassal, en réponse à la variabilité d'une perturbation hydrodynamique anthropique. Cette diatomée pennée, commune des lacs tempérés, est généralement observée sous forme de colonies étoilées regroupant des cellules dont le nombre et la taille peuvent varier en fonction des conditions environnementales. Nous nous proposons ainsi d'analyser l'influence de la perturbation sur la biodiversité des écosystèmes lacustres à un niveau d'organisation peu considéré, la population. Il s'agit de déterminer si la prise en compte de la variabilité phénotypique intra-populationnelle peut permettre d'évaluer la biodiversité, au même titre que la richesse spécifique au niveau communautaire. Pour cela, nous étudierons les variations de la diversité architecturale de la population d'A. formosa le long d'un gradient de perturbation situé au sein d'une série de retenues artificielles.
2 Site d'étude
Cette étude, envisagée à l'échelle du paysage, intègre une série de retenues plus ou moins interconnectées entre elles, localisées au sein du complexe Durance–Verdon. Le complexe artificiel Durance–Verdon est localisé dans le Sud-Est de la France, en région méditerranéenne. Il regroupe deux rivières régulées, la Durance, la plus grande rivière torrentielle de France, et son principal affluent, le Verdon, ainsi qu'un réseau complexe de canaux constituant le système d'adduction en eau de la région marseillaise. L'aménagement de ces deux cours d'eau comprend à la fois des retenues hydroélectriques et des réservoirs d'eau ; ces retenues diffèrent les unes des autres d'un point de vue morphométrique, géographique et hydrodynamique.
Des prospections ont été menées sur neuf retenues artificielles situées au sein du complexe Durance–Verdon. Sept d'entre elles sont des retenues hydroélectriques : trois situées sur la Durance (S1, S2, S3) et quatre localisées sur le Verdon (S4, S5, S6, S7) (Fig. 1). Les deux autres retenues sont des réservoirs d'eau destinés à la consommation en eau potable : S8, où transitent principalement les eaux de la Durance, et S9, qui stocke les eaux du Verdon.
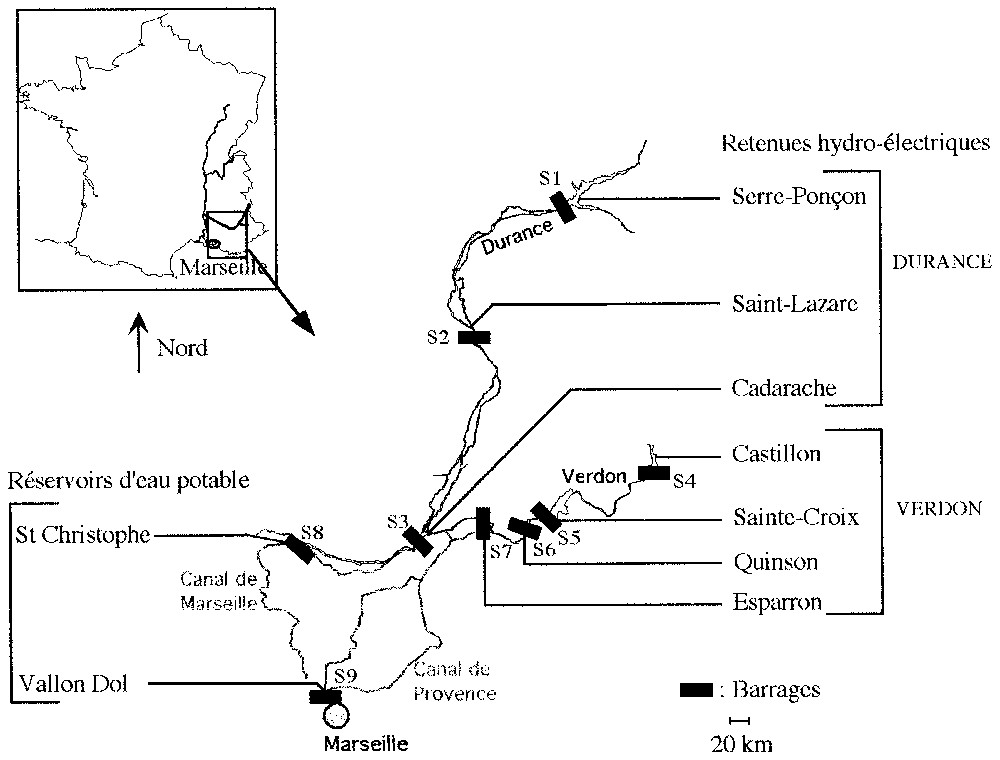
Localisation des stations de prélèvement dans les retenues du complexe Durance–Verdon.
3 Matériels et méthodes
3.1 Perturbation hydrodynamique
Les rivières régulées, comme la Durance et le Verdon, sont soumises à des niveaux de perturbation hydrodynamique variables en fonction de l'unité du paysage considérée, de la profondeur et de la dimension de la retenue créée et du mode de gestion des aménagements. Dans le complexe Durance–Verdon, les débits entrants et sortants, qui dépendent principalement du mode de gestion et de la capacité de stockage, varient d'une retenue à l'autre et au cours du temps. Cette forte hétérogénéité, à la fois spatiale et temporelle, de l'hydrodynamisme à l'échelle du complexe se traduit par des périodes de brassage des eaux plus ou moins fréquentes, plus ou moins intenses, et par conséquent, pour le phytoplancton, par un niveau de perturbation hydrodynamique plus ou moins élevé, puisque, dans les milieux lacustres, un changement épisodique, imprévisible, de la fréquence et de l'intensité du brassage de l'eau constitue une perturbation hydrodynamique majeure pour les algues phytoplanctoniques [23]. Dans le complexe Durance–Verdon, l'hydrodynamisme dans chaque retenue est quantifié par l'intermédiaire du temps de résidence moyen de l'eau. Plus le temps de résidence est court, plus le débit d'eau qui transite dans la retenue est important, le brassage des eaux intense et, par conséquent, le niveau de perturbation hydrodynamique fort. Inversement, avec un temps de résidence long, les conditions de brassage sont réduites et le niveau de perturbation hydrodynamique faible. Certains auteurs [24–26] ont montré qu'une période de 35 à 60 jours est nécessaire à une communauté phytoplanctonique pour tendre vers un état d'équilibre. Par conséquent, dans le complexe Durance–Verdon, la perturbation hydrodynamique est considérée comme forte, si le temps de résidence de l'eau est de l'ordre de quelques heures à quelques jours, moyenne, si le temps de résidence est de l'ordre du mois et enfin, la perturbation hydrodynamique peut être considérée comme faible pour les algues quand le temps de résidence de l'eau est plurimensuel ou annuel.
3.2 Phytoplancton
Les neuf retenues sont suivies sur une période de 18 mois, au cours de laquelle 207 relevés phytoplanctoniques (23 dates de prélèvements ×9 stations) ont été réalisés. Ces relevés sont effectués, de janvier 1999 à juin 2000, une fois par mois, excepté durant l'hiver et le printemps, où les prélèvements ont été effectués tous les quinze jours. Pour chaque retenue, les prélèvements sont réalisés, à l'aide d'une bouteille de type Van Dorn, en un point de surface unique (profondeur : 50 cm), situé le plus possible à l'aplomb du barrage. Les échantillons de phytoplancton sont fixés sur place au formol neutre à 5 %.
Pour chaque prélèvement, un sous-échantillon (25 ml) est observé au microscope inversé Olympus selon la méthode d'Utermöhl [27], afin de déterminer les descripteurs densitaires et morphologiques de la Diatomophycée, Asterionella formosa. Le suivi populationnel d'A. formosa est réalisé à partir de plusieurs descripteurs : l'abondance cellulaire (), la longueur cellulaire (μm) et l'architecture. Le suivi de l'architecture de chaque cellule algale est basé sur trois critères :
- – (1) la forme unicellulaire ou coloniale ;
- – (2) la forme de la colonie : étoilée ou non ;
- – (3) la taille de la colonie : nombre de cellules associées entre elles.
Le plus souvent, les cellules d'A. formosa sont en effet connectées entre elles, au niveau de leur pôle basal, par des bourrelets mucilagineux [28] et forment ainsi des colonies.
Les réponses structurales de la population d'A. formosa à la perturbation hydrodynamique sont analysées grâce à des indices de diversité déterminés au niveau populationnel, que nous avons appelés les indices architecturaux. Ceux-ci, diversité et équitabilité, sont déterminés à partir des types architecturaux, selon le même principe que pour la communauté [29]. Les différents types architecturaux considérés correspondent au nombre de cellules associées entre elles ; ils sont représentés par huit modalités : une, deux, trois, quatre, cinq, six, sept, et huit cellules et plus associées entre elles.
La diversité de la population d'A. formosa est évaluée selon le même principe que l'indice de diversité de Shannon–Weaver : H′=−∑pilog2pi, où pi représente l'abondance relative du type architectural i.
L'équitabilité est déterminée à partir de la formule suivante : H′/log2S, avec H′ l'indice de diversité architecturale et S le nombre de types architecturaux.
3.3 Analyses statistiques
Afin de structurer les neuf retenues du complexe Durance–Verdon en fonction de leurs caractéristiques physiques, et plus particulièrement du niveau de perturbation hydrodynamique caractérisant chacune d'entre elles, une analyse des correspondances multiples (ACM) est réalisée à partir d'une matrice de données qualitatives [30] ; cette matrice comprend des variables morphométriques (profondeur moyenne, capacité totale, superficie), une variable géographique (altitude) et d'autres variables résultant en partie du mode de gestion (temps de résidence, marnage maximum, fréquence de mélange des eaux, année de mise en service). Les valeurs de ces variables sont représentées par des modalités établies par le logiciel ADE-4 [31], en tenant compte des exigences du phytoplancton (Tableau 1). Notamment, pour le temps de résidence, nous avons retenu trois modalités : plurimensuel, mensuel et journalier à hebdomadaire, ce qui correspond pour le compartiment algal aux trois niveaux de perturbation hydrodynamique définis précédemment.
Modalités des différentes variables intervenant dans l'ACM réalisée à partir des caractéristiques physiques (20 modalités) des neuf retenues du complexe Durance–Verdon
| Variables | Modalités | ||
| 1 | 2 | 3 | |
| Profondeur moyenne (m) | <10 | 10–20 | ⩾50 |
| Altitude (m) | <400 | >400 | |
| Capacité totale (Mm3) | <15 | 15–150 | >150 |
| Superficie (ha) | 100–300 | 300–500 | >2000 |
| Temps de résidence | < semaine | > semaine | > mois |
| Marnage maximal (m) | <10 | >10 | |
| Année de mise en service | avant 1960 | après 1960 | |
| Fréquence de mélange des eaux | holomictique | monomictique |
Par ailleurs, une analyse des correspondances multiples (ACM) est conduite sur les descripteurs populationnels de la diatomée, A. formosa. Il s'agit d'une ACM à codage flou [32,33] puisque pour un même relevé, une variable peut prendre plusieurs modalités. Cette analyse multivariée est réalisée à partir d'une matrice comprenant une variable densitaire (abondance cellulaire), une variable morphométrique (taille cellulaire), des variables architecturales (forme unicellulaire ou coloniale, taille de la colonie : cellule isolée, petite colonie (deux à quatre cellules), grande colonie (cinq à huit cellules et plus), forme de la colonie : étoilée ou non) et les indices architecturaux (diversité et équitabilité) (Tableau 2).
Modalités des differentes variables intervenant dans l'ACM à codage flou réalisée à partir des paramètres descriptifs de la diatomée, Asterionella formosa (19 modalités)
| Variables | Modalités | ||
| 1 | 2 | 3 | |
| Densité cellulaire () | <2000 | 2000–10000 | ⩾10000 |
| Longueur cellulaire (μm) | ⩽90 | 90–95 | ⩾95 |
| Forme unicellulaire/coloniale | cellule isolée | colonie | |
| Forme de la colonie | non étoilée | étoilée | |
| Taille de la colonie | cellule isolée | petite colonie | grande colonie |
| Diversité architecturale | ⩽1 | 1–2 | >2 |
| Équitabilité architecturale | <0,5 | 0,5–0,8 | >0,8 |
Les réponses de la diatomée aux trois niveaux de perturbation hydrodynamique auxquelles sont soumises les retenues du complexe Durance–Verdon sont analysées grâce à des tests G [34]. Ainsi, l'hypothèse nulle d'indépendance de l'occurrence des modalités par rapport aux groupes de retenues est testée pour chacune des variables considérées dans la population d'A. formosa.
4 Résultats
4.1 Hiérarchisation des retenues en fonction du niveau de perturbation hydrodynamique
La projection des coordonnées sur les axes F1 et F2 de l'ACM rend compte de 75 % de la variabilité totale. Sur la carte des relevés, trois groupes de retenues se distinguent (Fig. 2).

Ordination des retenues à partir des caractéristiques physiques des neuf retenues avec une analyse des correspondances multiples (ACM) : (a) carte factorielle F1×F2 des retenues ; (b) cartes factorielles des différents paramètres physiques.
Le groupe 1, corrélé négativement avec l'axe F1, rassemble les retenues, S1, S4 et S5, retenues profondes, dotées d'une superficie, d'une capacité de stockage et d'un marnage importants ; situées en altitude, elles sont caractérisées par un temps de résidence supérieur à 100 jours, et par conséquent par un niveau de perturbation hydrodynamique faible.
Le groupe 3 s'oppose au groupe 1 le long de l'axe 1 : il est constitué des retenues S2, S3, S6 et S8, très peu profondes, avec une très faible capacité de stockage et un temps de renouvellement extrêmement réduit (de l'ordre du jour) et variable (quelques heures à quelques jours). Ces réservoirs du groupe 3 sont caractérisés par un niveau de perturbation hydrodynamique fort.
Le groupe 2 est corrélé négativement à l'axe 2 : il réunit les retenues S7 et S9, peu profondes, avec des capacités de stockage et un temps de résidence intermédiaires, de l'ordre du mois, et sont donc soumises à un niveau intermédiaire de perturbation hydrodynamique.
Cette analyse met en évidence la forte hétérogénéité spatiale de la perturbation hydrodynamique, à laquelle sont soumises les algues phytoplanctoniques au sein du complexe : la perturbation hydrodynamique est faible dans les retenues du groupe 1, moyenne dans celles du groupe 2 et forte dans celles du groupe 3.
4.2 Réponses populationnelles d'Asterionella formosa à la perturbation hydrodynamique
La projection des coordonnées sur les axes F1 et F2 de l'ACM à codage flou rend compte de 79 % de la variabilité totale. La carte des relevés présente trois groupes de retenues distincts : les groupes 1, 2 et 3 sont constitués respectivement des retenues S1, S4 et S5, des retenues S7 et S9, et enfin, des retenues S2, S3, S6 et S8 (Fig. 3a). Ces groupes de retenues obtenus à partir des paramètres descriptifs de la diatomée, Asterionella formosa, correspondent à ceux déterminés par les paramètres physiques des retenues. Cette algue répond donc par des modifications populationnelles au gradient de perturbation hydrodynamique.

Ordination des retenues à partir des variables descriptives de la diatomée, A. formosa, avec une analyse des correspondances multiples (ACM) à codage flou. (a) Carte factorielle F1×F2 des retenues. (b)–(h) Cartes factorielles des différentes variables descriptives de la diatomée : (b) densité cellulaire ; (c) taille cellulaire ; (d) forme unicellulaire/coloniale ; (e) forme de la colonie ; (f) taille de la colonie ; (g) diversité architecturale ; (h) équitabilité architecturale.
4.2.1 Abondance cellulaire
L'abondance cellulaire d'A. formosa est significativement dépendante des groupes de retenues (G=35,8>χ24ddl, p⪡0,001). Dans les retenues où le niveau de perturbation est intermédiaire, les abondances cellulaires sont les plus fortes () alors qu'à perturbation forte, les plus faibles abondances sont enregistrées () (Fig. 3b). Il existe, à l'échelle du complexe Durance–Verdon, un gradient densitaire de la population d'A. formosa en réponse au niveau de perturbation hydrodynamique.
Le niveau de perturbation hydrodynamique influence donc, en premier lieu, la capacité de cette Diatomée à se développer dans les écosytèmes lacustres.
4.2.2 Longueur cellulaire
Les tailles des cellules d'A. formosa sont significativement dépendantes des groupes de retenues (G=47,3>χ24ddl, p⩽0,001). À perturbation intermédiaire, les cellules sont plus grandes (99,7±2,5 μm) qu'à perturbation forte, où chaque cellule mesure, en moyenne, moins de 95 μm de long (Fig. 3c).
Il existe donc un gradient de longueur cellulaire d'A. formosa à l'échelle du complexe de retenues.
4.2.3 Architecture
Les variables architecturales, forme isolée/coloniale et forme de la colonie, ne permettent pas de différencier les neuf retenues du complexe Durance–Verdon (Fig. 3d–e).
En effet, quel que soit le niveau de perturbation hydrodynamique, les cellules sous forme coloniale sont mieux représentées que les formes unicellulaires dans la population d'A. formosa (Tableau 3). Cependant, le nombre de cellules isolées dans la population est plus élevé à perturbation intermédiaire (test G : p⪡0,001). À perturbation forte ou faible, les cellules isolées représentent moins de 7 % de la population.
Nombre d'observation des différents types architecturaux calculés pour chacun des trois groupes de retenues à partir de l'ensemble des relevés où l'algue a été dénombrée. Le nombre d'observation correspond au nombre de cellules dans un litre adoptant un type architectural donné. Le test G teste l'hypothèse Ho : l'occurrence des différentes modalités de chaque variable architecturale est indépendante des groupes de retenues (niveau de perturbation)
| Architecture | Perturbation | Test G | ||
| faible | moyenne | forte | ||
| groupe 1 | groupe 2 | groupe 3 | ||
| Forme unicellulaire/coloniale : | ||||
| cellules isolées | 305 | 1185 | 175 | |
| cellules coloniales | 4161 | 9055 | 2350 | |
| G=109>χ2.01[2]=13,8 | ||||
| rejet Ho | ||||
| Forme de la colonie : | ||||
| colonies étoilées | 1373 | 2598 | 559 | |
| colonies non étoilées | 2788 | 6458 | 1791 | |
| G=64,3>χ2.001[2]=13,8 | ||||
| rejet Ho | ||||
| Taille de la colonie : | ||||
| cellules isolées | 305 | 1185 | 175 | |
| petites colonies | 1517 | 4609 | 1433 | |
| grandes colonies | 2644 | 4446 | 917 | |
| G=522,1>χ2.001[2]=13,8 | ||||
| rejet Ho |
De même, quel que soit le niveau de perturbation hydrodynamique, les cellules sous forme de colonies non étoilées dominent la population d'A. formosa (Tableau 3). Cependant, selon un gradient croissant du niveau de perturbation, la proportion de cellules sous forme de colonies étoilées se réduit fortement dans la population d'A. formosa (test G : p⪡0,001).
Le nombre de cellules associées entre elles varie significativement en fonction du groupe de retenues considéré (Tableau 3). À perturbation faible, les cellules sous forme de grandes colonies (59 %) dominent la population d'A. formosa ; à perturbation moyenne, on note une codominance entre les petites colonies (45 %) et les grandes colonies (43 %) ; à perturbation forte, la population est dominée par des cellules coloniales regroupées au sein de petites colonies (57 %). Ainsi, plus la perturbation est forte, plus le nombre de cellules par colonie se réduit : dominance des colonies de huit cellules à perturbation faible et de quatre cellules à perturbation forte (Fig. 4). À perturbation moyenne, on constate une codominance entre les formes coloniales de huit et de quatre cellules (23 et 22,7 %).
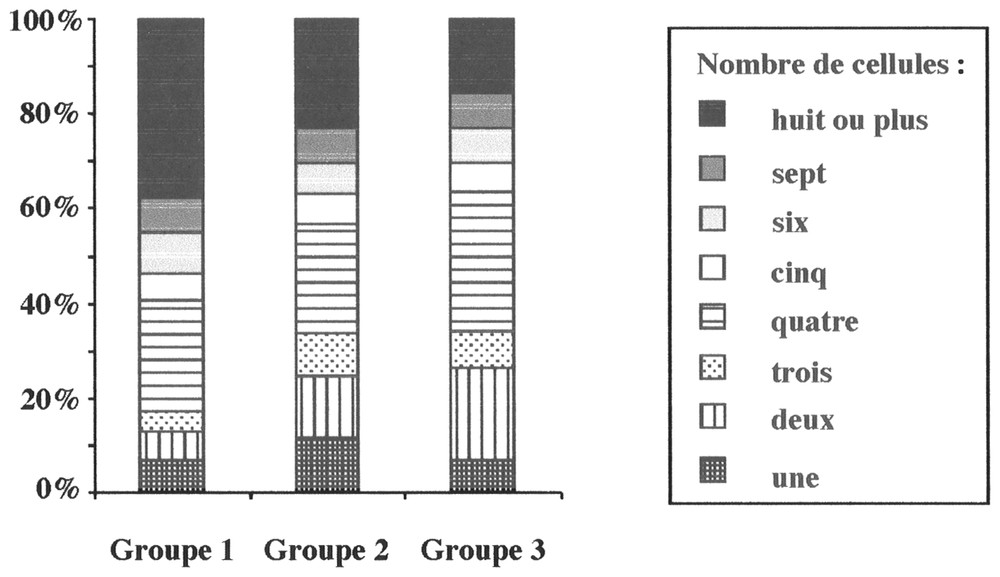
Abondance relative moyenne de chaque type architectural (nombre de cellules associées) d'A. formosa dans chacun des trois groupes de retenues.
4.2.4 Indices de biodiversité
Les indices architecturaux, outils visant à traduire la biodiversité au niveau populationnel, diffèrent en fonction du groupe de retenues considéré (G>χ24ddl, p⩽0,001). À perturbation intermédiaire, on observe les plus fortes valeurs de diversité et d'équitabilité (Fig. 3g–h). Le groupe 1 occupe une position intermédiaire et le groupe 3 est caractérisé par les plus faibles valeurs de diversité et d'équitabilité. La population d'A. formosa dans les retenues soumises à une perturbation moyenne est la plus diversifiée et présente une structure plus équilibrée, tendant vers une équirépartition des différents types architecturaux (une à huit cellules par colonie).
5 Discussion
Cette étude a permis de mettre en évidence, à l'échelle du complexe Durance–Verdon, un gradient de perturbation hydrodynamique d'origine anthropique comprenant trois niveaux : faible, moyen et fort, correspondant respectivement à des temps de résidence plurimensuel (faible brassage des eaux), mensuel, et journalier à hebdomadaire (fort brassage des eaux).
À l'échelle du paysage que représente le complexe Durance–Verdon, l'ensemble des descripteurs biotiques de la population d'Asterionella formosa présente une variabilité spatiale qui se superpose au gradient de perturbation hydrodynamique.
À faible niveau de perturbation, la population d'A. formosa présente des valeurs moyennes d'abondance et de longueur cellulaires, ainsi que d'indices architecturaux (diversité et équitabilité) ; les grandes colonies étoilées regroupant huit cellules constituent le type architectural favorisé. Ce type architectural offre le plus d'opportunité à A. formosa pour optimiser et prolonger son maintien en suspension [35], puisque la formation de colonies s'accompagne de sécrétion de mucus hygrophile.
À perturbation intermédiaire, la contrainte de sédimentation s'amoindrit, on observe une diminution de la taille coloniale et un accroissement de la longueur cellulaire, A. formosa investit alors davantage dans l'exploitation des ressources, ce qui entraı̂ne une augmentation de l'abondance cellulaire, caractéristique d'une meilleure exploitation des nutriments, et un accroissement de la taille cellulaire, et donc de la surface photosynthétique.
Un fort niveau de perturbation hydrodynamique entraı̂ne des conditions environnementales défavorables au succès massif de cette algue. Dans ces conditions hydrodynamiques, la population d'A. formosa, dotée des plus petites cellules du complexe, est la plus pauvre, aussi bien du point de vue densitaire qu'architectural. Cette diatomée fait néanmoins partie des espèces phytoplanctoniques qui se maintiennent dans cet environnement hostile. Cette capacité de résilience est à relier à sa plasticité morphologique : réduction de la longueur cellulaire et de la taille des colonies.
Ces résultats rejoignent les prédictions de [36] selon lesquelles les traits de résilience et/ou de résistance des espèces (petite taille du corps) s'expriment de plus en plus le long d'un gradient croissant de variabilité temporelle de l'environnement.
Ainsi, cette diatomée planctonique, A. formosa, présente en réponse à la perturbation hydrodynamique anthropique une forte plasticité morphologique, ce qui facilite son adaptation aux fluctuations des conditions environnementales au sein du complexe Durance–Verdon. Cette plasticité morphologique se traduit par une augmentation, soit de la longueur cellulaire (perturbation intermédiaire), soit de la taille de la colonie formée (forme de huit cellules privilégiée à perturbation faible), ceci afin d'exploiter au mieux les ressources du milieu (nutriments et lumière). A. formosa, algue de grande taille non mobile, est soumise à une forte contrainte de perte par sédimentation ; elle doit donc adopter, en fonction de l'hydrodynamisme, le type architectural le plus adapté pour tendre vers un équilibre entre optimisation du potentiel photosynthétique, exploitation des ressources nutritives et maintien en suspension dans la zone euphotique.
La variabilité morphologique de cette Diatomée, A. formosa, en réponse aux conditions hydrodynamiques octroie à cette espèce un fort pouvoir de colonisation des écosystèmes lacustres. Sa forte plasticité phénotypique montre que, dans ce paysage hétérogène, cette espèce exploite au mieux les capacités de son génotype afin de se maintenir, quelle que soit la variabilité de l'environnement.
Les modifications morphologiques d'A. formosa ont été observées, dans le cadre de cette étude, face à la variabilité de l'hydrodynamisme, mais elles ont déjà été envisagées comme des indicateurs du contexte thermique et du budget nutritif du phytoplancton. La température aussi bien que les nutriments contrôlent la taille des colonies [28,37–39]. La réduction de taille cellulaire apparaı̂t être une adaptation à certaines conditions environnementales (faibles teneurs en silice, augmentation en phosphore et/ou température), défavorables d'un point de vue compétitif à cette Diatomée [39]. À l'échelle du complexe Durance–Verdon, les modifications morphologiques d'A. formosa sont en premier lieu sous le contrôle des conditions hydrodynamiques : la réduction de taille cellulaire à perturbation forte n'a pu être reliée à des facteurs nutritionnels, comme une limitation en silice [40]. Cependant, le zooplancton pourrait également influencer la plasticité morphologique d'A. formosa ; face à cette pression de broutage, l'algue pourrait en effet développer des mécanismes morphologiques de défense contre la prédation.
La variabilité morphologique de cette Diatomophycée a donc une signification écologique, de par l'information qu'elle donne sur la variabilité environnementale. Par conséquent, elle pourrait être utilisée comme un indicateur limnologique. Les suivis morphométrique et architectural des espèces coloniales semblent donc très intéressants à réaliser en complément du suivi densitaire. Les propriétés morphologiques des espèces algales influencent la réponse dynamique du phytoplancton aux conditions physiques de l'environnement [41,42]. La morphologie des cellules, ou des agrégats cellulaires, et leur capacité à moduler leurs dimensions sous différentes conditions environnementales peuvent être d'une grande importance dans les processus de colonisation et de flottaison du phytoplancton et peuvent jouer sur leurs capacités à exploiter la lumière ainsi que les nutriments [43] et, par conséquent, influencer la direction de la succession phytoplanctonique.
La plasticité morphologique des algues phytoplanctoniques ajoute des degrés de complexité aux systèmes aquatiques. La détermination d'indices architecturaux a permis de montrer une modification de la biodiversité au niveau populationnel en réponse à la variabilité de l'environnement physique : à perturbation intermédiaire, la diversité architecturale est maximale ; il y a donc un enrichissement au niveau populationnel avec la coexistence de types architecturaux « colonisateurs » et « compétiteurs ». Lors d'une élévation ou d'une diminution du niveau de perturbation, la diversité diminue. À faible perturbation, l'exclusion compétitive réduit la diversité architecturale en favorisant les types architecturaux « compétiteurs », les colonies de grande taille bien adaptées morphologiquement aux contraintes environnementales de perte par sédimentation, alors qu'à perturbation forte, les types architecturaux « colonisateurs », les colonies de petite taille à croissance plus rapide sont avantagées, les types architecturaux « compétiteurs » ne disposant pas d'un temps suffisant pour se développer.
Cette étude intègre une nouvelle échelle d'observation de la biodiversité, qui n'est pas incluse dans la définition de la biodiversité proposée par [2] : à l'échelle du complexe Durance–Verdon, les écosystèmes lacustres répondent au gradient de perturbation hydrodynamique anthropique par des variations de la diversité des traits biologiques de l'espèce A. formosa. La biodiversité peut être envisagée au niveau populationnel en considérant la variété des types architecturaux. La prise en compte de la plasticité morphologique constitue un bon outil pour évaluer la biodiversité ainsi que la capacité de résilience de l'espèce.
Les écosystèmes aquatiques constituent des systèmes complexes où la prise en compte de différents niveaux de perception de la biodiversité ainsi que de différents niveaux d'organisation paraı̂t indispensable afin d'appréhender au mieux les capacités de résilience ou de résistance des écosystèmes.
Remerciements
Nous remercions la Société des eaux de Marseille (SEM) pour son soutien financier, Électricité de France (EDF) et la Société du canal de Provence (SCP) pour nous avoir fourni les données morphométriques des retenues et nous avoir permis l'accès aux barrages.



