Abridged English version
The whole Mediterranean Maghreb belongs to the priority world concerns with regard to conservation biology [2,7]. This is due to its well-known taxonomic richness, its strong plant endemism and increasing human threats [5,6]. It is one of the eight hottest hotspots of the planet [5]. Within this Mediterranean hotspot, two areas did not yet receive the attention they deserve: the Dalmatian coast and archipelagos (Croatia) and the Numidian area (Algeria–Tunisia). For the first area, a supported evaluation is due to be published soon [33]. It is for the second area that an analysis of diversity and endemism is discussed in this present paper.
Based on the only exhaustive references relating to the flora of Algeria [34,35], a data matrix of the flora of northern Algeria was constructed. For the present analysis, we considered strictly Algerian endemism and border endemism on the one hand, and rarity of species on the other hand. Among the 20 phytogeographical sectors described for Algeria [34,35], the 15 northern sectors under Mediterranean influence were considered here. The biodiversity evaluation is given by a cumulated index translating at the same time the partial taxonomic richness of a sector (more or less rare species) and its total species richness of endemic plants.
This endemism is composed of Algerian endemism (224 species), Algerian and Moroccan endemism (124 species), Algerian and Tunisian endemism (58 species), and Algerian and Sicilian endemism (1 species). The sectors with the highest endemism in absolute values are the Oran's coast (O1: 103 species) and Small Kabylia (K2: 101 species). They are followed by the Hills of Tlemcen (O3: 94 species), the Great Kabylia (K1: 86 species), the Hills of Constantine (C1: 83 species) and the High Plains (H1: 82 species). For endemism, the K2 sector (Small Kabylia) appears as rich as, and even richer than, the sectors O1 or O3, and it is followed closely by the neighbouring sectors (K1 and C1).
For the 1635 more or less rare species within the whole study area, the most diversified sectors are K2 (487 species), followed by K3 and K1 (467 species each). For these three sectors, coastal Numidia (K3) has the highest number of rarest species, while K2 and K1 arrive at the head for the relatively rare species. The other diversified sectors are the surroundings of Algiers (A1: 433 species), the Hills of Tlemcen (O3: 421 species), the Oran's coast (O1: 397 species), the mountains close to Algiers (A2: 365 species) and the Hills of Constantine (C1: 357 species).
Calculations of the biodiversity index illustrate clearly that Small Kabylia (K2) and nearby sectors (K1 and K3) have the highest biodiversity index, and are superior to those of Oran's coast (O1) and the Hills of Tlemcen (O3), which represent the eastern end of the regional hotspot known as the ‘Baetic–Rifan complex’ [18,46]. This index synthesises the prevalence of the K1–K2–K3 sectors with regard to endemism and diversity. Furthermore, results illustrate the high floristic originality of these three sectors and thus highlight the highest patrimonial value for the 15 sectors.
The great heterogeneity of natural habitats explains the ecological diversity and its dependent floristic richness: the coastline is composed of beaches, dunes, rocks or cliffs, the alluvial plains have various fields, marshes, or lakes, and the mountains are among the highest of the country. These biotopes show extremely diversified and rich landscapes and ecosystems.
As in other parts of the Mediterranean basin, the richest sectors in endemic and rare species correspond to areas of tectonic-plate collision [20]. In the light of the given arguments, these mountainous and coastal habitats are identified as a vast regional hotspot centred on Small Kabylia (K2), which extends from the surroundings of Algiers (Mitidja area) to the Tunisian border (Kroumiria). This additional hotspot, which can be added to the ten already identified hotspots in the Mediterranean basin [18], which we name ‘Kabylies–Numidia–Kroumiria’, belongs to a larger biogeographical unit, which includes the major part of the Algerian–Tunisian Tell. The individualisation of this hotspot, in a rich and diversified geological context, is corroborated by recent molecular studies on plants as well as other studies on various taxonomic groups [48,51,52,54,55,58–60].
This evaluation will have to be translated, on a national scale as well as on an international one, by implementing new legal, technical, and financial rules for conservation, and the reinforcement of existing ones.
1 Introduction
Mis à part les dernières grandes régions sauvages encore préservées (forêts vierges équatoriales, dont l'Amazonie), près de la moitié du reste de la biodiversité mondiale se concentre au sein de 34 « points chauds », ou hotspots [1,2]. Ces points chauds sont caractérisés tant par leur richesse spécifique et leur taux d'endémisme [3,4] que par les menaces anthropiques grandissantes [5]. Ainsi, la plupart de ces points chauds identifiés se rencontrent dans des zones où la démographie est forte et la pression humaine en augmentation rapide [6]. Toutes les zones à climat de type « méditerranéen » (Australie méridionale, région du Cap, Chili, Californie, Méditerranée), sont ainsi considérées comme des points chauds [2,7]. Au-delà des biomes terrestres, l'étude des points chauds se généralise à l'ensemble de la biosphère : points chauds de biodiversité souterraine dans les grottes et réseaux karstiques [8], de biodiversité marine dans les zones de récifs tropicaux [9], de diversité des chaînes trophiques dans les zones pélagiques des océans [10], etc.
Le point chaud du Bassin méditerranéen [11,12] est un centre d'endémisme et une région à forte biodiversité actuelle, vraisemblablement en lien étroit et complexe avec ses fonctions passées de refuges glaciaires [13] et celles de refuges actuels [14]. La proximité latitudinale avec les zones tempérées plus froides, d'une part, et avec les zones tropicales, d'autre part, s'associe à la complexité de leurs reliefs, qui produisent des effets orographiques sur les nombreuses facettes locales du climat. À cause de sa paléogéographie complexe et mouvementée, et de l'histoire des modes d'occupation par l'homme tout aussi diversifiée, les diversités alpha (richesse spécifique locale) et béta (hétérogénéité et complémentarité entre localités voisines) sont très élevées [15,16]. L'ensemble du Maghreb méditerranéen, majoritairement représenté par l'Algérie, est donc au cœur de ces préoccupations mondiales en matière de biologie de la conservation : richesse taxonomique avérée, fort endémisme végétal et menaces anthropiques croissantes.
Dans un contexte d'extinction sans précédent [17], l'identification des aires majeures de biodiversité au sein du vaste point chaud méditerranéen a été étudiée [18]. En effet, cette richesse n'est pas uniformément distribuée, notamment du fait des facteurs historiques et paléogéographiques [19,20]. Médail et Quézel [18] ont alors pu définir les dix « zones rouges » régionales suivantes : les îles Canaries et Madère, l'Atlas marocain, le complexe de l'arc Bético-Rifain, les Alpes maritimes et ligures, les îles Tyrrhéniennes, la Grèce continentale, la Crète, l'ensemble Taurus turc et Chypre, l'axe Syrie–Liban–Israël, la Cyrénaïque. Toutefois, l'hétérogénéité des connaissances floristiques selon les pays, et surtout l'irrégularité de leur actualisation, laisse à penser que certains secteurs demeurent sous-évalués.
Les analyses de diversité d'espèces et des modèles d'endémisme fournissent les entrées essentielles pour la planification de la conservation. Par conséquent, si l'on prend l'exemple des pays tropicaux, le fait que ces régions très riches soient mal étudiées constitue un important frein à la conservation de la biodiversité, car les modèles théoriques peuvent difficilement être considérés [21]. En effet, pour élaborer des stratégies de conservation, et espérer conserver efficacement la biodiversité, il faut tout d'abord évaluer l'enjeu de manière précise : « Fournir des informations sur le statut de la biodiversité est une première étape critique, qui met en évidence la sévérité du problème et encourage les sociétés à commencer à assumer la responsabilité de leurs actions » [22]. C'est dans cette optique que ce travail envisage de mieux caractériser les secteurs de biodiversité végétale au Maghreb méditerranéen et d'en évaluer la valeur patrimoniale à une échelle internationale.
2 Problématique de l'étude
2.1 L'estimation quantitative de la biodiversité
Généralement, pour des raisons pratiques, nécessitant un niveau de connaissance suffisant, seuls sont pris en compte, dans les évaluations de la biodiversité, les Vertébrés, chez les groupes animaux, et les Trachéophytes (plantes vasculaires), chez les groupes végétaux. Une analyse des points chauds « les plus chauds » (hottest hotspots) a été faite en suivant cinq facteurs tels que le nombre de plantes et de Vertébrés endémiques, le rapport endémiques/surface pour chacun des deux groupes, et la disparition des habitats [5]. Il en ressort que, parmi les huit points les plus chauds (Madagascar, les Philippines, le Sundaland, la forêt atlantique brésilienne et les Caraïbes, les Andes tropicales et le Bassin méditerranéen) figure le pourtour méditerranéen, qui abrite un total exceptionnel de 13 000 plantes endémiques.
Quantitativement, l'étude de la biodiversité à travers le seul groupe des plantes vasculaires (Trachéophytes) est une approximation intéressante. En effet, plusieurs auteurs [23,24] ont montré combien la richesse en insectes était linéairement corrélée à celle en plantes vasculaires (avec un coefficient de corrélation
Ainsi, avec plus de 25 000 à 30 000 espèces et sous-espèces selon les auteurs [25,26], le Bassin méditerranéen figure parmi les régions les plus riches du monde et à taux d'endémiques élevé, avoisinant 50% [18] ; il possède, de plus 4,3% des plantes de toute la planète [5], pour une superficie relative extrêmement modeste.
Cette richesse spécifique cumulée se répartit assez régulièrement à travers l'ensemble du bassin, avec, le plus souvent, une valeur comprise entre 1500 et 2000 espèces pour 10 000 km2 [27]. Il est cependant possible de délimiter, selon les auteurs [27,28], huit à dix secteurs à haute richesse floristique, dont la richesse spécifique varie entre 2000 et 3000 espèces pour 10 000 km2, valeur dépassée seulement pour certaines zones intertropicales, la région du Cap et celle de Perth, en Australie [27].
2.2 L'endémisme en Méditerranée
Si l'ensemble du Bassin méditerranéen renferme près de 50% d'endémisme spécifique ou subspécifique chez les plantes vasculaires [18], celui-ci n'est pas aussi uniformément réparti que la richesse spécifique. En effet, il se concentre en particulier dans des secteurs à haut niveau d'endémisme régional, qui sont préférentiellement [20] :
- – dans les zones de collisions de plaques (chaînes de montagnes et grandes failles tectoniques) ;
- – les grandes îles actuelles (Corse, Sicile, Crète, Chypre...) ou les anciennes îles rattachées au bloc continental (Calabre, Kabylies...) ;
- – sur des roches sédimentaires (calcaires ou dolomitiques) et ophiolitiques (croûte océanique émergée).
L'analyse de cet endémisme végétal [20], révèle des caractéristiques particulières. Seulement 10% sont des taxons rudéraux (R) ou des compétiteurs (C) au sens des stratégies démographiques du modèle C–S–R de Grime [29]. Environ 40% présentent une adaptation partielle au stress de part leur stratégie mixte (CS, SR), tandis que les 50% restant sont des endémiques régionales issues d'adaptations strictes de tolérance au stress (S). Ainsi, l'endémisme rupicole (de type S) est surtout associé aux falaises dont la végétation est un climax édaphique stationnel, et se concentrera d'autant plus dans les zones de failles tectoniques et de collisions de plaques.
2.3 La recherche des points névralgiques ou « point chauds »
L'analyse des points chauds se décline habituellement [5] selon trois cibles principales : la richesse spécifique, l'endémisme et les menaces. La pertinence du choix de ces trois indices a récemment été reconnue pour leur complémentarité, et il a été démontré [30] que la plupart des points névralgiques de richesse spécifique, de menaces et d'endémisme ne possédaient pas la même distribution géographique à l'échelle mondiale.
À l'échelle du Bassin méditerranéen, nous ne possédons pas encore de mesure fiable de l'indice de « menace ». Même l'approximation consistant à comptabiliser le nombre d'espèces jugées menacées dans le groupe taxonomique étudié [30], n'est pas applicable ici. En effet, à ce jour, la seule liste globale de plantes menacées qui soit disponible reste la liste 1997 de l'UICN [31], et une analyse rapide du nombre d'espèces concernée par pays montre une énorme distorsion de ce nombre par rapport au niveau de connaissance par pays [32].
Comme initialement suggéré par Myers [3,4] à l'échelon mondial, l'analyse régionale du grand ensemble habituellement nommé « Bassin méditerranéen », et incluant les îles macaronésiennes, a été effectuée sur les plans de la richesse taxonomique [28] et du taux d'endémisme [20]. Médail et Quézel [18] ont ainsi abouti à une identification de dix points chauds régionaux combinant richesse et endémisme. Tous ces points chauds régionaux sont caractérisés par une richesse taxonomique exceptionnelle (au moins 2000 espèces pour 15 000 km2) ou un taux d'endémisme élevé (plus de 10, voire 20% de la flore locale), et le plus souvent les deux à la fois.
En plus de ces dix points chauds, deux régions n'ont pas encore retenu l'attention qu'elles méritent : le littoral et les archipels dalmates (Croatie) et la région de l'ancienne Numidie (Algérie–Tunisie).
Concernant la première région, Nikolić et al. [33] sont venus apporter une réponse argumentée. Le secteur dalmate était déjà référencé comme étant un centre de diversité reconnu du point de vue de sa richesse taxonomique [28], mais avait été sous-estimé quant à son taux d'endémisme [18]. Nikolić et al. [33] ont montré que l'ensemble du secteur combine, au sud, dans les archipels, un taux d'endémisme remarquable, et au nord, sur le continent, une richesse taxonomique exceptionnelle, ces deux phénomènes étant liés à une particularité de la ligne de rivage pendant la dernière glaciation.
C'est pour la deuxième région que nous proposons une analyse argumentée de la diversité et de l'endémisme. En effet, le secteur des Kabylies et du littoral de l'antique Numidie (jusqu'à la Kroumirie) a déjà été référencé comme étant un centre d'endémisme [18], mais n'a pas été retenu comme secteur à forte biodiversité [28]. De plus, Quézel et Médail [14] ont par la suite reconnu ce même secteur comme une zone refuge actuelle, accueillant des végétaux ligneux relictes, d'origine tertiaire. La méconnaissance quantitative de la biodiversité de ces flores locales est peut-être responsable de cette sous-estimation.
3 Matériel et méthodes
3.1 Référentiel de données
La seule référence exhaustive qui concerne la flore d'Algérie est celle de la « nouvelle flore d'Algérie et des régions désertiques méridionales » de Quézel et Santa [34,35]. Aucune flore plus récente, ni aucune révision à cette flore n'a été entreprise à ce jour. Pour la Tunisie, la seule flore complète disponible date de la même période, bien que sa parution fût plus étalée [36–38] et utilisât globalement la même conception systématique.
Il se trouve que la quasi-totalité de la flore tunisienne est incluse dans celle d'Algérie, et que la région la plus à même de refléter les richesses du Nord-Est algérien est la région frontalière de Kroumirie, dont le taux d'endémisme strict est quasi nul comparé à l'endémisme partagé avec l'Algérie voisine. Ainsi, notre évaluation ne portera que sur le territoire algérien.
D'un point de vue nomenclatural et systématique, une révision de toute la flore d'Afrique du Nord et des îles Canaries est cependant en cours [39]. Très utile sur le plan taxonomique, elle nous est malheureusement très insuffisante quant à la chorologie des taxons, limitée à leur présence par pays. Il en est de même pour le projet Euro+Med Plant Base (voir http://www.emplantbase.org/home.html), encore inachevé.
3.2 L'endémisme
La mention de l'endémisme dans la flore de Quézel et Santa [34,35] se fait de plusieurs façons. Lorsque le taxon est considéré comme endémique d'Algérie, il est signalé par la mention simple « endémique » (noté End.). L'endémisme est également mentionné lorsqu'il est commun avec un territoire voisin qui est alors précisé (Rif, Maroc, Tunisie, Sicile...). Enfin, deux autres types d'endémisme sont mentionnés sans autre précision, l'endémisme nord africain (noté N.A.) et l'endémisme saharien (noté Sah.).
Nous ne retiendrons dans ce travail que l'endémisme strictement algérien et l'endémisme frontalier (en commun avec un seul autre pays, généralement le Maroc ou la Tunisie), tels que ceux mentionnés par Quézel et Santa [34,35], et sans vérification ni correction de la donnée. Pour ce qui est des endémismes « nord-africain » et « saharien », il nous a fallu préciser cette information, qui s'est parfois révélée correspondre à un endémisme frontalier binational, bien que, la plupart du temps, il correspondît à trois pays ou plus. Pour cela, nous avons utilisé de préférence les travaux inédits de Dobignard [39], complétés lorsque cela était nécessaire par la consultation de flores récentes concernant les territoires concernés, notamment le Nord du Maroc [40] et la Tunisie [41].
3.3 La rareté
La mention de l'abondance ou de la rareté dans la flore de Quézel et Santa [34,35] se fait par un indice unique, précédant la répartition au sein du territoire national (cf. Section 3.4). Cet indice possède huit niveaux allant de « extrêmement rare » (RRR) à « extrêmement commun » (CCC). Ils sont basés sur une évaluation subjective de la connaissance accumulée à cette époque par les auteurs, d'une part, et leurs prédécesseurs, d'autre part, dont toutes les observations sont rassemblées dans l'œuvre de René Maire [42], publiée à titre posthume et malheureusement demeurée incomplète.
Nous retiendrons dans notre analyse les quatre niveaux qui correspondent à une rareté plus ou moins grande : RRR, RR (très rare), R (rare) et AR (assez rare). Nous avons exclu les taxons que Quézel et Santa [34,35] signalaient eux-mêmes comme adventice sur le territoire algérien. Précisons que, dans de rares cas, l'indice de rareté n'est pas mentionné, et il nous a fallu le compléter. Pour cela, nous nous sommes inspirés des autres indications (répartition mais aussi écologie) et de notre propre connaissance de la plante, le cas échéant. Hormis ces apports ponctuels, méthodologiquement indispensables pour garantir une homogénéité de l'information, aucune modification des données originales n'a été effectuée, afin de ne pas introduire un biais supplémentaire à celui des auteurs de ladite flore.
Dans cette étude, nous appellerons donc « zone refuge » (au sens large) chaque portion du territoire qui est en mesure d'abriter une ou plusieurs espèces « rares » (au sens large). Il peut s'agir d'une limite d'aire à l'échelle des frontières administratives, bien qu'en continuité écologique, ou au contraire d'une réelle rareté à l'échelle du même territoire. Dans ce dernier cas, il peut s'agir d'une espèce répandue au sein d'une aire vaste, mais disjointe ou fragmentée et qui trouve ici son habitat particulier (refuge écologique), ou, au contraire, d'une espèce endémique locale (refuge biogéographique).
3.4 Les secteurs phytogéographiques
L'Algérie se compose de deux sous-ensembles, le « Tell » au sens large (c'est-à-dire l'Algérie du Nord) et le Sahara algérien (c'est-à-dire les régions désertiques méridionales).
L'Algérie a été découpée par Quézel et Santa [34] en 20 secteurs phytogéographiques, dont 15 pour l'Algérie du Nord (Fig. 1). Ce sont ces 15 secteurs qui seront retenus pour l'interprétation des résultats de notre analyse :

Définition des secteurs phytogéographiques du Nord de l'Algérie (« carte 2 », in : Quézel et Santa, 1962 : 12–13).
- – O1, O2, O3, respectivement : les collines du littoral oranais, les plaines de l'arrière-littoral oranais dont la Macta, les monts de Tlemcen et autres montagnes du Tell oranais ;
- – A1, A2, respectivement : les collines et le littoral du proche Algérois, incluant la Mitidja, les montagnes du Tell algérois ;
- – K1, K2, K3, respectivement : la Grande Kabylie, la Petite Kabylie, incluant la Kabylie de Collo, la Numidie littorale ceinturant les villes de Annaba (ex-Bône) et El Kala (ex-La Calle) ;
- – C1 : les collines du Tell constantinois, incluant les montagnes de l'axe Bibans/Hodna/Bellezma ;
- – H1, H2, Hd respectivement : les hautes plaines de l'ouest (du Sud oranais au Sud algérois), les hautes plaines de l'est (Sud constantinois), la plaine du Hodna (enclave nord-saharienne) ;
- – AS1, AS2, AS3, respectivement : l'Atlas saharien occidental (région d'Aïn Sefra), l'Atlas saharien central (région de Djelfa), les Aurès et l'Atlas saharien oriental (région de Tébessa).
En général, les secteurs ne sont pas renseignés pour les espèces communes, mais le sont pour les espèces rares (presque toujours pour les niveaux de rareté RRR à RR, encore assez souvent pour les niveaux de rareté R à AR). Lorsqu'ils ne sont pas renseignés, une description sommaire précise leur répartition en Algérie (dans tout le nord, sur le littoral oranais, dans le tell algéro-constantinois, les hautes plaines, etc.), et il est alors assez facile de compléter la donnée manquante sans introduire trop d'incertitude. Ainsi pour les espèces endémiques communes, des apports ponctuels ont été introduits.
En revanche, compléter les données sectorielles manquantes pour toutes les plantes (et donc surtout les plus communes) aurait introduit un grand biais supplémentaire, et nous nous y sommes refusés. Ainsi, là encore, hormis quelques rajouts méthodologiques indispensables, aucun biais significatif n'a été ajouté à ceux déjà présents dans les données originales de ladite flore.
3.5 Évaluation de la biodiversité
Pour chaque secteur phytogéographique méditerranéen au sens large, l'évaluation quantitative de sa biodiversité se fera selon deux entrées : l'endémisme et la rareté. Pour chaque secteur, un cumul de tous les taxons remplissant l'une ou l'autre des conditions est effectué. D'une part, le calcul du nombre de taxons s'effectuera sans double compte des taxons à la fois rares et endémiques ; d'autre part, un indice de diversité sera calculé en effectuant des doubles comptes si nécessaire. La valeur de cet indice cumulé traduira ainsi à la fois la richesse taxonomique globale d'un secteur et sa richesse en taxons endémiques.
L'inventaire exhaustif de la flore n'étant pas disponible pour chaque secteur, la diversité taxonomique exhaustive n'est pas quantifiable et le calcul du taux d'endémisme n'est pas possible. Comme approximation, nous utiliserons le calcul en valeur brute du nombre d'endémiques référencés pour chaque secteur, en posant l'hypothèse que le nombre d'espèces végétales plus ou moins rares et la richesse spécifique totale sont fortement corrélés. Une telle corrélation a été démontrée chez les insectes entre espèces en danger et richesse totale [43] et reste, dans notre cas, le critère le plus fiable pour quantifier à partir des données partielles actuellement disponibles. L'utilisation des espèces rares peut donc servir de substitut approprié, tandis que l'utilisation des seuls points chauds d'endémisme ne peut pas couvrir la richesse totale de la biodiversité, car ces derniers centres d'endémisme et de diversité ne coïncident pas forcément [44,45].
Une matrice globale renfermant les 3744 taxons répertoriés dans la flore de Quézel et Santa [34,35] a été élaborée (cf. annexes A et B). Chaque espèce est renseignée pour son endémisme et sa rareté au sein des 20 secteurs phytogéographiques. Seules les espèces ayant un niveau de rareté allant de RRR à AR et les espèces endémiques rares ou communes, appartenant aux 15 secteurs phytogéographiques retenus, sont prises en considération. L'évaluation géographique de la biodiversité de l'Algérie du Nord a ainsi porté sur 1720 taxons (cf. annexes A et B).
Extrait de la matrice de données brutes concernant la distribution des taxons retenus par type d'endémisme et par secteur phytogéographique (selon [34,35], modifié)
| Secteur | Total taxons | (taxons renseignés) | Algérie | Algérie + Libye | Algérie + Maroc | Algérie + Niger | Algérie + Sicile | Algérie + Tunisie | Non endémique | (endémiques sensu lato) |
| O1 | – | 439 | 58 | 0 | 36 | 0 | 0 | 9 | 336 | 103 |
| O2 | – | 319 | 37 | 0 | 30 | 0 | 0 | 7 | 245 | 74 |
| O3 | – | 450 | 41 | 0 | 46 | 0 | 0 | 7 | 356 | 94 |
| A1 | – | 469 | 38 | 0 | 17 | 0 | 0 | 18 | 397 | 73 |
| A2 | – | 399 | 32 | 0 | 22 | 0 | 0 | 16 | 329 | 70 |
| K1 | – | 502 | 44 | 0 | 18 | 0 | 1 | 23 | 416 | 86 |
| K2 | – | 525 | 56 | 0 | 19 | 0 | 1 | 25 | 424 | 101 |
| K3 | – | 502 | 36 | 0 | 9 | 0 | 0 | 31 | 426 | 76 |
| C1 | – | 395 | 40 | 0 | 16 | 0 | 1 | 26 | 312 | 83 |
| H1 | – | 280 | 38 | 0 | 37 | 0 | 0 | 7 | 198 | 82 |
| H2 | – | 179 | 19 | 0 | 14 | 0 | 0 | 14 | 132 | 47 |
| Hd | – | 66 | 4 | 0 | 4 | 0 | 0 | 4 | 54 | 12 |
| AS1 | – | 236 | 18 | 0 | 36 | 0 | 0 | 1 | 181 | 55 |
| AS2 | – | 160 | 12 | 0 | 18 | 0 | 0 | 1 | 129 | 31 |
| AS3 | – | 308 | 29 | 0 | 19 | 0 | 1 | 12 | 247 | 61 |
| (N. Algérie) | – | 1720 | 224 | 0 | 124 | 0 | 1 | 58 | 1313 | 407 |
| SS1 | – | 123 | 18 | 0 | 16 | 0 | 0 | 4 | 85 | 38 |
| SS2 | – | 140 | 22 | 1 | 9 | 0 | 0 | 11 | 97 | 43 |
| SO | – | 50 | 8 | 0 | 9 | 0 | 0 | 0 | 33 | 17 |
| SC | – | 163 | 20 | 0 | 3 | 2 | 0 | 2 | 136 | 27 |
| SM | – | 25 | 2 | 0 | 0 | 0 | 0 | 0 | 23 | 2 |
| (Sahara) | – | 306 | 50 | 1 | 23 | 2 | 0 | 12 | 218 | 88 |
| Tous secteurs | 3744 | 1919 | 264 | 1 | 136 | 2 | 1 | 60 | 1456 | 464 |
Extrait de la matrice de données brutes concernant la distribution des taxons retenus par niveau de rareté/abondance et par secteur phytogéographique (selon [34,35], modifié)
| Secteur | Total taxons | (taxons renseignés) | RRR(x), RR(x) | RRR | RR ? | RR | R | AR | AC | C | CC | CCC | (+/– rares) | (+/– communs) |
| O1 | – | 439 | 0 | 5 | 0 | 82 | 199 | 111 | 15 | 17 | 9 | 1 | 397 | 42 |
| O2 | – | 319 | 0 | 1 | 0 | 32 | 143 | 108 | 12 | 13 | 9 | 1 | 284 | 35 |
| O3 | – | 450 | 1 | 3 | 0 | 62 | 229 | 126 | 10 | 10 | 8 | 1 | 421 | 29 |
| A1 | – | 469 | 2 | 6 | 0 | 120 | 185 | 119 | 13 | 16 | 8 | 0 | 433 | 37 |
| A2 | – | 399 | 1 | 0 | 0 | 48 | 174 | 142 | 15 | 12 | 7 | 0 | 365 | 34 |
| K1 | – | 502 | 0 | 2 | 0 | 74 | 231 | 160 | 17 | 12 | 6 | 0 | 467 | 35 |
| K2 | – | 525 | 0 | 3 | 0 | 92 | 242 | 150 | 17 | 15 | 6 | 0 | 487 | 38 |
| K3 | – | 502 | 1 | 9 | 0 | 130 | 206 | 121 | 15 | 14 | 6 | 0 | 467 | 35 |
| C1 | – | 395 | 0 | 1 | 0 | 59 | 174 | 123 | 15 | 15 | 8 | 0 | 357 | 38 |
| H1 | – | 280 | 0 | 2 | 0 | 48 | 121 | 86 | 10 | 7 | 6 | 0 | 257 | 23 |
| H2 | – | 179 | 0 | 0 | 0 | 20 | 73 | 66 | 11 | 6 | 3 | 0 | 159 | 20 |
| Hd | – | 66 | 0 | 0 | 0 | 5 | 30 | 27 | 2 | 1 | 1 | 0 | 62 | 4 |
| AS1 | – | 236 | 0 | 2 | 0 | 33 | 108 | 78 | 8 | 5 | 2 | 0 | 221 | 15 |
| AS2 | – | 160 | 0 | 1 | 0 | 15 | 72 | 63 | 5 | 3 | 1 | 0 | 151 | 9 |
| AS3 | – | 308 | 0 | 2 | 0 | 48 | 144 | 100 | 8 | 4 | 2 | 0 | 294 | 14 |
| (N. Algérie) | – | 1720 | 5 | 34 | 0 | 584 | 705 | 302 | 47 | 29 | 13 | 1 | 1630 | 90 |
| SS1 | – | 123 | 0 | 0 | 0 | 22 | 44 | 41 | 10 | 6 | 0 | 0 | 107 | 16 |
| SS2 | – | 140 | 0 | 0 | 0 | 32 | 58 | 37 | 7 | 6 | 0 | 0 | 127 | 13 |
| SO | – | 50 | 0 | 0 | 0 | 6 | 23 | 15 | 3 | 3 | 0 | 0 | 44 | 6 |
| SC | – | 163 | 0 | 4 | 0 | 62 | 69 | 23 | 4 | 1 | 0 | 0 | 158 | 5 |
| SM | – | 25 | 0 | 0 | 2 | 7 | 10 | 6 | 0 | 0 | 0 | 0 | 25 | 0 |
| (Sahara) | – | 308 | 0 | 4 | 2 | 95 | 129 | 57 | 15 | 6 | 0 | 0 | 285 | 21 |
| tous secteurs | 3744 | 1919 | 5 | 38 | 2 | 663 | 783 | 327 | 55 | 32 | 13 | 1 | 1818 | 101 |
Ces quelques précisions et limites méthodologiques étant posées, il nous est alors possible de comparer la richesse de chaque secteur phytogéographique du Nord de l'Algérie, ou « Algérie méditerranéenne ».
4 Résultats
4.1 Secteurs d'endémismes
Le nombre de taxons endémiques pour l'Algérie du Nord est 407, dont 338 au rang d'espèce et seulement 48 et 21 aux rangs de sous-espèce et de variété. Pour mémoire, les taxons endémiques ou subendémiques sont au nombre de 464 (387 espèces, 53 sous-espèces et 24 variétés) pour l'ensemble du territoire national (cf. annexe A).
Pour l'Algérie du Nord, l'endémisme en valeur brute se décompose de la manière suivante :
- – endémisme algérien strict : 224 taxons ;
- – endémisme algéro-marocain : 124 taxons ;
- – endémisme algéro-tunisien : 58 taxons ;
- – autres : Algérie + Sicile (1 taxon).
L'analyse de la répartition de cet endémisme, tous niveaux de rareté confondus, et tous types confondus, au niveau des 15 secteurs phytogéographiques de l'Algérie du Nord, permet d'identifier les secteurs à valeur patrimoniale les plus intéressants (Tableau 1).
Répartition des types d'endémisme par secteur phytogéographique, d'après [34,35], modifié
| Secteur | O1 | K2 | O3 | K1 | C1 | H1 | K3 | O2 | A1 | A2 | AS3 | AS1 | H2 | AS2 | Hd |
| Algérie | 58 | 56 | 41 | 44 | 40 | 38 | 36 | 37 | 38 | 32 | 29 | 18 | 19 | 12 | 4 |
| Algérie + Maroc | 36 | 19 | 46 | 18 | 16 | 37 | 9 | 30 | 17 | 22 | 19 | 36 | 14 | 18 | 4 |
| Algérie + Sicile | 0 | 1 | 0 | 1 | 1 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 |
| Algérie + Tunisie | 9 | 25 | 7 | 23 | 26 | 7 | 31 | 7 | 18 | 16 | 12 | 1 | 14 | 1 | 4 |
| Total taxons endémiques | 103 | 101 | 94 | 86 | 83 | 82 | 76 | 74 | 73 | 70 | 61 | 55 | 47 | 31 | 12 |
Les secteurs à endémisme le plus élevé en valeur brute sont O1 (103 taxons) et K2 (101 taxons). Ensuite, viennent d'autres secteurs à endémisme encore assez élevé, comme O3 (94 taxons), K1 (86 taxons), C1 (83 taxons), H1 (82 taxons). Puis suivent un grand nombre de secteurs à endémisme de plus en plus modéré, que sont K3, O2, A1, A2, AS3, AS1, H2. Enfin, les secteurs à nombre d'endémiques les plus faibles sont AS2 et Hd.
La Petite Kabylie (K2) apparaît donc aussi riche, voire plus riche en endémisme (valeur brute) que les secteurs du littoral oranais (O1) ou des monts de Tlemcen (O3), qui appartiennent au point chaud du complexe bético-rifain [18,46]. Elle est suivie de près par les secteurs voisins de la Grande Kabylie (K1) et du Tell constantinois (C1).
4.2 Secteurs de rareté
Pour l'Algérie du Nord, 1630 taxons plus ou moins rares ont été retenus, dont 1034 au rang d'espèce puis 431 et 170 aux rangs de sous-espèce et variété. Pour mémoire, les taxons plus ou moins rares sont au nombre de 1818 (1185 espèces, 455 sous-espèces et 178 variétés) pour l'ensemble du territoire national (cf. annexe B).
Tous niveaux de rareté confondus, le nombre de taxons au niveau des 15 secteurs phytogéographiques du Nord de l'Algérie permet d'identifier les secteurs à valeur patrimoniale élevée (Tableau 2).
Répartition des niveaux de rareté par secteur phytogéographique, d'après [34,35], modifié
| Secteur | K2 | K1 | K3 | A1 | O3 | O1 | A2 | C1 | O2 | AS3 | H1 | AS1 | H2 | AS2 | Hd |
| AR | 150 | 160 | 121 | 119 | 126 | 111 | 142 | 123 | 108 | 100 | 86 | 78 | 66 | 63 | 27 |
| R | 242 | 231 | 206 | 185 | 229 | 199 | 174 | 174 | 143 | 144 | 121 | 108 | 73 | 72 | 30 |
| RR | 92 | 74 | 130 | 120 | 62 | 82 | 48 | 59 | 32 | 48 | 48 | 33 | 20 | 15 | 5 |
| RRR | 3 | 2 | 9 | 6 | 3 | 5 | 0 | 1 | 1 | 2 | 2 | 2 | 0 | 1 | 0 |
| RR(x), RRR(x) | 0 | 0 | 1 | 2 | 1 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Total taxons rares | 487 | 467 | 467 | 432 | 421 | 397 | 365 | 357 | 284 | 294 | 257 | 221 | 159 | 151 | 62 |
Il ressort que les secteurs les plus diversifiés en espèces rares sont K2 (487 taxons) suivi de K3 et K1 (467 taxons). Les autres secteurs diversifiés sont A1 (432 taxons), O3 (421taxons), O1 (397 taxons), A2 (365 taxons), C1 (357 taxons). Des secteurs encore assez diversifiés sont AS3 (294 taxons) et O2 (284 taxons). Les secteurs modérément à peu diversifiés sont H1 (257) et AS1 (221), puis H2 (159), AS2 (151) et Hd (62).
Ainsi, la Petite Kabylie (K2) et les secteurs voisins de la Grande Kabylie (K1) et de Numidie littorale (K3) sont tous les trois bien plus riches en taxons plus ou moins rares (et vraisemblablement en taxons, tous niveaux de diversité confondus) que les autres secteurs du pays. Cette remarque s'applique vraisemblablement à l'ensemble de la flore vasculaire, puisque notre analyse a porté sur environ la moitié des taxons de la flore d'Algérie. Ces trois secteurs sont suivis de près par les secteurs du littoral oranais (O1) et des monts de Tlemcen (O3), lesquels appartiennent au point chaud du complexe bético-rifain [18,46].
L'ensemble des secteurs K1, K2 et K3 se distingue par le nombre de taxons rares le plus élevé (tous les niveaux de rareté confondus). Ils sont suivis par les secteurs O1, O3 (du complexe bético-rifain), mais aussi par les secteurs A1, A2 et C1, qui les prolongent géographiquement.
Cette richesse remarquable en espèces rares au niveau des secteurs K3, O2 et A1 s'explique par la diversité et la rareté des habitats qui constituent ces secteurs : complexes de Guerbès–Senhadja et El Kala en Numidie littorale (K3), plaine de la Macta en Oranie (O2), cordons dunaires littoraux et, surtout, vaste plaine humide de la Mitidja (A1). Notons que c'est avec le secteur de la Numidie orientale (K3) que la plaine de la Mitidja (A1) possédait le plus d'affinités écologiques et biogéographiques.
4.3 Biodiversité par secteurs
Le calcul effectué ici cumule le nombre de taxons « plus ou moins rares » et/ou « endémiques au sens large » de chaque secteur phytogéographique, tout d'abord sans double compte (richesse taxonomique), puis en effectuant des doubles comptes pour les taxons qui sont à la fois rares et endémiques ( « indice de biodiversité », cf. Section 3.5).
Pour l'Algérie du nord, les 1720 taxons rares et/ou endémiques retenus se répartissent au niveau des 15 secteurs phytogéographiques de l'Algérie du Nord, de la façon suivante (Tableau 3).
Calcul de l'indice de biodiversité à partir du nombre de taxon rare et/ou endémiques par secteur phytogéographique, d'après [34,35], modifié
| Secteur | K2 | K1 | K3 | O3 | A1 | O1 | C1 | A2 | O2 | AS3 | H1 | AS1 | H2 | AS2 | Hd |
| Taxons endémique s.l. | 101 | 86 | 76 | 94 | 73 | 103 | 83 | 70 | 74 | 61 | 82 | 55 | 47 | 31 | 12 |
| Taxon plus ou moins rare | 487 | 467 | 467 | 421 | 432 | 397 | 357 | 365 | 284 | 294 | 257 | 221 | 159 | 151 | 62 |
| (de RRR à AR) | |||||||||||||||
| Taxon rare et/ou endémique | 525 | 502 | 502 | 450 | 469 | 439 | 395 | 399 | 319 | 308 | 280 | 236 | 179 | 160 | 66 |
| (sans double compte) | |||||||||||||||
| Indice de biodiversité | 588 | 553 | 543 | 515 | 505 | 500 | 440 | 435 | 358 | 355 | 339 | 276 | 206 | 182 | 74 |
| (avec doubles comptes) |
Il ressort nettement que la Petite Kabylie (K2) et les secteurs voisins de la Grande Kabylie (K1) et de la Numidie littorale (K3) ont un indice de biodiversité maximal, supérieur même à celui des secteurs du littoral oranais (O1) et des monts de Tlemcen (O3), qui représentent l'extrémité orientale du point chaud du complexe bético-rifain [18,46]. Ces derniers secteurs ont un indice comparable à celui du proche Algérois (A1), avec cependant les réserves qui s'imposent si l'on considère que la diversité taxonomique de ce secteur a probablement fortement chuté au cours de ces dernières décennies, au vu des remarques évoquées au Section 5.
La richesse en taxons rares des secteurs K1, K2 et K3 (et sans doute leur richesse taxonomique globale) est également supérieure à celle des secteurs O1 et O3, tandis que leur richesse en taxons endémiques est comparable en valeur brute (donc sans doute moins élevée en valeur relative).
Cet indice de biodiversité synthétise la prédominance des secteurs K1–K2–K3 sur les plans de l'endémisme et de la diversité et fait ainsi ressortir la valeur patrimoniale la plus élevée des 15 secteurs considérés.
4.4 Relations entre rareté et endémisme
Cette analyse bibliographique de la flore d'Algérie nous fournit des résultats concernant la répartition géographique des taxons rares et/ou endémiques, mais aussi concernant la relation entre endémisme et rareté (Tableau 4).
Niveaux de rareté et types d'endémisme en Algérie du nord, d'après [34,35], modifié
| Niveau rareté/endémisme | RRR (x) RR (x) | RRR | RR | R | AR | AC | C | CC | CCC | Total | % taxons ± rares | dont% très rares | % taxons +/– communs |
| Algérie | 1 | 11 | 67 | 84 | 20 | 20 | 14 | 7 | 0 | 224 | 81,7 | 35,3 | 18,3 |
| Algérie + Maroc | 0 | 2 | 31 | 49 | 15 | 16 | 7 | 3 | 1 | 124 | 78,2 | 26,6 | 21,8 |
| Algérie + Tunisie | 0 | 0 | 10 | 16 | 10 | 11 | 8 | 3 | 0 | 58 | 62,1 | 17,2 | 37,9 |
| Algérie + Sicile | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 100 | 100 | 0 |
| Total subendémiques pays limitrophes | 0 | 2 | 42 | 65 | 25 | 27 | 15 | 6 | 1 | 183 | 73,2 | 23,6 | 26,8 |
| Total endémiques stricts et subendémiques | 1 | 13 | 109 | 149 | 45 | 47 | 29 | 13 | 1 | 407 | 77,9 | 30,2 | 22,1 |
| Non endémiques | 4 | 25 | 475 | 556 | 257 | – | – | – | – | 3028 | 43,5 | 16,6 | 56,5 |
| Total renseignés | 5 | 38 | 584 | 705 | 302 |
47
|
29
|
13
|
1
|
1720 | – | – | – |
| Total Flore | 5 | 38 | 584 | 705 | 302 | – | – | – | – | 3435 | 47,6 | 18,3 | 52,4 |
| (N-Algérie) | |||||||||||||
| % endémiques | 20 | 34,2 | 18,7 | 21,1 | 14,9 | – | – | – | – | 11,8 | 19,4 | 19,6 | 5,0 |
Dans l'ensemble, dans le Nord de l'Algérie, 11,8% de la flore est composée de taxons endémiques ou subendémiques. Chez les taxons très rares à plus ou moins rares, le pourcentage d'endémisme avoisine 20% (respectivement 19,6% et 19,4%), tandis que chez les taxons plus ou moins communs, il n'est que de 5%.
L'indice de rareté des endémiques d'Algérie au sens large est élevé. Plus de trois quart (77,9%) des taxons endémiques stricts d'Algérie ou subendémiques (Algérie + un pays limitrophe) sont des plantes plus ou moins rares en Algérie, les endémiques plus ou moins communes représentant moins du quart du total. Ce phénomène est encore plus marqué chez les endémiques strictes d'Algérie (81,7%), et un peu atténué chez les subendémiques partagées avec les territoires limitrophes (en moyenne 73,2%, tous types confondus). Parmi ces endémiques plus ou moins rares, près du tiers (30,2%) sont très rares à rarissimes, voire déjà disparues. Là encore, le phénomène est accentué chez les endémiques strictes (35,3%) par rapport aux subendémiques (en moyenne 23,6%, tous types confondus). Dans les deux cas, le niveau de rareté est le plus faible du coté des subendémiques algéro-tunisiennes (62,1% de taxons plus ou moins rares, dont 17,2% de très rares), tandis que chez les subendémiques algéro-marocaines (respectivement 78,2% et 26,6%) il reste proche du taux atteint par les endémiques algériennes strictes (respectivement 81,7% et 35,3%).
En résumé, les endémiques les plus rares sont surtout observées dans le secteur algérien strict (on pensera notamment aux endémiques restreints des sommets de Grande Kabylie, des forêts de Petite Kabylie, des collines oranaises, etc.). L'endémisme frontalier avec le Maroc, et plus encore celui avec la Tunisie, correspondent moins à des zones d'hyperendémisme spécialisé (excepté la région de Ghar-Rouban, entre Oujda et Tlemcen) qu'à de vastes zones biogéographiques où les espèces endémiques sont localement peu rares, voire abondantes.
5 Discussion générale
Nos résultats sur la répartition géographique des taxons rares et/ou endémiques confirment et complètent ceux de l'analyse préliminaire d'Amghar et Briki [47], réalisée à partir de la même source bibliographique [34,35] et selon une méthodologie très proche. La synthèse des points essentiels de cette analyse illustre l'originalité floristique de la Petite Kabylie (K2), complétée par celles de la Grande Kabylie (K1) et de la Numidie littorale (K3) voisines. Ces trois secteurs comprennent le nombre le plus élevé d'espèces plus ou moins rares (AR à RRR), la Numidie littorale (K3) étant en tête pour les espèces les plus rares (RR, RRR) tandis que La Petite et la Grande Kabylie (K2 et K1) arrivent en tête pour les espèces relativement rares (AR à R). Pour ce qui est de l'endémisme, la Petite Kabylie (K2) rivalise en tête avec les collines oranaises (O1), tandis que la Grande Kabylie arrive en quatrième position, à la suite des monts de Tlemcen (O3). L'analyse cumulée de ces deux paramètres que sont la rareté et l'endémisme, au travers du calcul d'un « indice de biodiversité », confirme ces résultats. Quant au proche Algérois (A1), son indice de biodiversité élevé est comparable à celui des secteurs de l'Oranie (O1 et O3) si l'on se réfère à l'évaluation faite par les auteurs de la flore vers le milieu du XXe siècle.
La richesse remarquable de tous ces secteurs peut s'expliquer par la présence de chaînes de montagnes parmi les plus élevées du pays (Djurdjura, 2308 m ; Babor, 1969 m) en contact direct avec le littoral méditerranéen. Ces données confirment, à échelle nationale, que les secteurs les plus riches en endémiques dans l'ensemble du Bassin méditerranéen correspondent aux zones de collisions de plaques [20]. Sur le terrain, l'hétérogénéité spatiale de la matrice des habitats naturels participe à enrichir de façon exceptionnelle la diversité écologique et spécifique : les milieux littoraux se déclinent en plages, criques ou falaises, les milieux continentaux sont de nature terrestre marécageuse ou aquatique, et les plaines, tout comme les montagnes, possèdent un panel intéressant de secteurs naturels encore sauvages, qui contrastent avec d'autres, plus ou moins fortement anthropisés par l'agriculture ou l'urbanisation.
À la lumière des résultats obtenus pour la présente étude, nous pouvons suivre la même démarche que celle de Médail et Quézel [18] concernant la définition des points chauds régionaux au sein du pourtour méditerranéen. Ainsi, les secteurs montagnards et littoraux centrés autour de la Petite Kabylie (K2) sont identifiés comme un vaste point chaud régional de biodiversité, allant du secteur algérois (Mitidja) jusqu'à la frontière tunisienne (Kroumirie). L'identification de ce point chaud supplémentaire en Méditerranée vient donc compléter la dizaine déjà identifiée [18] ainsi que celui suggéré par les travaux récents de Nikolić et al. [33] concernant le littoral dalmate. Essentiellement cantonné au littoral et à ses contreforts montagneux (Djurdjura, Babors, Edough...), des irradiations plus ou moins nettes de ce point chaud se font sentir vers l'intérieur des terres. Cependant, elles s'atténuent progressivement et leurs limites sont difficiles à préciser à partir du découpage sectoriel utilisé dans la présente évaluation. Les effets de ce point chaud sont encore identifiables vers l'Atlas de la Mitidja, le Zaccar et l'Ouarsenis à l'ouest, les Mogods à l'est, le Tell constantinois et le complexe Aurès/Bellezma, au sud. Ce point chaud, que nous nommerons « Kabylies–Numidie–Kroumirie » appartient donc à un plus vaste ensemble biogéographique naturel, qui correspond à une majeure partie du Tell algéro-tunisien (Fig. 2).
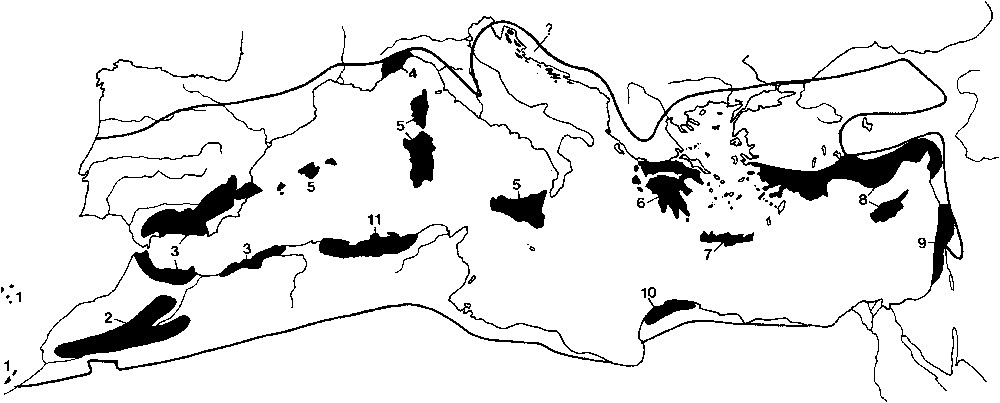
Délimitation géographique du point chaud « Kabylies–Numidie–Kroumirie » et positionnement au sein de l'ensemble de points chauds du « Bassin méditerranéen » (source : [18], modifié). 1, Madère et Canaries ; 2, Haut et Moyen Atlas ; 3, complexe bético-rifain ; 4, Alpes maritimes et ligures ; 5, îles tyrrhéniennes ; 6, Sud- et Centre-Grèce ; 7, Crète ; 8, Sud-Anatolie et Chypre ; 9, Syrie–Liban–Israël–Palestine ; 10, Cyrénaïque méditerranéenne ; 11, Kabylies–Numidie–Kroumirie (présent travail) ; ?, littoral et archipels dalmates (suggéré par Nikolić et al., soumis). Masquer
Délimitation géographique du point chaud « Kabylies–Numidie–Kroumirie » et positionnement au sein de l'ensemble de points chauds du « Bassin méditerranéen » (source : [18], modifié). 1, Madère et Canaries ; 2, Haut et Moyen Atlas ; 3, complexe ... Lire la suite
Cette région du Tell algéro-tunisien est d'ailleurs considérée comme un « refuge primaire » qui a fonctionné lors de la dernière glaciation [13], et ce malgré la rareté des évidences polliniques (probablement due aux rares études palynologiques et non pas au manque de sites propices).
Ce vaste ensemble est également caractérisé par une grande diversité géologique et géomorphologique. Par exemple, de par son appartenance au bloc tectonique Kabylies/Sicile/Calabre, la péninsule de l'Edough a subi un isolement géologique ancien. Après son raccordement au bloc continental durant le Miocène, les phases de transgression marine du Pliocène ont pu inonder les basses terres entourant la péninsule de l'Edough et formant une île temporaire [48]. Pour décrire ce phénomène biogéographique important, on parle souvent d' « île fossile continentale » [49]. En Europe méditerranéenne [49], mais aussi en Californie [50], le niveau d'endémicité de ces îles fossiles est élevé, tant chez divers groupes d'animaux continentaux (Gastéropodes, Isopodes, Coléoptères, et même parfois Vertébrés) que chez une majorité de plantes vasculaires. Dans cette île fossile du Pliocène, nous pouvons encore espérer trouver d'autres plantes et animaux endémiques [48].
L'individualisation de ce point chaud, dans un contexte géologique riche et diversifié, est confortée par des études récentes, aussi bien au niveau de groupes taxonomiques animaux que chez les plantes vasculaires.
Pour les groupes animaux, des travaux récents chez les Vertébrés méritent d'être relevés. L'amphibien Pleurodelus poireti (Gervais, 1835) a été récemment redéfini et limité aux seules populations du massif de l'Edough et de ses piémonts, tandis que les autres populations du Tell algéro-tunisien ont pu être rattachées à l'espèce méconnue Pleurodeles nebulosus (Guichenot, 1850), grâce à des observations morphologiques confirmées par un fort isolement génétique [48,51]. Cet isolement, ancien mais postérieur à la crise messinienne, a pu être estimé à 4,2 millions d'années [48]. Chez les Gastéropodes des genres Pomatias et Tudorella, des travaux comparables [52] ont montré le fort isolement génétique de la population relictuelle de T. sulcata « sensu lato » du cap de Garde à Annaba, située sur l'extrémité du massif de l'Edough.
Au sein du secteur de la Numidie littorale (K3), la péninsule de l'Edough est un massif montagneux littoral, particulièrement riche et encore sauvage. À l'originalité floristique déjà recensée pour les flores classiques d'Algérie [34,35] ou de Tunisie [36–38] viennent s'ajouter des particularités floristiques récemment mises en évidence. La composée Centaurea papposa (Cosson) Greuter, autrefois incluse dans une espèce centro-méditerranéenne (syn. : C. cineraria L. subvar. papposa (Cosson) Quézel et Santa) est désormais considérée comme une endémique rare, partagée entre le cap de Garde, en Algérie, et le cap Bon, en Tunisie [53]. Des recherches préliminaires sur les composées du genre Hypochaeris [54] ont d'ores et déjà permis d'affirmer la présence d'une lignée isolée de H. alliatae « sensu lato » (cf. Hypochaeris laevigata var. hipponensis Maire ?) dans le massif de l'Edough.
Les travaux de génétique et de phylogéographie initiés sur les chênes (Quercus sp.) à feuillage caducifolié d'Europe et du Bassin méditerranéen [13,55] ont montré la présence d'un haplotype récolté sur Quercus canariensis Willd. de la Petite Kabylie (K2) et endémique au Maghreb méditerranéen. Même si ces données restent fragmentaires, « d'autres analyses dans cette région pourraient révéler des liens phylogéographiques intéressants » [13]. On peut d'ores et déjà renforcer l'interprétation en mentionnant, outre la présence du taxon ibéro-maghrébin Quercus canariensis (syn. : Q. faginea subsp. baetica (Webb) Maire), celle d'une autre espèce, Quercus afares Pomel, strictement endémique à la Grande Kabylie (K1), à la Petite Kabylie (K2) et à la Kroumirie (Tunisie).
Ces observations sont corroborées par le cas du sapin de Numidie, Abies numidica Carrière. Sa répartition actuelle, limitée aux massifs de Babor et Tababort en Petite Kabylie (K2), est associée à la présence relictuelle en Afrique du Nord d'autres arbres d'origine tempérée ou tempérée froide (Populus tremula L., Acer campestre L., etc.) [56]. La présence de ces arbres a conduit à la notion de « zone refuge actuelle » [14]. Sa présence ancienne, durant le dernier maximum glaciaire du Würm vers 35 000 B.P. en Kroumirie, d'où il a disparu vers 4600 B.P. seulement [57], confirme également la présence d'un refuge glaciaire dans cette zone.
À ces éléments ligneux s'ajoutent de nombreux éléments herbacés, dont les plus célèbres sont la pivoine Paeonia mascula (L.) Miller susbp. atlantica (Cosson) Greuter & Burdet (syn. : Paeonia corallina subsp. atlantica (Cosson) Maire) et le cyclamen des Babors Cyclamen repandum var. baborense Debussche & Quézel (syn. C. repandum subsp. atlanticum Maire). Ce dernier constitue un témoin biogéographique aussi intéressant que méconnu [58], au statut taxonomique encore incertain, et actuellement en danger d'extinction dans son secteur d'indigénat [59].
L'orchidée Serapias stenopetala Maire et Stephenson, longtemps incluse par méconnaissance dans l'espèce méditerranéo-atlantique Serapias lingua L., vient d'être retrouvée en Algérie [60] et découverte en Tunisie [41], où elle est endémique des zones humides de Numidie littorale (K3) et de Kroumirie.
Enfin, les zones humides d'El Kala et de toute la Numidie littorale (K3) hébergent un ensemble aussi important qu'original de la flore algérienne. Plusieurs espèces constituent une poche d'éléments relictuels d'origine afro-tropicale [61], déjà remarquée par les botanistes du XIXe siècle [62]. Certains de ces éléments sont liés aux mares temporaires méditerranéennes et aux divers groupements qui les composent [63]. D'autres sont liés aux lacs permanents d'eau douce, comme Marsilea minuta L. (syn. : Marsilea diffusa var. algeriensis Trabut). La plupart, pour l'Algérie et souvent pour tout le Maghreb, sont spéciaux à la Numidie littorale (K3), ou plus rarement aux environs de Jijel en Petite Kabylie (K2), et autrefois en partie à la plaine de la Mitidja et au littoral algérois (A1).
Ce sont ces derniers milieux qui s'avèrent être les plus fragilisés. Les diverses menaces ont depuis longtemps détruit les zones humides et le littoral aux environs d'Alger au cours du XXe siècle (développement de l'agriculture, puis de l'urbanisation et du tourisme). Une nouvelle menace, très active et irréversible, est en train de détruire la flore et les écosystèmes de tout le secteur. Ceinturant Alger, la capitale, l'urbanisation anarchique actuelle de la Mitidja vient aujourd'hui poursuivre et achever la transformation de la plaine entamée au cours des XIXe et XXe siècles, lors de son assèchement et de sa mise en culture. Il en va de même du littoral sableux à l'ouest et à l'est d'Alger, et dans une moindre mesure de toutes les hauteurs de la ville ( « Sahel » d'Alger).
Certaines espèces étaient déjà portées disparues au milieu du XXe siècle, comme par exemple Moluccella spinosa L. [35], et de nombreuses autres ne nous paraissent plus avoir été revues depuis : on peut citer l'exemple de Aplenium hemionitis à Bouzaréah, et surtout de diverses hélophytes ou psammophytes signalées à El Harrach (ex-Maison-Carrée) et dans les environs devenus très urbanisés. Parmi elles, celles qui voyaient dans ce secteur leur unique station algérienne [34,35] étaient au nombre de 29, et il serait urgent d'entreprendre un inventaire exhaustif de l'agglomération et des campagnes algéroises afin d'établir un bilan précis de ces disparitions.
Une dizaine d'autres espèces partageaient une ou deux autres stations avec les plaines humides du littoral bônois ou callois (K3). Par chance, dans ce secteur, encore en partie préservé, la plupart d'entre elles existent toujours [64–66].
Ces mêmes menaces se développent aujourd'hui aux environ de Annaba, El Kala, Skikda et même Jijel. Il y a beaucoup à craindre dans ce type de milieu, tout aussi facile à aménager que fragile. En effet, un dernier aspect de ces biotopes rares est de servir naturellement de refuge à une flore d'origine euro-sibérienne, qui n'a pu se maintenir après la dernière phase glaciaire que par la présence de milieux aquatiques compensant l'aridité du climat méditerranéen. Or, sur les rivages nord de la Méditerranée, en France, c'est justement la disparition des éléments euro-sibériens qui a le plus suivi la dégradation des milieux au cours du XXe siècle [67].
6 Conclusion et perspectives
D'un point de vue fondamental, cette évaluation originale doit être rapidement confrontée aux données nouvelles, notamment en raison de la dégradation du patrimoine floristique observée pour la plupart des secteurs concernés par la présente étude (urbanisation des plaines et du littoral, dégradation des forêts de montagne, etc.). En effet, nos connaissances en matière de flore vasculaire sont encore majoritairement livresques et relativement anciennes, et il devient urgent de prospecter à nouveau le territoire national afin de mettre à jour nos données. Ainsi, une révision systématique, avec une redéfinition des taxons endémiques et une actualisation des données chorologiques s'avère indispensable pour moderniser ce diagnostic et l'approfondir à une échelle nationale et même locale.
De plus, la délimitation des hotspots régionaux en Méditerranée demeure basée sur une approche floristique limitée aux plantes vasculaires [18,68], ce qui semble insuffisant si l'on prend l'exemple des papillons [43] comme groupe taxonomique bien connu. Bien que riche en endémiques, l'Europe méditerranéenne n'apparaît pas exceptionnellement riche en espèces, tout comme les îles de Méditerranée ou de Macaronésie, fortement appauvries. Ainsi, bien que phytophages, les papillons ne répondent pas aux mêmes patrons de richesse que les plantes, ou bien dans des proportions différentes.
Néanmoins, notre évaluation, basée sur la richesse spécifique, la rareté et l'endémisme est à ce jour la plus complète possible en ce qui concerne les plantes vasculaires. Des investigations complémentaires devraient être réalisées afin de ne pas généraliser hâtivement des stratégies de conservation qui peuvent s'avérer inadéquates pour de nombreux autres organismes, représentants de la biodiversité [44].
D'un point de vue appliqué, cette évaluation devra se traduire, aussi bien à une échelle nationale qu'internationale, par la mise en place de nouveaux dispositifs juridiques, techniques et financiers de conservation, ainsi que le renforcement des moyens existants. La mise en place récente du Commissariat national du littoral en Algérie et le déploiement de moyens d'action concrets pour la gestion des sites naturels déjà classés dans le cadre de la convention de Ramsar ou des réserves MAB (man and biosphere) de l'Unesco, sont autant d'actions positives en faveur d'une conservation efficace de la biodiversité des divers secteurs phytogéographiques de l'Algérie. Cependant, la création de nouveaux parcs nationaux au niveau de secteurs hautement remarquables et ne bénéficiant encore aujourd'hui d'aucune protection (le mont Chélia dans les Aurès, le massif des Babors en Petite Kabylie, la presqu'île de Collo, l'Edough près d'Annaba, diverses portions encore préservées du littoral kabyle ou algérois, la forêt d'Akfadou, les gorges de Palestro près de Lakhdaria) constitue une action primordiale à entreprendre.
À une échelle nationale, il a été montré en Afrique du Sud [45] que les aires protégées sélectionnées à partir de la présence d'espèces menacées et d'espèces endémiques étaient bien plus performantes que celles sélectionnées au hasard, ou bien selon des critères non biologiques. Cependant, elles ne garantissent pas la représentation de toute la diversité ; aussi les réseaux d'aires protégées ne doivent pas seulement s'appuyer sur les espèces menacées ou endémiques, aussi importantes soient-elles. Ainsi, des scénarios ont-ils été testés concernant l'optimisation des réserves dans la conservation de la biodiversité de certains hotspots, en prenant notamment en compte à la fois leur complémentarité et leur représentativité [69]. Les scenarios basés sur les sites les plus riches en espèces ou sur les sites les plus complémentaires entre eux sont plus efficaces que ceux basés sur les types d'habitat ou la description de la végétation, et a fortiori sur le scénario témoin (sites sélectionnés au hasard). Face à l'augmentation de la densité humaine, il devient urgent de diagnostiquer quels sont les sites « irremplaçables » en termes de conservation d'écosystèmes et de diversité animale et végétale [70]. Face à une demande sociale et à la pression anthropique croissante, certains biologistes préconisent aujourd'hui d'évaluer le coût économique de la protection des terres encore naturelles dans ces points chauds de biodiversité [71]. Souhaitons que nos travaux participent à un élan global des scientifiques et des politiciens pour la mise en application un réseau d'espaces protégés toujours plus performant.
Remerciements
Les auteurs tiennent à remercier Toni Nikolic pour l'accès à ses travaux en cours de publication.
Annexes



Vous devez vous connecter pour continuer.
S'authentifier