Abridged English version
The landfill leachates are usually very rich in organic matter and also in inorganic compounds such as heavy metals. These substances can be responsible for the contamination of surrounding natural surface freshwaters as well as groundwaters. Different types of treatments can reduce the pollutant content of the leachates; lagooning is one of them. In this type of treatment, bacteria are responsible for the removal of organic matter. To our knowledge, very few studies were up to now devoted to the seasonal dynamics of bacteria in lagooning systems used to treat landfill leachates. In the present study, spatial and temporal distribution of bacterial abundance and biomass was assessed in a landfill leachate station located in Étueffont (Territoire de Belfort, France). Water samples were taken monthly from May 1998 to May 1999 from both the gross leachate and four successive lagooning basins. Some physicochemical analyses were performed in parallel with the microbiological analysis: temperature, pH, conductivity, metals concentrations, biological oxygen demand (BOD), and chemical oxygen demand (COD).
BOD of the gross leachate varied between 25 and 187 mg l−1, with an average of 62 mg l−1, while the BOD in the fourth basin was on average 20 mg l−1. This indicates an average removal of 42 mg l−1. COD of the gross leachate varied between 313 and 1550 mg l−1, with an average of 868 mg l−1, while the COD in the fourth basin was on average 260 mg l−1. Bacterial numbers in the gross leachate varied from 0.04 to (). The seasonal distribution of bacterial abundance showed high numbers in summer, which significantly correlated with increased BOD levels in the leachate. In the lagooning basins, bacterial abundance varied between to . Overall, the temporal distribution of bacterial densities in the four basins was complex and seemed to be influenced by environmental conditions and the leachate quality. In the first basin, a correlation was found between the bacterial abundance and the ratio BOD/COD, which is an index of the biodegradability of organic matter. This indicates the prevailing role of the biodegradable organic matter from the landfill in the development of bacterioplankton. Bacterial abundance and biomass in the four lagooning basins were overall lower than those reported in literature for aquatic systems with comparable organic matter content. This may be ascribed to the leachate toxicity on bacteria.
1 Introduction
Les progrès réalisés dans la vie urbaine ont généré une inquiétante accumulation de déchets d'ordures ménagères. En France, la moyenne annuelle de ces déchets est estimée à 31,4 millions de tonnes (360 kg par personne) [1], qui doivent être mis finalement en décharge [2]. La conséquence majeure et inévitable d'une telle mise en décharge est la production d'un lixiviat pouvant faire émerger de sérieux problèmes écologiques [3]. Plus précisément, lorsque le site n'est pas pourvu d'un système de confinement, les lixiviats riches en matières organique et inorganique, mais aussi en métaux lourds [4–7], peuvent contaminer les systèmes aquatiques souterrains et de surface. Plusieurs travaux ont rapporté divers problèmes de santé (anomalies congénitales et cancers de l'estomac, de la vessie, des poumons et des cas de leucémies) chez les personnes résidant près des sites de décharge d'ordures ménagères [8,9]. Cette charge polluante est souvent atténuée par le rôle bénéfique des microorganismes, et plus précisément des bactéries, qui jouent un rôle primordial dans la stabilisation des déchets. Les bactéries hétérotrophes aquatiques, en utilisant le carbone organique dissous des lixiviats, contribuent à son transfert à travers la chaîne trophique lorsqu'elles subissent la pression de prédation par les espèces bactérivores [10–13]. À notre connaissance, les études à long terme ayant trait à la dynamique saisonnière du compartiment bactérien dans les lixiviats de décharge sont très rares, se limitant le plus souvent à l'étude du rôle des bactéries hétérotrophes dans la dégradation de la matière organique dans les eaux de lixiviation [12–16]. Or, le rôle central du bactérioplancton dans le fonctionnement des écosystèmes marin et lacustre, des retenues de barrage, des eaux usées, des réservoirs d'eau potable n'est plus à démontrer [17–26]. De plus, les performances d'un traitement par lagunage en série des déchets issus des activités domestiques et agro-industrielles sont largement tributaires de l'efficience des bactéries hétérotrophes dans la dégradation de la matière organique [27]. Dans ces conditions, il est apparu important de suivre l'évolution spatio-temporelle des abondances et des biomasses du bactérioplancton, couplée à divers facteurs environnementaux dans le lixiviat brut et au cours de son traitement par lagunage dans la station d'Étueffont (Belfort, France).
2 Matériel et méthodes
2.1 Site étudié
La décharge d'ordures ménagères du Pays sous-vosgien est située au nord-est de Belfort (France, Fig. 1). Les caractéristiques morphométriques des quatre bassins de lagunage sont résumées dans le Tableau 1. La décharge occupe une surface de 4000 m2 ; elle est haute de 25 m, dont 4 m en profondeur. Elle a été fonctionnelle à partir de 1974 jusqu'à 1999, et présente un mode d'exploitation à ciel ouvert par broyage des déchets sans compactage. Cette gestion entraîne la production d'un lixiviat collecté en aval de la décharge et traité par lagunage naturel à air libre dans quatre bassins étanchéifiés. Le lixiviat traité est ensuite rejeté dans un petit ruisseau avoisinant.
Localisation géographique du site étudié.
Caractéristiques morphométriques des quatre bassins de la station d'Étueffont
| Bassin 1 | Bassin 2 | Bassin 3 | Bassin 4 | |
| Longueur (m) | 78 | 46 | 66 | 48 |
| Largeur (m) | 5 | 43 | 28 | 23,5 |
| Profondeur (m) | 0,8 | 1 | 1 | 1 |
| Perméabilité (m s−1) | 10−10 | 10−10 | 10−10 | 10−10 |
| Épaisseur de la vase (m) | 0,09 | 0,07 | 0,07 | 0,05 |
| Surface (m2) | 390 | 1934 | 1848 | 1128 |
| Volume (m3) | 312 | 1934 | 1848 | 1128 |
| Volume total (m3) | 5222 | |||
| Débit moyen de sortie (m3 S−1) | 0,001 | 0,001 | 0,001 | 0,001 |
| Temps de séjour (j) | 5 | 32 | 31 | 19 |
| Temps de séjour total (j) | 86 |
2.2 Échantillonnage
Les prélèvements d'eau destinés aux analyses physicochimiques et bactériologiques ont été effectués mensuellement de mai 1998 à mai 1999 entre 12 h 00 et 14 h 00 (heure légale) à la buse de sortie du lixiviat brut et dans les quatre bassins (moyenne des trois prélèvements effectués par bassin : un prélèvement au milieu correspondant au point le plus profond de chaque bassin, et les deux autres à proximité des deux berges amont et aval de chaque bassin).
2.3 Paramètres physicochimiques
Les mesures de la température, du pH, de la conductivité électrique et de l'oxygène dissous ont été effectuées in situ à l'aide d'une sonde multiparamètre (Multiline P3 PH/LF-SET). Les chlorures et les ions métalliques ont été dosés par chromatographie ionique (Dionex DX-100) La demande biochimique en oxygène (DBO) et la demande chimique en oxygène (DCO) ont été mesurées respectivement selon les nomes NF EN 1899-1 et NF T 90-101 (Afnor, 2001).
2.4 Numération bactérienne
Une fraction de 50 ml de chaque prélèvement a été préfiltrée sur une toile en nylon de 160 μm de vide de mailles, puis fixée au formaldéhyde (concentration finale : 2%). Au laboratoire, 5 ml de chaque échantillon ont été colorés au DAPI (4,6-diamino-2-phénylindol) et filtrés sur une membrane millipore noire de porosité 0,2 μm. Afin d'avoir une répartition homogène des cellules, un filtre noir en acétate de cellulose (Sartorius, taille de pores : 1,2 μm) est placé au dessous du filtre noir. Après une incubation de 15 min, le filtre est monté entre lame et lamelle et immédiatement congelé à −25 °C. Le dénombrement bactérien a été effectué à l'aide d'un microscope inversé à épifluorescence (Leica DM IRB, objectif ×40) en ultraviolet [28]. Lors du comptage, entre 500 et 800 cellules, réparties sur 20 champs différents, ont été dénombrées. Cela correspond à une précision de comptage supérieure à 10% au seuil de confiance de 90% [29,30]. Lors des énumérations microscopiques, il a été vérifié que les événements comptés ne possédaient de pigment chlorophyllien ; dans la suite de cet article, le terme de bactéries correspond donc aux bactéries hétérotrophes.
2.5 Estimation de la biomasse bactérienne
Pour chaque échantillon, on a estimé un biovolume moyen en mesurant au minimum une centaine de cellules à l'aide d'un micromètre oculaire. Le biovolume cellulaire moyen a été calculé à partir de la formule suivante [31] :
Les biomasses sont estimées à partir du biovolume cellulaire, en utilisant le facteur de conversion proposé par [32] : .
2.6 Analyse statistique
Les analyses de la variance ont été calculées en utilisant Statistica (interface Windows) par le biais du test paramétrique Anova. Les résultats statistiques sont considérés significatifs pour .
3 Résultats
3.1 Température
Les températures enregistrées dans le lixiviat brut varient de 7,4 à 19,5 °C (m ± sd = 14 ± 5 °C) (Tableau 2). Les résultats mettent en évidence une évolution saisonnière similaire dans les quatre bassins, avec des lixiviats plus chauds en été et plus froids en hiver. En général, une légère diminution de la température est observée en passant du premier au dernier bassin, certainement liée à la température plus élevée du lixiviat brut.
Valeurs moyennes et écart-types (σ) de la température (°C), du pH et des teneurs (mg l−1) en O2 dissous, en Cl, en DBO, en DCO et en éléments métalliques dans les lixiviats de la station d'Étueffont
| Lixiviat brut | Bassin 1 | Bassin 2 | Bassin 3 | Bassin 4 | ||||||
| moyenne | sd | moyenne | sd | moyenne | sd | moyenne | sd | moyenne | sd | |
| T (°C) | 15 | 6 | 14 | 7 | 13 | 8 | 13 | 8 | 13 | 8 |
| pH | 7,09 | 1,24 | 6,91 | 1,24 | 6,88 | 1,27 | 7,04 | 1,41 | 7,23 | 1,47 |
| O2 (mg l−1) | 3,95 | 3,96 | 3,56 | 3,76 | 5,39 | 3,63 | 6,12 | 4,32 | 7,95 | 4,68 |
| Cl (mg l−1) | 605 | 246 | 283 | 168 | 230 | 136 | 186 | 89 | 167 | 82 |
| Fe (mg l−1) | 4,4 | 3,54 | 5,57 | 4,23 | 3,48 | 2,16 | 2,90 | 1,67 | 2,42 | 1,33 |
| Mn (mg l−1) | 3,6 | 3,03 | 2,96 | 1,82 | 2,50 | 1,19 | 2,39 | 1,39 | 2,22 | 1,03 |
| Ni (mg l−1) | 2,14 | 2,85 | 1,68 | 2,68 | 1,17 | 2,16 | 1,0 | 2,37 | 1,36 | 2,39 |
| Cr (mg l−1) | 0,47 | 0,56 | 0,16 | 0,14 | 0,95 | 2,73 | 0,09 | 0,06 | 0,08 | 0,07 |
| Sn (mg l−1) | 0,43 | 0,54 | 0,30 | 0,39 | 0,21 | 0,24 | 0,3 | 0,32 | 0,12 | 0,16 |
| Zn (mg l−1) | 1,02 | 0,56 | 0,87 | 0,86 | 0,94 | 0,67 | 0,82 | 0,69 | 1,04 | 0,68 |
| Cu (mg l−1) | 0,46 | 0,52 | 0,24 | 0,13 | 0,18 | 0,33 | 0,10 | 0,06 | 0,15 | 0,26 |
| DBO (mg l−1) | 63 | 45 | 46 | 26 | 24 | 23 | 17 | 9 | 20 | 13 |
| DCO (mg l−1) | 868 | 482 | 436,08 | 188 | 319,77 | 113 | 271 | 81 | 260 | 74 |
3.2 Oxygène dissous
Les concentrations en oxygène dissous mesurées à la sortie de décharge varient de 0,5 à 11 mg l−1 (m ± sd = 3,64 ± 3,09 mg l−1) (Tableau 2). Les teneurs en oxygène dissous relevées dans les lixiviats des quatre bassins d'Étueffont oscillent entre 0,17 et 12,5 mg l−1 (m ± sd = 3,56 ± 3,8 mg l−1) en B1, entre 0,25 et 13,6 mg l−1 (m ± sd = mg l−1) en B2, entre 1,5 et 17,1 mg l−1 (m ± sd = 6,1 ± 4,3 mg l−1) en B3, et entre 1,5 et 16,1 mg l−1 (m ± sd = 7,9 ± 4,5 mg l−1) en B4 (Tableau 2). Le suivi de ce paramètre met en évidence la présence de deux pics de concentration en oxygène, le premier, très marqué, enregistré en été et le deuxième, avec des valeurs moins importantes, observé en hiver. Les valeurs les plus faibles ont été observées dans le premier bassin.
3.3 pH
Les valeurs de pH relevées dans le lixiviat brut varient de 5,1 à 8,2 (m ± sd = 7,09 ± 1,08) (Tableau 2). Les valeurs de pH du lixiviat mesurées dans les quatre bassins varient de 4,02 à 8,08 (m ± sd = 6,91 ± 1,24) en B1, de 4,62 à 8,21 (m ± sd = 6,88 ± 1,27) en B2, de 4,74 à 8,39 (m ± sd = 7,23 ± 1,47) en B3, et de 4,55 à 8,86 (m ± sd = 7,23 ± 1,47) en B4 (Tableau 2). Ce paramètre présente une évolution saisonnière bien marquée, avec des pH basiques en été et en automne et des pH acides en hiver et au printemps.
3.4 DBO
Lixiviat brut. Les valeurs de la teneur en matières organiques biodégradables (DBO) rejetées par la décharge varient de 25 à 187 mg l−1 (m ± sd = 62 ± 44,5 mg l−1) (Tableau 2). Les valeurs les plus élevées ont été enregistrées en novembre 1998, avec 187 mg l−1. En été, on observe une légère diminution des concentrations de DBO, de l'ordre de 25 mg l−1, qui coïncide avec les maxima de températures ambiantes enregistrées sur le site. En automne (octobre et novembre 1998), on assiste à une augmentation des teneurs en DBO dans le jus de décharge. Celles-ci commencent à diminuer avec l'arrivée de l'hiver, tout en demeurant élevées.
Bassins. Les valeurs de DBO varient de 14 à 100 mg l−1 (m ± sd = 26 ± 46 mg l−1) en B1, de 5 à 90 mg l−1 (m ± sd = 24 ± 23 mg l−1) en B2, de 2 à 34 mg l−1 (m ± sd = 17 ± 8 mg l−1) en B3, et de 2 à 50 mg l−1 (m ± sd = 20 ± 13 mg l−1) en B4. En moyenne, la différence de DBO entre le lixiviat brut et l'eau du quatrième bassin est donc de 42 mg l−1. L'abattement de la DBO semble principalement intervenir dans le premier bassin, puisque la différence entre le bassin 1 et le bassin 4 n'est que de 6 mg l−1.
3.5 DCO
Lixiviat brut. Les teneurs en DCO fluctuent entre 313 et 1550 mg l−1 (m ± sd = 868 ± 482 mg l−1) (Tableau 2). L'évolution saisonnière de la DCO apparaît opposée à celle de la DBO et semble être liée à la dilution des lixiviats par les précipitations hivernales.
Bassins. Les valeurs de la DCO oscillent entre 180 et 735 mg l−1 (m ± sd = 436 ± 188 mg l−1) en B1, entre 187 et 602 mg l−1 (m ± sd = 320 ± 114 mg l−1) en B2, entre 166 et 430 mg l−1 (m ± sd = 271 ± 81 mg l−1) en B3, et entre 153 et 379 mg l−1 (m ± sd = 260 ± 74 mg l−1) en B4 (Tableau 2). Ces résultats mettent en évidence une évolution spatio-temporelle bien marquée, avec une diminution de la charge organique en passant du premier au dernier bassin et de l'été à l'hiver.
3.6 Abondances et biomasses bactériennes
Lixiviat brut. L'analyse des échantillons récoltés au niveau du lixiviat brut indique que le peuplement bactérien de la station d'Étueffont est représenté majoritairement par les formes cocci (77% du peuplement), avec une dominance des formes libres de grande taille ( pour les cocci et pour les bacilles). L'effectif bactérien dans le lixiviat brut oscille entre , valeur observée en avril 1999, et 0,34 × 106 bactéries ml−1, en octobre 1998 (m ± sd = 0,132 ± 0,122 × 106 bactéries ml−1) (Fig. 2). Les maxima d'abondance ont été enregistrés en période estivale. Le biovolume bactérien moyen calculé au cours de notre étude (0,39 μm3) est supérieur à celui relevé dans les réservoirs d'eau potable [21] dans les milieux oligotrophes, mésotrophes et eutrophes [29,31,33–37] et proche des valeurs données dans la littérature pour les milieux extrêmes [38–41].
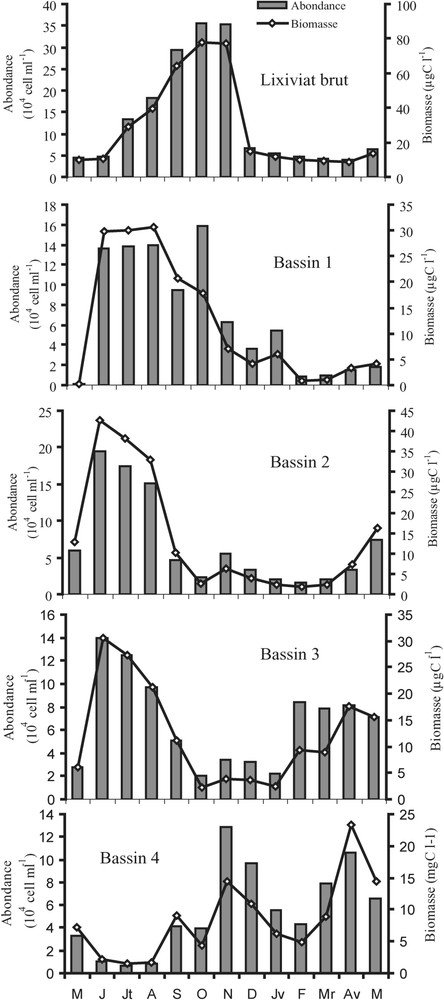
Distribution spatio-temporelle des abondances (cell l−1) et biomasses bactériennes (μg C l−1) dans le lixiviat brut (E) et dans le lixiviat issu des quatre bassins (B1, B2, B3 et B4) de mai 1998 à mai 1999.
Calculée pour chaque échantillon à partir du biovolume bactérien moyen et de l'abondance, la biomasse bactérienne a varié de 8,78 à 77,51 μg C l−1 (m ± sd = 28,94 ± 26,79 μg C l−1) (Fig. 2).
Bassin 1. Le peuplement bactérien est dominé par des formes libres essentiellement représentées par des cocci (91% du peuplement total). La plus forte abondance des formes bacilles a été observée en octobre 1998 (36% du peuplement). Les bactéries sont caractérisées par leur grande taille ( pour les cocci et pour les bacilles), les rapprochant étroitement des bactéries observées dans le lixiviat brut. L'abondance bactérienne varie de 0,008 × 106 à 0,15 × 106 bactéries ml−1 (m ± sd = 0,067 × 106 ± 0,063 × 106 bactéries ml−1). Les valeurs maximales mesurées dans ce bassin coïncident avec une élévation des teneurs en substances nutritives dans le lixiviat brut et dans le bassin (Fig. 2). L'évolution saisonnière montre des abondances bactériennes faibles en hiver et fortes en été. La biomasse bactérienne varie de 0,2 à 30 μg C l−1 (m ± sd = 11,98 ± 12,04 μg C l−1 (Fig. 1).
Bassin 2. L'analyse qualitative du peuplement bactérien dans le deuxième bassin met en évidence une forte dominance des formes cocci au dépend des formes bacilles (96% du peuplement bactérien). Toutefois, les bactéries observées dans ce bassin sont caractérisées par leur petite taille ( pour les cocci et pour les bacilles), à l'exception du mois de mai 1999, où l'on observe des cocci de grande taille, dont le diamètre est compris entre 0,5 et 0,8 μm. La densité bactérienne varie de 0,015 × 106 à 0,19 × 106 bactéries ml−1 (m ± sd = 0,069 × 106 ± 0,062 × 106 bactéries ml−1) (Fig. 2). C'est dans ce bassin que la valeur maximale observée dans les quatre bassins durant tout le suivi a été mesurée, en juin 1998. L'évolution saisonnière des densités bactériennes est similaire à celle du premier bassin ; celle-ci diminue en hiver et augmente en été. La biomasse bactérienne varie de 1,74 à 42,68 μg C l−1 (m ± sd = 13,8 ± 14,58 μg C l−1) (Fig. 1).
Bassin 3. D'une façon similaire au cas du bassin 2, les cocci dominent le peuplement bactérien, avec 97% aux dépens des bacilles, qui ne représentent que 3% du peuplement bactérien total. Toutefois, on observe dans ce bassin une domination des cocci de petite taille (diamètre ), très présentes en fin d'été. Les abondances bactériennes enregistrées dans le troisième bassin oscillent entre 0,02 × 106 et 0,14 × 106 bactéries ml−1 (m ± sd = 0,066 × 106 ± 0,0199 × 106 bactéries ml−1) (Fig. 2). Le peuplement bactérien présente la même évolution que celle mentionnée précédemment, mais avec des densités plus faibles. La biomasse bactérienne varie de 2,23 à 30 μg C l−1 (m ± sd = 12,29 ± 9,51 μg C l−1) (Fig. 2).
Bassin 4. Dans ce dernier bassin, on observe une présence de bacilles, comme dans le premier bassin (4% du peuplement bactérien total). L'étude de la distribution temporelle des diamètres bactériens montre une évolution saisonnière très nette chez les cocci, avec des cocci de petite taille en fin d'été. La densité bactérienne varie de 0,007 × 106 à 0,10 × 106 bactéries ml−1 (m ± sd = 0,055 × 106 ± 0,038 × 106 bactéries ml−1) (Fig. 2). Ce bassin est marqué par une évolution saisonnière bactérienne opposée à celles des autres bassins. Cette opposition se manifeste par des densités bactériennes faibles en été et fortes en hiver. La biomasse bactérienne varie de 1,52 à 23,3 μg C l−1 (m ± sd = 8,39 ± 6,21 μg C l−1) (Fig. 2).
4 Discussion
4.1 Paramètres abiotiques
Les valeurs de température du lixiviat enregistrées dans les quatre bassins sont très voisines et varient de 18 à 25 °C en été et de 0 à 8 °C en hiver. Notons que les bassins ont subi un gel au mois de novembre 1998. Le lixiviat du premier bassin est souvent plus chaud que celui des autres bassins, du fait de sa faible profondeur (0,7 m) et du réchauffement probable par les lixiviats bruts. Au cours de notre étude, la stratification thermique est peu marquée, l'écart maximal de température entre le fond et la surface est de 6 °C (mai 1999). En fait, pendant la période d'été, l'eau de surface devient plus chaude que les eaux du fond. Le phénomène s'inverse en hiver.
Les valeurs de pH enregistrées en été sont élevées (pH = 8), alors qu'en hiver elles diminuent pour atteindre des valeurs faibles (pH = 4). Cette tendance acide de l'eau hivernale semble être due, d'une part, au ralentissement de l'activité photosynthétique et, d'autre part, à l'apport par la décharge de lixiviats acides. L'évolution verticale de ce paramètre ne semble pas être influencée par la profondeur des bassins. Cependant, l'écart des valeurs de pH enregistré durant les douze mois de suivi ne dépasse pas l'unité entre la surface et le fond, pour l'ensemble des points de prélèvement considérés dans cette étude.
Les valeurs d'oxygène dissous enregistrées dans les quatre bassins montrent la présence d'une différence notable entre bassins, entre le fond et la surface et d'une saison à l'autre. Le cycle annuel laisse apparaître deux séquences principales : la première en été avec des valeurs élevées de 3 à 12 mg l−1 dans la zone euphotique et essentiellement liée aux blooms phytoplanctoniques estivaux, la deuxième en hiver avec des valeurs plus faibles, de 0 à 4 mg l−1, liée à l'absence de production primaire et à la dégradation de la matière organique par les bactéries hétérotrophes. Toutefois, au mois de janvier 1999, on enregistre une forte oxygénation du milieu, en raison vraisemblablement de la poussée hivernale d'organismes unicellulaires photosynthétiques et aux agitations mécaniques provoquées par les vents. L'évolution spatiale de cet élément montre une augmentation des teneurs en passant du premier au dernier bassin, indiquant une décroissance de l'intensité de l'activité hétérotrophe. L'étude de la stratification verticale des concentrations en oxygène dissous met en évidence une différence bien marquée entre le fond et la surface, pouvant atteindre jusqu'à 10 mg l−1 en été, qui est liée à l'intensité de l'activité photosynthétique dans la tranche superficielle des eaux.
Les variations saisonnières des valeurs des DBO et DCO sont bien nettes. De plus, nos résultats mettent en évidence une chute des teneurs en matières organiques contenues dans le lixiviat durant son cheminement d'un bassin à un autre. Cette décroissance des teneurs est liée à la fois à des processus physicochimiques (décantation, adsorption, floculation, etc.) et biologiques (biodégradation bactérienne). La décroissance moyenne de la DCO entre le lixiviat brut et l'eau du quatrième bassin (606 mg l−1) est beaucoup plus importante de que celle de la DBO (42 mg l−1), ce qui indique que l'abattement de la matière organique dépend davantage des processus physicochimiques que microbiologiques.
4.2 Abondances et biomasses bactériennes
Durant tout notre suivi, on observe dans tous les bassins une nette dominance des morphotypes cocci (95% de la population bactérienne) par rapport aux morphotypes bacilles (4% de la population bactérienne) et 1% pour les autres morphotypes. Les formes bacilles sont surtout présentes dans le premier bassin en fin d'été (septembre et octobre 1998), vraisemblablement en liaison avec l'élévation de la température de l'eau et les apports de substrats allochtones par le lixiviat brut dans le premier bassin. Toutefois, les tailles des cellules bactériennes mesurées dans les quatre bassins semblent être supérieures à celles rapportées par certains auteurs dans les milieux eutrophes [29,42–46]. Ces diamètres, assez importants, sont attribuables à la forte charge organique, quasi-permanente dans les quatre bassins. Par ailleurs, les densités bactériennes enregistrées dans les bassins de la station d'Étueffont sont très aléatoires et sont inférieures à celles décrites par [47] dans les eaux usées domestiques [48]. Ces faibles abondances sont vraisemblablement liées à l'effet toxique des lixiviats [48–54]. Il apparaît, d'après nos résultats, que les densités bactériennes sont quasi similaires dans les quatre bassins, ceci est confirmé par l'absence de différences statistiquement significatives ( ; test Anova). Toutefois, l'étude statistique dans le premier bassin met en évidence une corrélation positive significative entre les effectifs bactériens et le rapport DBO/DCO ( pour 11 ddl : degrés de liberté) (Fig. 3), qui constitue un indice de la biodégradabilité de la matière organique. Ceci met en évidence le rôle prépondérant de la matière organique biodégradable importée par la décharge dans le développement du bactérioplancton. Dans le deuxième bassin, c'est plutôt le pH qui semble gouverner l'abondance bactérienne avec une corrélation positive hautement significative ( pour 11 ddl). Il apparaît que les effectifs bactériens augmentent avec l'élévation du pH et des teneurs en oxygène dissous. Ce résultat est corroboré par les observations de plusieurs auteurs, mettant en évidence une corrélation positive entre pH et abondances bactériennes () dans les milieux eutrophes [26]. En effet, le pH fait partie des facteurs qui concourent à la clairance bactérienne dans de tels écosystèmes aquatiques. L'influence des variations de pH dans les installations de traitement des eaux usées par lagunage sur la clairance bactérienne a été étudiée par plusieurs auteurs. Ainsi, Oufdou et al. [55] ont montré que les pH alcalins favorisent le développement et la survie de certaines espèces, comme Vibrio cholerae. Dans le troisième bassin, l'étude statistique réalisée entre l'abondance bactérienne et les paramètres abiotiques semble mettre en évidence un rôle non négligeable de la matière organique biodégradable, vraisemblablement autochtone, dans l'induction de la prolifération bactérienne ( pour 11 ddl). Enfin, dans le dernier bassin, et en conséquence du développement important d'organismes unicellulaires photosynthétiques observé au cours de cette étude et de l'ensemencement permanent du milieu en matière organique, c'est le pH qui semble influencer majoritairement la dynamique du peuplement bactérien ( pour 11 ddl).

Variations saisonnières dans le lixiviat brut et les 4 bassins des rapports DBO/DCO et de l'abondance bactérienne.
Les faibles abondances bactériennes se répercutent nettement sur les biomasses bactériennes, qui sont nettement inférieures à ce qui est attendu en fonction de la richesse du milieu en matière organique [56,57].
5 Conclusion
Au terme de cette étude, il apparaît que les densités bactériennes enregistrées dans les bassins de la station d'Étueffont sont très aléatoires et sont inférieures à ce qui est attendu en fonction de la richesse du milieu en matière organique. Ces faibles abondances sont vraisemblablement liées aux effets toxiques des lixiviats du site étudié. De plus, les densités bactériennes semblent être similaires dans les quatre bassins, ce qui suggère une relativement faible contribution de l'activité bactérienne à la charge en matière organique, ce qui est confirmé par l'abattement beaucoup plus faible de la DBO par rapport à celui de la DCO. Sur le plan des successions saisonnières, l'évolution temporelle des densités bactériennes dans les quatre bassins de la station d'Étueffont met en évidence une évolution variable d'un bassin à un autre. En été, on enregistre un développement bactérien important dans les trois premiers bassins, favorisé par l'élévation de la température, corroborant les observations rapportées par divers auteurs [58–61], alors que, dans le dernier bassin, les effectifs bactériens diminuent sous l'effet probable d'une forte pression de prédation. En automne, l'apport par la décharge de lixiviats fortement chargés en substances nutritives et très peuplés en bactéries (0,35 × 106 bactéries ml−1) entraîne une augmentation importante des effectifs bactériens dans le premier bassin (octobre 1998) et dans les trois autres (novembre 1998). En hiver, on enregistre une diminution de la densité bactérienne dans l'ensemble des bassins, cela est attribuable à la baisse de la température et à la diminution de la charge organique sous l'effet de la dilution. Enfin, au printemps, l'élévation de la température et le développement des espèces phytoplanctoniques excrétrices de carbone organique dissous [62–65] semblent favoriser à nouveau le développement des bactéries hétérotrophes dans l'ensemble des bassins.
Remerciements
Nous tenons à remercier vivement le Syndicat intercommunal de la collecte et du traitement des ordures ménagères (Sictom) de la zone sous-vosgienne, qui nous a permis de réaliser cette étude.


