Abridged English version
In this study, we monitored seasonal fluctuations of hydrobiological factors and cell abundance of Alexandrium spp. from November 2007 to February 2009 at six stations in the southern Mediterranean sea (a semi-enclosed lagoon: Bizerte Lagoon). Alexandrium spp. abundance has ranged from undetectable to 7 × 105 cells L−1. Maximum cell densities were detected in November 2007 at station (MA), when salinity was 37.5 and temperature 16 °C. In November 2007, Alexandrium spp. densities have accounted for a large fraction (61%) of the harmful phytoplankton. During this month, there was phosphorus and a siliceous limitation. Indeed, N:P varied between 0.78 (February 2008) and 72.73 μM (November 2007). This report indicates a limitation in nitrogen (N:P < 16) during February 2008 and 2009 and during May, April, August and November 2008. Moreover, a phosphorus limitation (N:P > 16) was observed during November 2007, January, June and September 2008 (Fig. 3a). During all the periods of sampling, the Si:P was always lower than 16, indicating that siliceous was limiting (Fig. 3b). The Si:N was also always lower than 1 which confirms a silicon limitation during sampling (Fig. 3c).
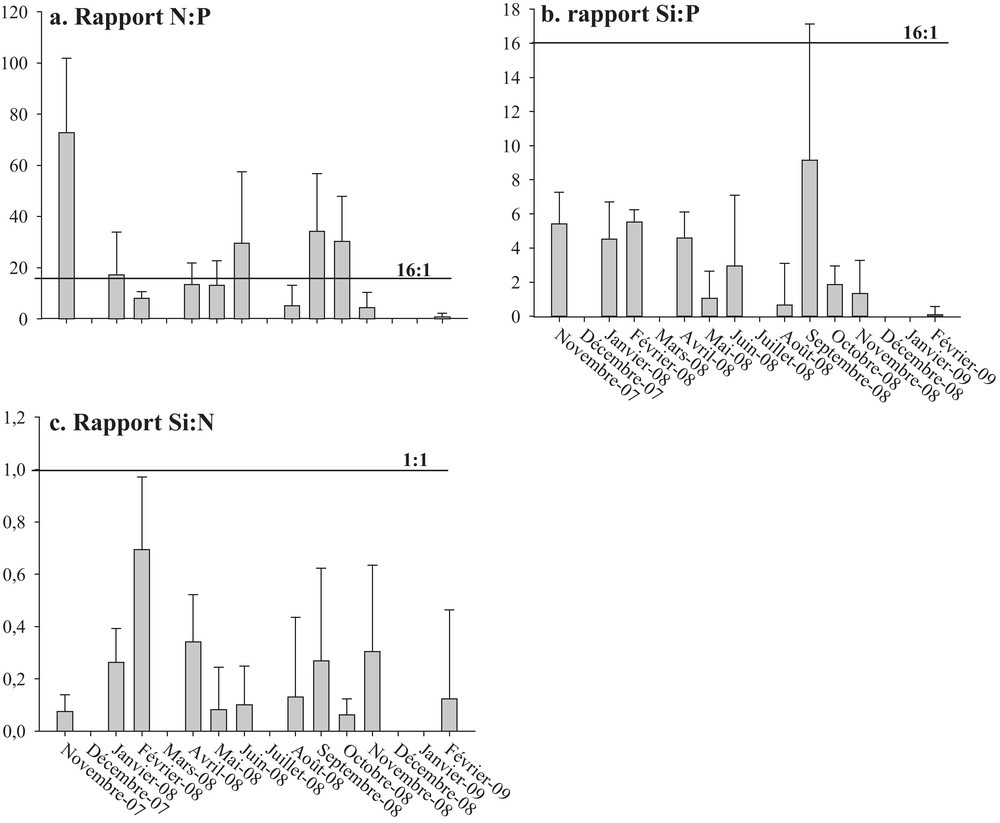
Variation des rapports de Redfield (N:P, Si:P, Si:N) dans les différentes stations prospectées pendant la période d’étude (moyenne des stations, n = 12).
Alexandrium spp. had sporadic appearances during this sampling but maximum abundance was recorded during the autumnal season, a period of high winds. These maximum concentrations can be explained by the presence of factors favourable to the development of the cysts. The abundance of these algae coincided with high concentrations of nitrate and ammonium. The statistical analyses revealed that abundance of Alexandrium spp. positive correlated with ammonium, N:P and N (Tableau 3). This could be explained by the adaptation of this genus to the very high ammonium concentrations (55.45 μM in November 2007) which characterizes the study site.
Abondances cellulaires (cellules L−1) d’Alexandrium spp. dans différents systèmes côtiers tunisiens.
| Espèces | Date de détection | Lieu de détection | Abondance cellulaire | Auteurs |
| Alexandrium catenella | Août 1997 | Canal de Tunis | Turki et Balti, 2005 | |
| Mars 2005 | Lac de Tunis | 5,40 × 104 | Turki et Balti, 2005 | |
| Janvier 2008 | Lac de Tunis | 5,50 × 104 | Armi et al., 2011 | |
| Alexandrium spp. | Août 1991 | Lagune de Ghar El Melh | 1,50 × 106 | Romdhana et al., 1998 |
| Juillet 2003 | Lagune de Bizerte | 7,90 × 101 | Turki, 2004 | |
| Déc. 93–nov 94 | Baie de Tunis | 4,10 × 101 | Daly Yahia Kefi et al., 2001 | |
| Déc. 93–nov 94 | Baie de Tunis | 2,95 × 102 | Daly Yahia Kefi et al., 2001 | |
| Juillet 1994 | Baie de Tunis | 1,16 × 102 | Daly Yahia Kefi et al., 2001 | |
| Mai 1995 | Baie de Tunis | 1,40 × 103 | Daly Yahia Kefi et al., 2001 | |
| Juillet 2006 | Lac de Tunis | Non déterminée | Armi et al., 2008 | |
| Alexandrium tamarense | Août 2007 | Lac de Tunis | 7,00 × 103 | Armi et al., 2011 |
The lagoon of Bizerte is a significant zone of shellfish production. The presence, even sporadic, of Alexandrium with high concentrations could constitute an obstacle to the development of the aquaculture in the area and a danger to consumers. A regular monitoring of these potentially toxic algae in the lagoon and the saxitoxines in shellfishs was thus necessary.
1 Introduction
Au cours de ces deux dernières décennies, l’intensité et la fréquence des efflorescences du phytoplancton nuisible dans les écosystèmes côtiers n’ont pas cessé d’augmenter [1–3]. Les efflorescences des dinoflagellés du genre Alexandrium ont été observées dans plusieurs côtes du monde entier. Les espèces d’Alexandrium sont particulièrement nocives parce que quelques espèces de ce genre présentent la capacité de produire les saxitoxines, l’agents responsables de l’intoxication paralysante par la consommation des fruits de mer (IPFM) (en anglais on les appelle les PSP pour paralytic shellfish poisoning) [1,4,5].
Au cours de ces dernières années, le genre Alexandrium a été répertorié en Méditerranée [6–14]. Au Sud de la Méditerranée, les études concernant ce genre sont rares [15–19]. Dans les lagunes du Nord de la Tunisie, depuis près d’une dizaine d’années, des mortalités de poissons ont été enregistrées coïncidant avec des blooms d’espèces d’Alexandrium [15,20]. Sur les côtes tunisiennes, ce genre a été identifié et répertorié au niveau de la baie et du lac de Tunis [16,21]. Dans la lagune de Bizerte, la présence des espèces d’Alexandrium a été décrite comme sporadique [22]. En outre, les études précédentes se sont contentées de signaler leur présence dans la lagune de Bizerte, mais aucune étude ne s’est intéressée à la distribution et l’écologie de ces organismes. La lagune de Bizerte supporte une forte activité d’aquaculture et la prolifération des microalgues nuisibles du genre Alexandrium peut avoir un impact direct sur la santé de l’homme via la consommation des produits de la mer. Le présent travail s’est intéressé donc à l’étude de la dynamique des espèces d’Alexandrium en relation avec les facteurs environnementaux dans une lagune au sud de la Méditerrannée, la lagune de Bizerte.
2 Matériel et méthodes
2.1 Site d’étude
La lagune de Bizerte (37°8′–37°14′N, 9°48′–9°56′E) est située au nord de la Tunisie (Fig. 1). Elle a une superficie de 150 km2 et une profondeur moyenne de 8 m. Ce plan d’eau communique avec la Méditerrannée par un canal de 12 m de profondeur et de 7 km de longueur. L’apport marin est fort en été, avec une circulation anticyclonique dans la lagune [23]. Les vents dominants en automne, de secteur nord-ouest, constituent le facteur principal forçant, puisque les marées sont négligeables [24]. Cette lagune, connue par une importante activité de pêche et d’aquaculture, supporte une forte biomasse (1–7 μg Chl a L−1) et une importante production phytoplanctonique (50–360 μg C m−3 d−1) [25]. Ceci peut être dû à une disponibilité nutritive assez élevée (NO2− + NO3− : 0,8–11 μM ; PO43− : 0,14–0,48 μM) [25].

Localisation des stations d’étude dans la lagune de Bizerte.
2.2 Échantillonnage
L’échantillonnage a été conduit mensuellement de novembre 2007 à février 2009 (à l’exception de décembre 2007, mars, avril et décembre 2008 et janvier 2009) au niveau de six stations de la lagune de Bizerte (Fig. 1) : Une station Tinja (TJ) qui se situe à l’embouchure du Lac Ichkeul, la principale source d’alimentation d’eau douce ; deux stations Canal (Ca) et Chaara (Ch) impactées par des effluents urbains et industriels et par aussi le flux marin, et trois stations Menzel Abderrahman (MA), Menzel Jemil (MJ) et Douaouda (Do) localisées à proximité des parcs conchylicoles. Les coordonnés géographiques et les profondeurs maximales de chaque station prospectée sont portées au Tableau 1. À chaque station, les prélèvements d’eau ont été effectués à la profondeur du maximum de Chl a (2–3 m). La température de l’eau et la salinité ont été mesurées in situ à l’aide d’un multiparamètre (WTW LF 197). La turbidité de l’eau a été aussi mesurée à l’aide d’un turbidimètre (TURB 350 IR, WTW).
Coordonnées GPS des stations d’étude et leurs profondeurs maximales.
| Localisation | Profondeur maximale (m) | ||
| Latitude (°N) | Longitude (°E) | ||
| Menzel Abderrahman : MAa | N 37° 13,178′ | E 009°51,178′ | 12,52 |
| Menzel Jemil : MJa | N 37° 12,266′ | E 009°51,237′ | 11,55 |
| Douaouda : Doa | N 37° 09,413′ | E 009°51,837′ | 8,80 |
| Tinja : TJb | N 37° 11,190′ | E 009°49,541′ | 10,12 |
| Chaara : Chc | N 37° 15,912′ | E 009°52,353′ | 9,20 |
| Canal : Cac | N 37° 15,912′ | E 009°52,553′ | 8,50 |
a Stations localisées dans des parcs conchylicoles.
b Station localisée à l’embranchement du lac Ichkeul.
c Stations influencées par des effluents urbain et industriel.
2.3 Analyses au laboratoire
2.3.1 Nutriments
Pour analyser les nutriments, des échantillons d’eau de 500 mL ont été filtrés sur des filtres en polycarbonates (0,2 μm, Millipore) et les filtrats ont été conservés à −20 °C jusqu’à l’analyse par spectrophotométrie. Les nitrites et les nitrates ont été déterminés selon le procédé de Wood et al. [26]. L’ammonium a été mesuré suivant la technique de Koroleff [27]. Les analyses des phosphates et de l’acide orthosilicique ont été basées sur les méthodes de Murphy et Riley [28] et de Mullin et Riley [29], respectivement. Les limites de détection des méthodes analytiques pour les NO2−, NO3−, NH4+, PO43− et Si(OH)4 sont respectivement de 0,01 ; 0,05 ; 0,05 ; 0,02 et 0,1 μM.
2.3.2 Abondance du phytoplancton
Pour dénombrer et identifier le phytoplancton, des échantillons d’eau (150 mL) ont été fixés avec une solution de Lugol acide (concentration finale de 3 %) et analysés une semaine après chaque échantillonnage. Au cours de chaque mois d’échantillonnage, les abondances cellulaires ont été déterminées, dans trois triplicatas, sous un microscope inversé à immersion [30,31]. Pour chaque échantillon, au moins 200 cellules de chaque groupe taxonomique ont été comptées.
2.4 Analyses statistiques
Les analyses statistiques ont été réalisées à l’aide du logiciel SPSS. 11.0 pour Windows. Une analyse de variance (Anova) à un seul facteur a été utilisée pour tester la signification des variations temporelles des variables abiotiques et biotiques. Les coefficients de corrélation de Spearman (rs) ont été calculés pour tester la relation linéaire entre l’abondance cellulaire d’Alexandrium spp. et les facteurs abiotiques.
3 Résultats
3.1 Variabilité temporelle du milieu naturel
La température de l’eau a varié entre 29 °C (août 2008) et 12 °C (janvier 2008) (Fig. 2a). La salinité la plus élevée (39,65) a été enregistrée au mois d’octobre 2008 aux stations MA et MJ, alors que la valeur minimale (30,90) a été observée en janvier 2008, à la station Ch (Fig. 2b). La turbidité de l’eau a fluctué entre une moyenne de 0,07 NTU (août 2008, stations Ca et TJ) et 9,63 NTU (juin 2008, station MA) (Fig. 2c). Les concentrations en Si(OH)4 ont oscillé entre une valeur minimale de 0,20 μM (février 2009, station TJ) et une valeur maximale de 8,43 μM (novembre 2007, station MJ) (Fig. 2d). La teneur maximale en PO43− (11,50 μM) a été enregistrée au mois de février 2009 à la station Ch (Fig. 2e). La concentration minimale en ion NO2− (0,01 μM) a été enregistrée au mois de novembre 2007, à la station Ch alors que la concentration maximale (0,84 μM) a été trouvée au cours du mois d’avril 2008, à la station Ca (Fig. 2f). Les concentrations en ion NO3− ont varié entre 0,004 et 4,01 μM (Fig. 2g). En novembre, les concentrations en azote ammoniacal ont accusé 99,58 μM à la station TJ. Pendant le reste de la période d’étude, les concentrations de cet élément nutritif ont varié entre 3,41 et 26,35 μM (Fig. 2h).
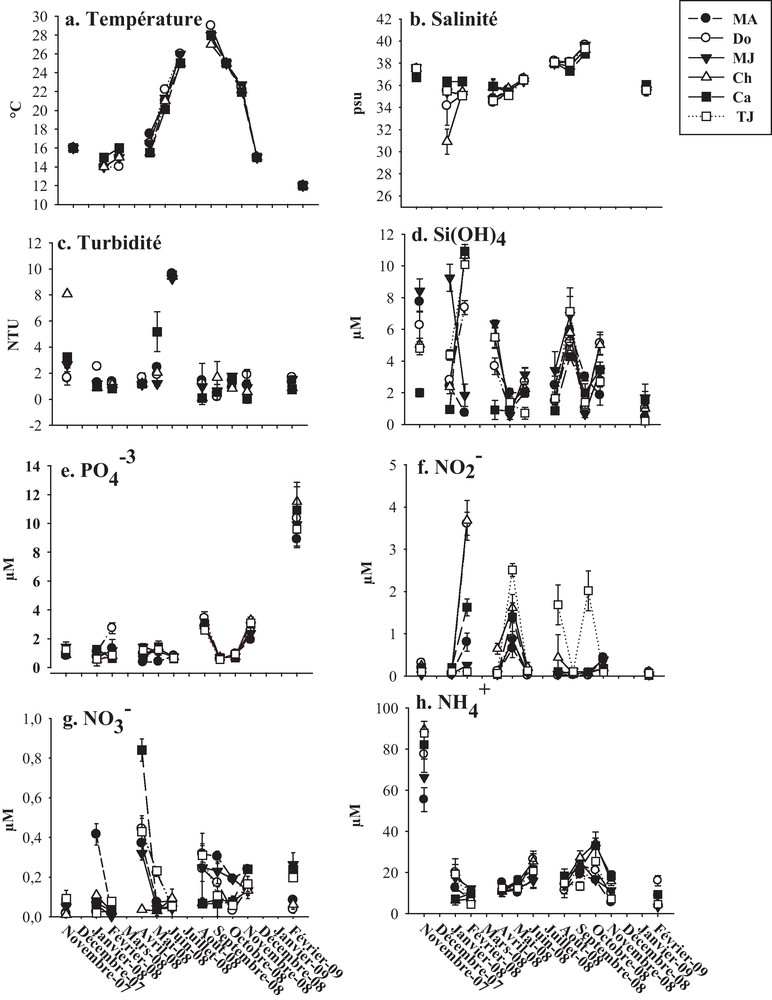
Variation des facteurs abiotiques dans les différentes stations prospectées pendant la période d’étude (moyenne ± écarts-types).
3.2 Rapport de Redfield
Le rapport N:P a varié entre 0,78 (février 2008) et 72,73 (novembre 2007). Ce rapport indique qu’il y a eu une limitation en azote (N:P < 16) au cours des mois de février (2008 et 2009) et avril, mai, août et novembre 2008. En outre, une limitation en phosphore (N:P > 16) a été probable au cours des mois de novembre 2007, janvier, juin et septembre 2008 (Fig. 3a).
Au cours de toute la période d’échantillonnage, le rapport Si:P a été toujours inférieur à 16:1, suggérant que le silicium était limitant (Fig. 3b). Le rapport Si:N était aussi toujours inférieur à 1:1, ce qui indique une limitation probable en silicium au cours de l’échantillonnage (Fig. 3c).
3.3 Variation spatiotemporelle du phytoplancton
Le phytoplancton a montré des variations temporelles significatives (p < 0,01). Les abondances cellulaires maximales du phytoplancton total (65,39 × 105 cellules L−1) et du phytoplancton potentiellement toxique (29,32 × 105 cellules L−1) ont été enregistrées au cours de la saison estivale (août 2008) au niveau de la station Ca (Fig. 4). Par contre, la densité cellulaire minimale du phytoplancton total (1,15 × 105 cellules L−1) a été enregistrée en hiver (janvier 2008) à la même station alors que celle du phytoplancton potentiellement toxique (0,08 × 105 cellules L−1) a été atteinte en automne à la station Do (Fig. 4). Concernant les concentrations maximales du phytoplancton potentiellement toxique, à part le pic enregistré en août à la station Ca, les autres stations ont montré des concentrations maximales au mois de novembre 2007 (3,27–11,00 × 105 cellules L−1). Le Tableau 2 présente les taxa, du phytoplancton potentiellement toxique, recensés au cours de cette étude.
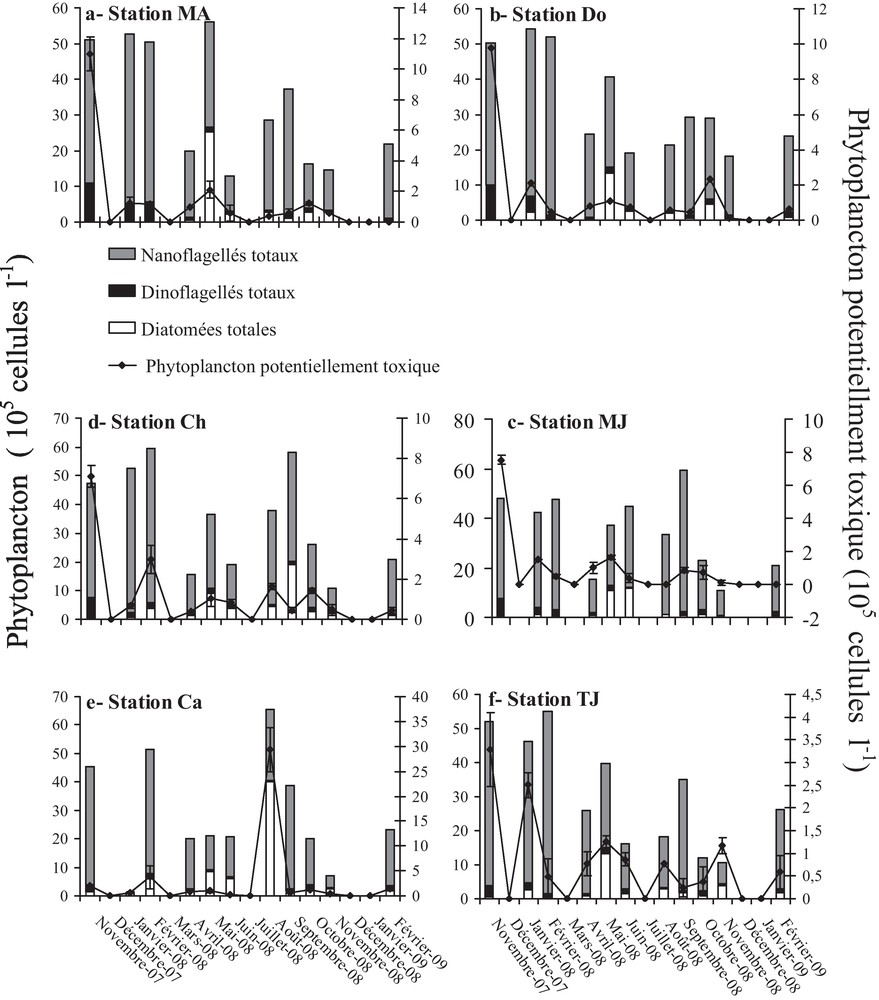
Variation de l’abondance cellulaire des trois groupes phytoplanctoniques et du phytoplancton potentiellement toxique dans les différentes stations prospectées pendant la période d’étude (moyenne ± écarts-types).
Liste des taxa susceptibles d’être nuisibles observés au cours des saisons au niveau des six stations d’étude avec des informations sur leur nuisance.
| Saison | Stations | Taxa | Impact |
| Automne | MA | Alexandrium spp. | Quelques espèces produisent des IPFMa |
| Do | Cochlodinium polykrikoides | Provoque la mortalité de faune marine | |
| MJ | Gonyaulax spp. | Certaine espèce de Gonyaulax (Gonyaulax spinifera) produit des yessotoxines (IDFMc) | |
| Do | Karenia mikimotoi | Ib, ECd | |
| MA | Neoceratium lineatum | ECd | |
| MJ | Prorocentrum spp. | IDFMc | |
| Hiver | MJ | Dinophysis spp. | IDFMc |
| Été | MA | Akashiwo sanguinea | ECd, provoque la mortalité de faune marine |
| Ca | Pseudo-nitzschia spp. | IAFMe |
a IPFM : intoxication paralytique par la consommation des fruits de mer.
b I : production des ichtyotoxines.
c IDFM : intoxication diarrhéique par la consommation des fruits de mer.
d EC : eaux colorées.
e IAFM : intoxication amnésique par la consommation des fruits de mer.
Le phytoplancton a été caractérisé par une dominance marquée des nanoflagellés pendant la plupart des mois. Les dinoflagellés ont aussi contribué à la communauté phytoplanctonique avec des abondances variant de 0,21 × 105 cellules L−1 (en novembre 2008, à la station Ca) à 10,99 × 105 cellules L−1 (en novembre 2007, à la station MA). Quant aux diatomées, elles n’étaient présentes en abondance (7,71–25,17 × 105 cellules L−1) qu’en novembre et février 2008 (station Do), en avril 2008 (stations MJ et TJ) et en mai 2008 (stations MA, Cha et Ca) (Fig. 4).
3.4 Variation spatiotemporelle de l’abondance cellulaire du genre Alexandrium
Le genre Alexandrium n’a été observé que d’une façon sporadique pendant quelques mois (novembre 2007, janvier 2008, février 2008, mai 2008 et septembre 2008) avec des abondances variant de 0,04 à 7 × 105 cellules L−1 (Fig. 5). Sa présence la plus marquée a été en novembre 2007 dans toutes les stations où ce genre a accusé des densités de 0,67 à 7 × 105 cellules L−1. C’est à la station MA, qu’Alexandrium spp. ont montré des densités maximales (7 × 105 cellules L−1) et une forte contribution (62 %) du phytoplancton potentiellement toxique.
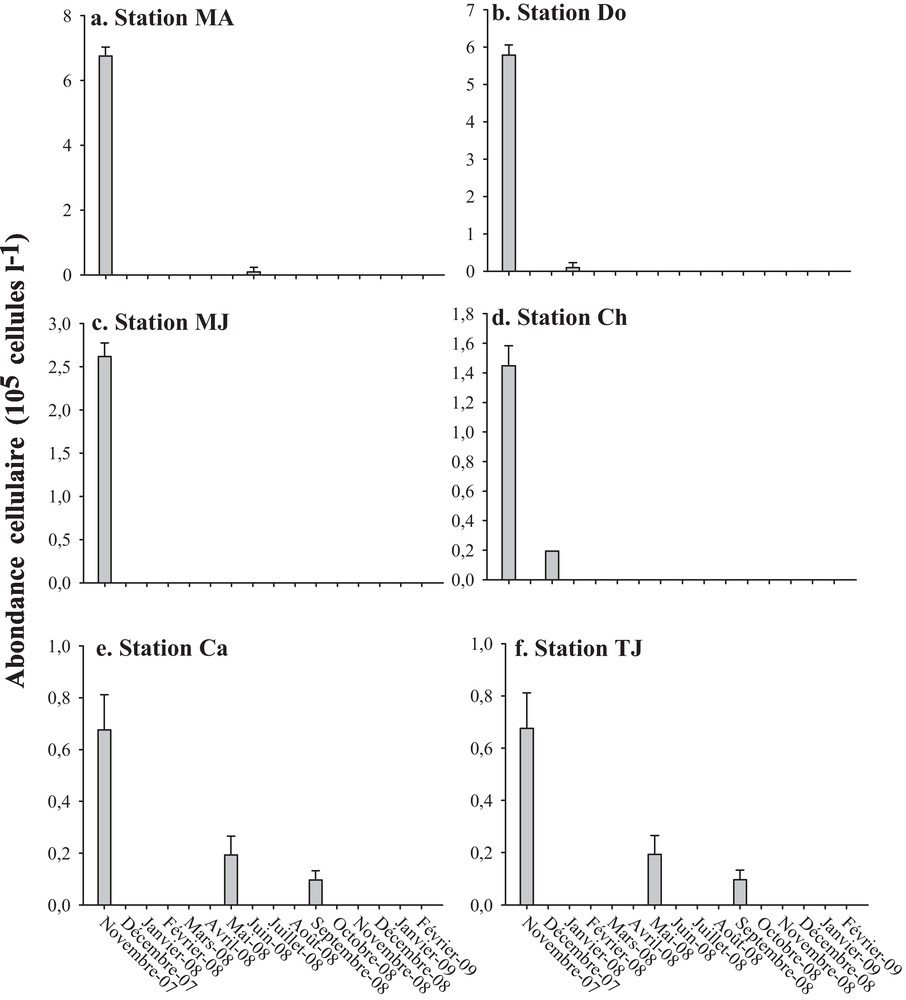
Variation de l’abondance cellulaire du genre Alexandrium dans les différentes stations prospectées pendant la période d’étude (moyenne ± écarts-types).
4 Discussion
Compte tenu de sa nature oligotrophique, la mer méditerranéenne a été précédemment considérée à faible risque pour le développement d’efflorescences de microalgues nocives. Cependant, cette mer est récemment classée comme zone très vulnérable aux proliférations des espèces nuisibles à cause de l’eutrophisation anthropique des eaux [32].
Parmi les microalgues nuisibles, les espèces d’Alexandrium ont été répertoriées dans différents écosystèmes côtiers méditerranéens [11,13,14]. Au sud de la méditerranée, la présence d’Alexandrium a été signalée au niveau des côtes marocaines et algériennes [17,19]. Sur les côtes tunisiennes, le genre Alexandrium a été étudié au niveau de la baie et du lac de Tunis [16,21]. Récemment, les toxines paralysantes produites par Alexandrium ont été détectées dans des moules cultivées dans le lac de Tunis, avec des concentrations inférieures à 80 μg STX équivalent/100 g de chaire de moules [21].
Vu la propagation du genre d’Alexandrium dans la Méditerranée, et la rareté des travaux le concernant au niveau de la rive sud et plus particulièrement dans la lagune de Bizerte, le présent travail a essayé de suivre les efflorescences de ce genre et de déterminer les facteurs abiotiques susceptibles de contrôler son apparition dans cette lagune.
Durant cette étude, l’abondance du phytoplancton potentiellement toxique a largement varié au cours des mois (Fig. 4). Pour la majorité des stations (MA, Do, Ch, MJ et TJ), les pics de densité (3,27–11 × 105 cellules L−1) ont été détectés en novembre 2007. Ceci a coïncidé avec les pullulations des espèces d’Alexandrium qui ont été observées dans la plupart des stations (Fig. 5). En effet, ces espèces ont contribué de 20 à 62 % du phytoplancton potentiellement nuisible au cours de ce mois.
Les espèces d’Alexandrium sont capables de former des kystes dont la germination joue un rôle crucial dans leurs efflorescences [33,34]. La pullulation passive d’Alexandrium en novembre 2007 (Fig. 5) pourrait être reliée à une remise en suspension rapide, des sédiments contenant des kystes, par les vents violents de nord-ouest en automne (novembre–décembre) et à leur germination.
Une étude antérieure a signalé une présence sporadique des espèces d’Alexandrium dans la lagune de Bizerte [22]. Au cours de la présente étude, ces espèces étaient aussi observées que sporadiquement en novembre 2007 (dans toutes les stations), en mai et septembre 2008 (dans les stations Ca et TJ) et en janvier 2008 (dans la station Ch) (Fig. 5). Toutefois, lors de l’efflorescence la plus prononcée (en novembre 2007), les densités enregistrées (0,67–7 × 105 cellules L−1) ont dépassé les concentrations seuils d’alerte (104 cellules L−1) fixées par l’Ifremer [35]. Les abondances trouvées au cours de notre échantillonnage sont également plus élevées à celles mesurées dans d’autres écosystèmes côtiers tunisiens, tel que la baie de Tunis (1,16 × 102–1,40 × 103 cellules L−1 [16]) et le lac de Tunis (7 × 103–5,50 × 104 cellules L−1 [18,21]). De plus une étude antérieure dans la lagune de Bizerte a rapporté des concentrations plus faibles (1,9 × 103 cellules L−1 [22]) que celles enregistrées au cours de la présente étude (Tableau 3). Sur d’autres côtes méditerranéennes (exemple : siciliennes et espagnoles), les espèces d’Alexandrium ont été observées à des abondances variables, allant de < 103 cellules L−1 jusqu’à 5 × 106 cellules L−1 [12,14]. La dynamique du phytoplancton potentiellement toxique en générale, et d’Alexandrium en particulier, est évidement reliée à certains facteurs abiotiques [21,36,37]. En Méditerranée, il a été montré que les conditions d’efflorescences d’Alexandrium sont très variables entre les écosystèmes. Par exemple, des efflorescences d’Alexandrium minutum, signalées aux côtes grecques, espagnoles et italiennes, et des efflorescences d’Alexandrium catenella, signalées aux côtes algériennes, ont été reportées à des différentes températures (18–22 °C, 12–15 °C, 16–24 °C, 17 °C, respectivement) et salinité (35–38, 32–38 et 37,2–37,5, respectivement) [12,19,38]. Sur les côtes tunisiennes (exemple, lac de Tunis), les espèces Alexandrium tamarense et A. catenella ont accusé des pics de densité sous des températures respectives de 29,3 et 15,9 °C et des salinités respectives de 40,6 et 36,7 [21]. Au cours de la période d’étude, les efflorescences d’Alexandrium ont été observées à des températures et salinités variant de 15 à 26 °C et de 35 à 38, respectivement.
Les diverses conditions de température et de salinité sous lesquelles les efflorescences d’Alexandrium ont été observées, indiquent que les espèces de ce genre ont des différentes préférences pour ces facteurs abiotiques, donc elles prolifèrent sous des conditions spécifiques à leurs exigences. Certains auteurs ont même déclaré que pour la même espèce A. minutum, des pullulations ont été observées à différentes conditions de température et salinité [38,39].
L’abondance cellulaire d’Alexandrium spp. a été par ailleurs positivement corrélée avec le rapport N:P (r = 0,831, p < 0,01) (Tableau 4), alors qu’au niveau de la lagune de Ganzirri (Nord-Est du Sicile) ce rapport a été négativement corrélé avec l’abondance cellulaire d’A. minutum (r = −0,48, p < 0,05) [40]. Au niveau des côtes grecques, A. minutum a proliféré lorsque le rapport N:P était égal à 26,02 [38]. Au cours de la présente étude, l’abondance maximale de ce genre a été observée quand des rapports ont été nettement plus élevés (72,73 au mois de novembre 2007). L’élévation de ce rapport au niveau de la lagune de Bizerte pourrait être due aux concentrations d’ammonium qui sont assez élevées, atteignant > 55,45 μM en novembre 2007 (Fig. 2h). Cet élément semble favoriser la prolifération des espèces d’Alexandrium dont les abondances ont été positivement corrélées au NH4+ (Tableau 4). Dans d’autre milieux (côtes italiennes, étang de Taiwan), une relation positive a été aussi observée entre la densité d’A. minutum et l’ammonium [40,41]. Dans la lagune de Bizerte, il semblerait donc que les espèces d’Alexandrium ont développé une adaptation aux teneurs élevées en nutriments azotés dans la lagune de Bizerte. En effet, ce site est caractérisé par des eaux eutrophes [25,42], ce qui est aussi confirmé par la présente étude, les différents nutriments ont accusé des valeurs élevées (> 1 μM), surtout l’ammonium dont la teneur a atteint 89,58 μM en novembre 2007, à la station Ch (Fig. 2h). L’abondance de l’azote ammoniacal est une caractéristique des eaux riches en matières organiques puisque c’est le produit de leur dégradation. Il provient de l’hydrolyse des substances azotées rejetées dans l’eau et des fertilisants azotés d’origine agricole. À part la pollution de l’eau, ces concentrations élevées pourraient être expliquées par l’activité d’aquaculture qui se pratique au niveau des stations d’étude. En effet, d’après Giles et Pilditch [43], la production de fèces et de pseudofèces dans les fermes conchylicoles peut augmenter les concentrations de NH4+ dans la colonne d’eau.
Coefficients de corrélation de Spearman entre les abondances d’Alexandrium spp., et du phytoplancton et les facteurs abiotiques.
| Temperature | Salinité | Si(OH)4 | NH4+ | NO2− | NO3− | PO43− | N:P | Si:P | Si:N | |
| Phytoplancton total | ns | ns | 0,572** | ns | ns | 0,463* | ns | ns | 0,537* | ns |
| Phyto. potentiellement toxique | ns | ns | ns | 0,704** | ns | ns | ns | 0,510* | ns | ns |
| Dinoflagellés | ns | ns | ns | 0,859** | ns | ns | ns | 0,765** | ns | ns |
| Diatomées | 0,607** | ns | −0,456* | ns | ns | ns | ns | −0,456* | ns | ns |
| Flagellés | ns | ns | 0,704** | ns | ns | ns | ns | ns | 0,635** | 0,443* |
| Alexandrium spp. | ns | ns | ns | 0,962** | ns | ns | ns | 0,831** | ns | ns |
Durant toute la période d’échantillonnage, une limitation en Si (Si:N < 1 et Si:P < 16:1 ; Fig. 3b, c) et une limitation en P (N:P > 16:1 ; Fig. 3a) ont été probables, entre autre, en novembre 2007 et septembre 2008 pendant lesquels, Alexandrium a proliféré (Fig. 5). Ces résultats suggèrent que la pullulation des espèces d’Alexandrium est surtout dépendante de l’élément N, plus particulièrement de l’azote ammoniacal. Ceci est en accord avec les observations de Franco et al. [38] qui ont reporté une prolifération d’A. minutum lorsque le rapport N:P > 16:1.
5 Conclusions
Cette présente étude a montré qu’au niveau de la lagune de Bizerte, le genre Alexandrium a été présent sporadiquement durant la période allant de novembre 2007 à février 2009. Cependant, lors de son apparition, le genre a accusé des abondances cellulaires très élevées qui ont dépassé les concentrations du seuil d’alerte (104 cellules L−1) fixées par [35]. Les concentrations maximales d’Alexandrium (jusqu’à 7 × 105 cellules L−1) ont été observées en automne, période des vents violents. Ceci pourrait être expliqué d’une part par la remise en suspension des sédiments contenant des kystes de ce dinoflagellé et d’autre part par la présence de facteurs favorables au développement de ces kystes. L’abondance d’Alexandrium a coïncidé avec des concentrations élevées d’ammonium. Cette abondance a été aussi corrélée positivement avec le rapport N:P ce qui est peu commun dans d’autres milieux aquatiques. Ceci suggère une préférence et une adaptation de ce genre aux concentrations très élevées en ammonium caractérisant le site d’étude.
La lagune de Bizerte est une importante zone de production conchylicole. La présence, même sporadique, des espèces d’Alexandrium à des concentrations élevées pourrait constituer un obstacle au développement de l’aquaculture dans la région et un danger aux consommateurs. Une surveillance régulière de ce dinoflagellé dans les eaux de la lagune et de la saxitoxine dans la chair des bivalves s’averre donc nécessaire.
Déclaration d’intérêts
Les auteurs déclarent ne pas avoir de conflits d’intérêts en relation avec cet article.
Remerciements
Nous remercions deux anonymes reviewers pour leurs commentaires utiles.


