1 Introduction
La désertification est considérée comme l’une des problématiques environnementales les plus préoccupantes du XXIe siècle ; c’est un vrai problème pour les environnements arides et semi-arides, où les précipitations sont variables et où les plantes sont soumises à des périodes de sécheresse plus au moins longues [1].
En Algérie, près de 500 000 hectares de terres en zones steppiques sont en voie de désertification, et plus de 7 millions d’hectares sont directement menacés par le même processus [2]. La superficie des parcours dégradés s’est élevée à 7,5 millions d’hectares en 1995 [3]. Cette dégradation, attribuée notamment aux conditions environnementales stressantes, à l’érosion éolienne, au défrichement et au surpâturage, se traduit par des effets de plus en plus néfastes sur les plans écologique et économique. L’amélioration du couvert végétal des massifs forestiers dégradés de l’Atlas saharien par la plantation d’espèces diversifiées adaptées à ces zones permettra une meilleure lutte contre la désertification [4].
Le robinier Robinia pseudoacacia L. est une espèce fixatrice d’azote de la famille des légumineuses. C’est un arbre à croissance rapide, qui peut se développer sur des sols dégradés en raison d’un système racinaire très efficace qui peut s’étendre sur un rayon de 15 m autour du tronc sur les terrains secs [5]. Le robinier émet des stolons grâce auxquels la plante se propage. Aussi l’utilise-t-on souvent pour fixer les terrains menacés d’affaissement (digues, terre-pleins) et pour reboiser les sols stériles. Il colonise naturellement remblais, talus et terrains vagues [6]. Résistant à de nombreux stress environnementaux (basses et hautes températures, sécheresse, polluants atmosphériques), le robinier présente un grand potentiel dans la restauration de la végétation et la régénération des écosystèmes.
L’exploitation de cet arbre à grande échelle nécessite une bonne maîtrise des conditions de germination et de l’élevage des plants. La germination proprement dite est régulée par des caractéristiques génotypiques de la graine, mais aussi environnementales : en particulier, la disponibilité de l’eau dans le sol. Ces facteurs joueraient un rôle important dans l’optimisation du pouvoir germinatif [7,8]. Les graines de R. pseudoacacia L. sont enrobées d’un tégument dur qui joue un rôle de protection, mais qui freine aussi l’entrée de l’eau, empêchant ainsi l’imbibition de la graine. Un pré-traitement des graines est donc nécessaire pour obtenir une bonne imbibition ainsi qu’un meilleur taux de germination [9]. Les pré-traitements réalisés permettent l’élimination de la dormance par leurs effets mécaniques, chimiques et physiologiques [10].
Les objectifs du présent travail sont, d’une part, la détermination des différents types de pré-traitements efficaces afin d’améliorer la faculté germinative des graines de R. pseudoacacia et qui sont à la portée des institutions forestières et, d’autre part, l’étude de la faculté germinative de ces graines sous l’effet d’un stress osmotique induit par différentes concentrations de PEG6000 afin de comprendre l’aptitude des graines à germer en conditions de manque d’eau, et éventuellement de déterminer le seuil de tolérance de ces graines face à cette contrainte dans la nature.
2 Matériels et méthodes
2.1 Matériel végétal
Les graines de R. pseudoacacia L. ont été récoltées au mois de décembre 2014 dans la région de Cherchell (wilaya de Tipaza : 36° 47′25′′Nord, 2° 37′30′′Est).
2.2 Préparation des graines
Les graines de R. pseudoacacia L. ont subi une étape de désinfection, qui consiste à les tremper dans de l’hypochlorite de sodium à 16 % pendant 30 secondes. Les graines sont ensuite rincées abondamment à l’eau du robinet. Ce processus permet l’aseptisation des graines dans le but de les préparer à la germination.
2.3 Effet des différents pré-traitements sur la germination
Pour lever l’inhibition tégumentaire des graines, six pré-traitements ont été effectués. Les graines de R. pseudoacacia L. ont étés reparties en sept lots de 60 graines.
Le premier lot de graines est composé de graines non scarifiées ; c’est le lot témoins. Les six autres lots sont composés de graines essais ayant subi six types différents de scarification : scarification manuelle, qui consiste à réaliser une petite incision à l’aide d’un coupe-ongle sur la partie basale de la graine, scarification chimique par de l’acide sulfurique concentré (H2SO4, 95 % 36 N) et par du peroxyde d’hydrogène (H2O2) à 30 volumes durant des laps de temps différents, scarification physique en plongeant les graines dans de l’eau bouillante pendant des temps différents et par micro-onde à différentes intensités (700 W et 462 W) et pendant des durée différentes (Tableau 1).
Durée des pré-traitements subit par les graines de Robinia pseudoacation L.
| Pré-traitements | Durée |
| Aucun | – |
| Manuelle | – |
| H2SO4 concentré | 15, 30, 45, 60, 75, 90 minutes |
| H2O2 (30 V) | 15, 30, 45, 60, 75, 90 minutes |
| Eau bouillante | 15, 30, 45, 60, 75, 90 minutes |
| Micro-ondes (700 W) | 30, 40, 50, 60, 75, 90, 105, 120 secondes |
| Micro-ondes (462 W) | 30, 40, 50, 60, 75, 90, 105, 120 secondes |
Après scarification, toutes les graines sont lavées à l’eau courante à trois reprises pendant 2 minutes, puis trempées dans l’eau distillée pendant 2 heures pour permettre l’imbibition.
Les graines de chaque lot sont ensuite placées dans des boîtes de Pétri (8,5 cm de diamètre) tapissées de quatre couches de papier filtre saturé en eau distillée, à raison de 60 graines par boîte. Les boîtes de Pétri sont mises à l’obscurité dans une étuve à 28 °C. Le comptage des graines germées est réalisé tous les jours, pendant 8 jours.
Trois répétitions ont étés réalisées pour chaque lot. Le nombre de graines germées dans chaque boîte de Pétri est enregistré et exprimé en pourcentage. La capacité germinative, la vitesse de germination et le pourcentage de réduction de la germination sont déterminées selon les formules suivantes :
2.4 Effet du stress osmotique sur la germination
Les graines de R. pseudoacacia L., prétraitées par scarification manuelle, sont misent à imbiber séparément dans des solutions à concentration dePEG6000 de 0, 2,5 %, 5 %, 7,5 %, 10 %, 15 %, 20 % et 30 %, correspondant respectivement à des potentiel osmotiques de 0, –0,167, –0,452, –0,86, –1,38, –2,78, –4,65 et –9,80 bar, à raison de 60 graines pour chaque concentrations. Après 2 heures d’imbibition, les graines de chaque concentrations sont mises à germer dans trois boîtes de Pétri (8,5 cm de diamètre) tapissées de quatre couches de papier filtre saturées avec la solution d’imbibition, à raison de 60 graines par boîte. Les boîtes de Pétri sont mises à l’obscurité dans une étuve à 28 °C. Le comptage des graines germées est réalisé tous les jours, pendant 8 jours.
Trois répétitions ont étés réalisées pour chaque lot. Le nombre de graines germées est enregistré et exprimé en pourcentage. La capacité germinative, la vitesse de germination ainsi que le pourcentage de réduction de la germination sont calculés selon les formules exprimées plus haut.
Le potentiel osmotique de la solution de PEG6000 a été calculé selon l’équation empirique proposée par Michel et Kaufmann [13] :
où Ys est le potentiel osmotique (bars), C la concentration de PEG6000 en g/L et T la température en °C.
2.5 Tests statistiques
Les données sont présentées sous forme d’une moyenne de trois répétitions ± l’erreur standard ou l’écart-type. Les résultats obtenus ont fait l’objet d’analyse de la variance des moyennes avec les tests Anova à 1 facteur (test de Turkey), pour évaluer les relations significatives entre les différents points.
Les tests sont calculés à partir de l’application Statistica 5.1 pour Windows.
3 Résultats
3.1 Effet des différents pré-traitements sur la germination
La Fig. 1 montre l’évolution du pourcentage de germination des graines de R. pseudoaccacia L. soumises aux différents pré-traitements pendant huit jours d’expérimentation.

Évolution du taux de germination des graines de Robinia pdeudoacacia L. en pour cent en fonction des différents pré-traitements : (A), non scarifié (NS) et scarification manuelle (SM) ; (B), scarification par l’acide sulfurique (H2SO4) ; (C), scarification par l’eau bouillante ; (D), scarification par des micro-ondes (700 W) ; (E), scarification par des micro-ondes (462 W) ; (F), scarification par le peroxyde d’hydrogène (H2O2). Les barres verticales indiquent les écart-types de la moyenne (n = 3). Les astérisques représentent la différence significative avec les témoins à *P < 0,05, **P < 0,01 ou ***P < 0,001, par l’analyse de variance (Anova1), test de Tukey.
En l’absence de scarification, les graines du robinier ne germent pas durant toute la durée de l’expérimentation.
La germination des graines est améliorée par tous les pré-traitements, mais les pourcentages de germination varient selon celui qui est appliqué. Les meilleurs taux de germination sont observés chez les graines ayant subi les scarifications manuelle, par l’acide sulfurique, l’eau bouillante ainsi que par la scarification par les micro-ondes à 700 W. En revanche, les scarifications par le peroxyde d’hydrogène (H2O2) et par des micro-ondes à 462 W donnent des taux de germination relativement faibles (Fig. 1).
Un temps de latence d’au moins 24 h est observé pour les différents pré-traitements. Ce temps est nécessaire pour amorcer le processus métabolique nécessaire à la germination.
Un plateau optimal avoisinant les 83 % de germination est atteint après 8 jours d’expérimentation chez les graines ayant subi une scarification manuelle (Fig. 1A), ce qui représente le meilleur taux de germination des graines traitées.
Pour les autres pré-traitements, le taux de germination varie en fonction de la durée et de l’intensité du pré-traitement (Fig. 1). La scarification avec des micro-ondes à 700 W pendant 105 secondes (Fig. 1D) présente un taux optimal de germination de 70 ± 2,13 %, alors qu’il est de 63,33 ± 7,63 % et 61,68 ± 3,43 %, respectivement, après 90 minutes de pré-traitement à l’eau bouillante (Fig. 1C) et 75 minutes à l’acide sulfurique (Fig. 1B).
La vitesse de germination est nettement plus importantes lorsque les graines subissent une scarification manuelle (21,18 graines/j) et avec l’acide sulfurique (19,45 graines/j), alors qu’elle diminue lorsque les graines sont prétraitées avec de l’eau bouillante pour atteindre une vitesse maximale de 10,1 graines/j (Tableau 2).
Capacité germinative (CG %) optimale et vitesse de germination (VG) optimale, des graines de Robinia pseudoacacia L. soumises aux différents pré-traitements (chaque valeur représente la moyenne de trois répétitions).
| Pré-traitement | Durée optimale du pré-traitement | CG (%) | VG (graines/j) |
| Graines non scarifiées | – | 0 | 0 |
| Scarification manuelle | – | 83,33 | 21,18 |
| Scarification par H2SO4 | 75 minutes | 62,71 | 19,45 |
| Scarification par H2O2 | 75 minutes | 13,33 | 4,19 |
| Scarification par l’eau bouillante | 90 minutes | 63,33 | 10,1 |
| Scarification par les micro-ondes (700 W) | 105 secondes | 70 | 14,06 |
| Scarification par les micro-ondes (462 W) | 120 secondes | 16,66 | 4,4 |
La vitesse de germination devient très faible chez les graines traitées avec H2O2 et avec les moyennes radiations (Tableau 2).
Les scarifications manuelles avec l’acide sulfurique, les fortes radiations et l’eau bouillante permettraient une meilleure imbibition des graines en un laps de temps relativement court, ce qui autoriserait le lancement des activités métaboliques induisant la germination des graines. Ces pré-traitements permettent d’avoir de forts taux de germination rapidement.
3.2 Effet du stress osmotique sur la germination de R. pseudoacacia L.
Les graines de R. pseudoacacia L., après avoir subi un pré-traitement manuel par scarification, sont soumises à un stress osmotique induit par l’addition de concentrations croissantes de PEG6000 (0, 2,5 %, 5 %, 7,5 %, 10 %, 15 %, 20 % et 30 %) dans les solutions d’imbibition, correspondant à des potentiels osmotiques de 0, –0,167, –0,452, –0,86, –1,38, –2,78, –4,65 et –9,80 bar, respectivement. La Fig. 2 représente l’évolution de la germination des graines en fonction du temps. Les graines imbibées dans une solution de PEG6000 de –9,80 bar ne germent pas. Ce potentiel osmotique inhibe totalement la germination. Pour les autres concentrations de PEG6000, les graines présentent une cinétique de germination sigmoïde, avec une phase de latence, une phase exponentielle et un plateau (Fig. 2).
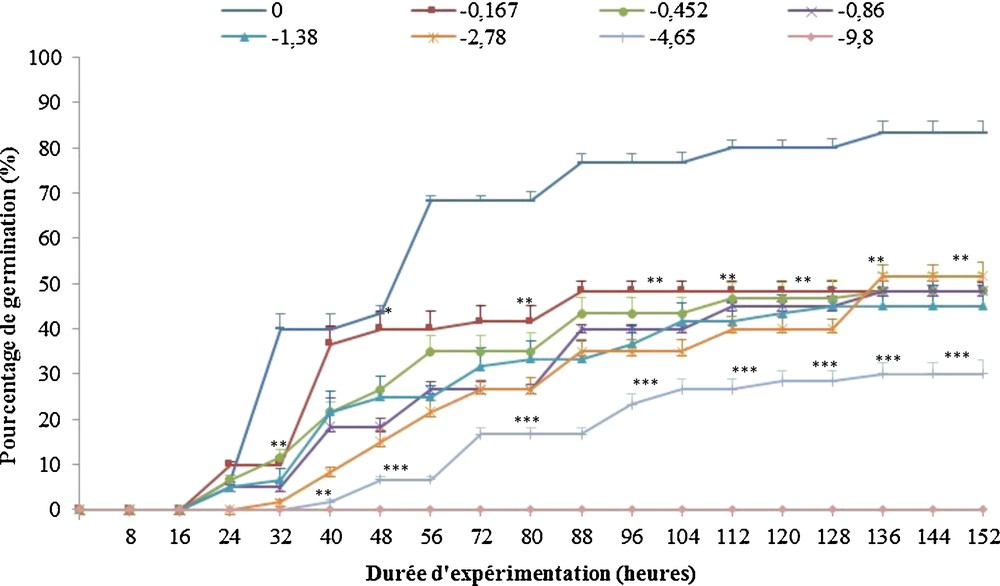
Effet d’un stress osmotique provoqué par différentes concentrations de PEG6000 (en bars) sur la germination des graines de Robinia pseudoacacia L. Les barres verticales indiquent les écart-types de la moyenne (n = 3). Les astérisques représentent la différence significative avec les témoins à *P < 0,05, **P < 0,01 ou ***P < 0,001, par l’analyse de variance (Anova1), test de Tukey.
Le temps de latence augmente avec l’augmentation de la concentration en PEG6000 ; il passe de 16 heures, pour des potentiels osmotiques inférieurs ou égaux à –1,38 bar, à 32 heures pour des potentiels de –4,65 bar.
Un taux maximal de germination de 83,33 ± 2,51 % est observé chez les graines témoins après 136 heures d’expérimentation. Le potentiel osmotique du milieu extérieur étant moins important que celui du milieu cellulaire favorise la bonne circulation de l’eau, permettant ainsi une bonne imbibition des graines. Lorsque le potentiel osmotique des solutions d’imbibition est réduit par l’addition de PEG6000, le taux maximal de germination diminue significativement pour atteindre des valeurs comprises entre 51 ± 3 % et 45 ± 4,58 % pour des potentiels osmotiques inférieurs ou égaux à –2,78 bar, puis chute pour atteindre 30,66 ± 3,21 % seulement lorsque le potentiel de la solution d’imbibition est à –4,65 bar. L’ajout du PEG6000 va réduire la quantité d’eau libre dans les solutions d’imbibition, ce qui limite l’imbibition des graines, réduisant ainsi le pourcentage de germination de près de 70 % lorsque le potentiel osmotique du milieu est de –4,65 bar à –9,80 bar ; le potentiel osmotique de la solution d’imbibition est trop fort et les graines n’arrivent pas à extraire l’eau nécessaire à la germination (Fig. 2).
La capacité de germination des graines témoins (83,33 ± 2,51 %) chute après ajout de PEG6000 pour atteindre 48,33 ± 2,08 % à –0,167 bar (Fig. 3A). La diminution de ce pourcentage devient ensuite plus graduelle et passe à 30,66 ± 3,21 % à –4,65 bars. À –9,8 bar, les graines sont incapables de germer (Fig. 3A).

Évolution de la capacité de germination « CG % » (A), la vitesse de germination « VG » (B) et le pourcentage de réduction de germination « RG % » (C) des graines de Robinia pdeudoacacia L. en fonction de l’intensité du stress osmotique.
Cette diminution de la capacité de germination s’accompagne d’une diminution de la vitesse de germination plus graduelle et passe de 53,93 graines/j à 12,29 graines/j respectivement à 0 et –9,8 bar (Fig. 3B).
Le pourcentage de réduction de la germination présente une cinétique pratiquement inverse à celle de la capacité de germination (Fig. 3C). La réduction de la germination devient importante lors de l’ajout de PEG6000 avec des valeurs de 51,66 % et 70 % respectivement pour les potentiels osmotiques de –0,167 et –4,65 bar, contrairement aux graines témoins, chez qui le pourcentage de réduction de la germination est significativement plus faible (16,66 %) (Fig. 3C).
4 Discussion
Les enveloppes dures des graines de nombreuses espèces forestières, dont les légumineuses, ont évolué pour résister à des conditions défavorables de l’environnement, telles que la chaleur intense, les animaux, la sécheresse, et les dommages physiques. La germination nécessite une rupture de l’enveloppe de la graine pour permettre l’absorption de l’eau par les semences [14].
Nos résultats indiquent que les scarifications manuelles par l’acide sulfurique (75 minutes), par l’eau bouillante (90 minutes) ainsi que la scarification par les micro-ondes (700 W) (105 secondes) permettent d’avoir les meilleurs taux de germination. Ces pré-traitements ont un effet favorable sur la germination en ramollissant le tégument de la graine permettant l’entrée de l’eau. Ces résultats sont en accord avec les observations faites chez Gleditsia triacanthos L. et R. pseudoacacia L. [15,16]. Par ailleurs, une immersion prolongée des graines dans l’acide sulfurique (plus de 75 minutes) provoque la détérioration de l’embryon. Le même résultat est observé lorsque les graines sont laissées dans de l’eau bouillante pendant plus de 90 minutes.
Les différents pré-traitements par l’eau chaude et par l’acide sulfurique sont des pré-traitements de scarification appropriés pour de nombreuses légumineuses arbustives, telles que Acacia salicina, A. pendula, A. cyanophylla et A. floribunda [17] ainsi que pour Leucaena leucocephala et A. farnesiana [18].
Au contraire, la scarification par le peroxyde d’hydrogène et par les micro-ondes à 462 W ne donne pas de résultats encourageants pour l’utilisation de ces deux pré-traitements à grande échelle. Le faible taux de germination obtenu signifie qu’ils n’ont pas réussi à ramollir les téguments des graines de R. pseudoacacia L. de façon efficace.
La scarification manuelle donne les meilleurs taux de germination des graines de R. pseudoacacia L., mais elle nécessite beaucoup de travail et de temps, d’où l’intérêt d’utiliser d’autres pré-traitements tels que l’acide sulfurique et l’eau bouillante afin d’économiser temps et énergie.
Le PEG6000 est un polymère hautement hydrophile ; il retient une grande quantité d’eau, ce qui augmente le potentiel osmotique du milieu externe [19], réduisant ainsi considérablement la circulation de l’eau depuis la solution vers le milieu interne de la graine [20].
Cette étude a permis de constater que la présence de PEG6000 dans les solutions d’imbibition réduit considérablement le taux de germinations des graines de R. pseudoacacia L. Cette diminution est plus importante à un potentiel osmotique de –4,65 bar. La capacité germinative de R. pseudoacacia L. est plus affectée par le stress osmotique que celles données dans la littérature pour des espèces des zones sèches, telles que A. albida, A. dudgeoni, A. seyal [21] et A. raddiana [22,23].
Cette réduction de la germination pourrait être due à un déficit d’hydratation des graines suite à un potentiel osmotique élevé entraînant une inhibition de la dégradation des réserves qui aboutit à la sortie de la radicule hors des téguments et par conséquent un retard de germination des graines [24–26]. Une altération des enzymes et des hormones qui se trouvent dans la graine par suite du manque d’eau pourrait également expliquer cette réduction de la germination [27].
5 Conclusion
La scarification des graines de R. pseudoacaciaest L. est indispensable pour permettre l’imbibition des graines et leur germination. L’aspect simple, propre, peu coûteux et pratique de la scarification avec l’eau bouillante rend ce type de pré-traitement efficace et permet, pour une utilisation à grande échelle, de gagner du temps, de l’effort et de l’argent tout en ayant un bon taux de germination, ce qui permet aux institutions forestières de lutter contre la désertification en leur facilitant la multiplication de cette espèce.
En conditions favorables, les graines scarifiées de R. pseudoacacia L. présentent un taux de germination très important. En conditions de stress osmotique sévère (–4,65 bar), ce taux de germination diminue significativement, ce qui pourrait indiquer une mauvaise tolérance des graines à ce stress au cours de la germination.


