Les organes reproducteurs des plantes à fleurs sont essentiels à la survie des plantes et à leur diversification génétique. Ils produisent également des graines, qui constituent la base de l'alimentation humaine et qui ont contribué à l'émergence de la plupart des civilisations humaines. Néanmoins, la biologie du développement des organes reproducteurs a tendance à être moins étudiée et donc moins bien comprise que celle d'autres organes végétaux, en particulier dans l'ère actuelle basée sur l'imagerie et les techniques « omiques ». Cette situation s'explique d'une part par la complexité de leur composition et de leur génétique, et d'autre part par leur inaccessibilité physique. Un déséquilibre similaire, en termes d'attention scientifique, peut également être observé à l'intérieur de chaque organe. Les anthères sont des organes reproducteurs mâles à l'intérieur desquels de multiples grains de pollen sont produits (Figure 1). Chaque grain de pollen est un minuscule organisme haploïde contenant deux spermatozoïdes (gamètes), inclus dans une cellule haploïde plus grande (cellule végétative), elle-même recouverte d’un manteau pollinique externe résistant et protecteur qui assure la survie prolongée du pollen. À maturité, les grains de pollen sont libérés des anthères et transportent leurs spermatozoïdes jusqu’aux ovules qui sont enfouis dans les organes reproducteurs femelles (les carpelles) (Figure 1), conduisant ainsi à la fécondation. En raison de leur rôle déterminant pour la fécondation, le développement des grains de pollen au sein des anthères a fait l'objet d'une attention considérable. La fécondation de l'ovule femelle par un des spermatozoïdes amené par le pollen conduit au développement de l'embryon. L'ovule fécondé se transforme alors en une graine à l'intérieur de laquelle l'embryon se développe et finira par émerger sous la forme d'une nouvelle plante, assurant ainsi la génération future (Figure 1). Dans les graines matures, les embryons stockent souvent des réserves d'énergie (lipides, protéines et glucides), qui garantissent leur survie lors de la germination, mais qui sont aussi cruciaux pour l'alimentation humaine et animale, ainsi que comme matières premières pour de nombreuses applications industrielles. Par conséquent, le développement de l'embryon dans les graines, tout comme le développement du pollen dans les anthères, a fait l'objet d'une attention considérable.
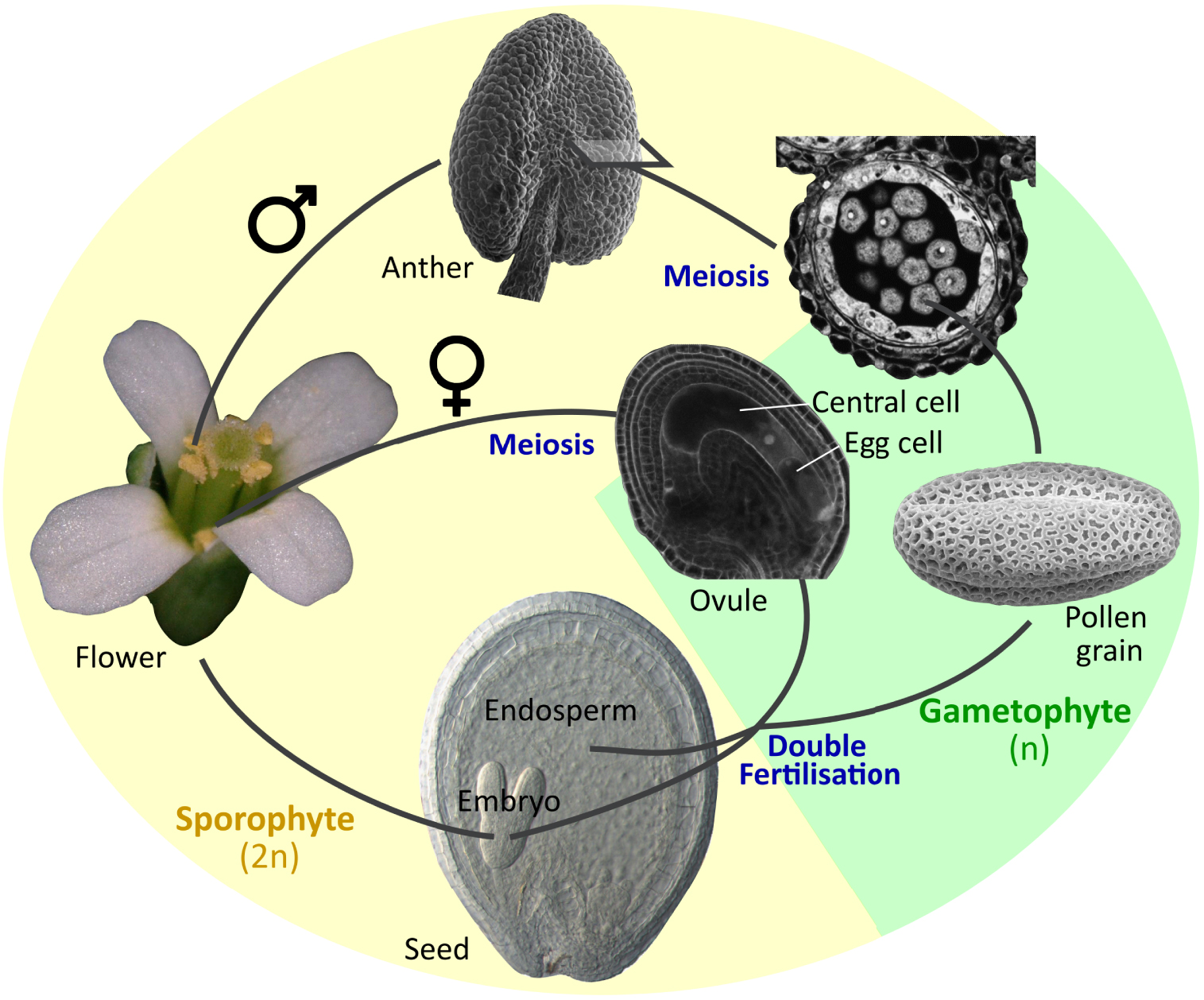
Reproduction sexuée chez Arabidopsis thaliana. Les organes et les tissus mentionnés dans cette étude sont représentés ici.
Toutefois, l'embryon et le grain de pollen ne pourraient achever leur développement en l'absence de tissus "de soutien" qui les entourent et qui les nourrissent pendant leur genèse à l'intérieur de la graine et des anthères. Ces tissus d'importance capitale, respectivement l’albumen et le tapis séminal, font partie des tissus les plus mal compris en termes de biologie du développement chez les plantes, mais aussi des plus fascinants et des plus singuliers. De plus, même si leurs origines génétiques et développementales sont très différentes, leurs fonctions similaires semblent les avoir conduits à développer un certain nombre d'attributs cellulaires et développementaux communs. Cette convergence apparente fera l'objet de cette revue. Dans un souci de simplicité, nous nous concentrerons principalement sur la plante modèle Arabidopsis thaliana, même si nous ferons référence à d'autres espèces lorsque cela s'avérera pertinent.
Par contraintes de place, nous avons décidé de ne pas traiter des fonctions pré-méiotiques et pré-fécondation des cellules précurseurs du tapis et de l'albumen (cellule centrale), bien que des similitudes intrigantes soient également observées à ces stades, notamment en ce qui concerne la transmission de petits ARN aux cellules germinales et aux cellules œuf [1, 2]. Nous avons également choisi de ne pas discuter de certains autres tissus de soutien à la reproduction, tels que le nucelle femelle, qui présente de fortes analogies avec l'albumen et le tapis. Le nucelle, qui est en fait plus analogue au tapis qu'à l'albumen [3] (en termes purement ontogénétiques), a été encore plus fortement négligé par la communauté scientifique.
1. L'albumen : vue d'ensemble de son développement
L'albumen est une innovation des angiospermes, qui réalisent une double fécondation caractéristique au cours de laquelle un tube pollinique livre deux spermatozoïdes génétiquement identiques au gamétophyte femelle multicellulaire situé à l'intérieur de l'ovule. Chez Arabidopsis, un des spermatozoïdes fusionne avec l'ovule pour donner naissance à un zygote diploïde (l’embryon), tandis que l'autre fusionne avec la cellule centrale (qui est doublement haploïde). La fécondation de la cellule centrale déclenche la croissance et la prolifération nucléaire de la cellule triploïde de l'albumen résultante. Ses premières divisions nucléaires se déroulent en l'absence de cytokinèse, ce qui produit un coenocyte doté de plusieurs noyaux, inclus dans un cytoplasme unique qui entoure une grande vacuole centrale. La spectaculaire phase d’expansion initiale de l'albumen coenocytique coïncide avec une phase de croissance plus limitée de l'embryon. Par la suite, la croissance de l'albumen ralentit et l'albumen se cellularise progressivement, en commençant par la zone entourant l'embryon (l'albumen micropylaire) et en progressant vers le point d'attache de l'ovule à la plante mère (la chalaze). La cellularisation est rapidement suivie d’une accélération de la croissance de l'embryon, qui se met à envahir l'albumen. Ce processus s'accompagne d'une séparation, d'une décomposition et d'une élimination contrôlées des cellules de l'albumen, qui sont progressivement remplacées par l'embryon en expansion, de sorte qu'à la maturité de la graine, il ne reste plus qu'une seule couche de cellules de l'albumen [4, 5] (Figure 2A). Bien que le développement de l'albumen soit très variable d'une angiosperme à l'autre, un schéma général de fécondation, d'expansion, d'invasion par l'embryon et d'élimination contrôlée est généralement observé. En effet, même chez les gymnospermes, où seul l'ovule est fécondé et où la prolifération des gamétophytes femelles n'est pas strictement dépendante de la fécondation, les comportements relatifs des tissus des gamétophytes femelles entourant l'embryon en développement (qui sont progressivement éliminés) et de l'embryon fécondé (qui les envahit) semblent être analogues à ceux de l'albumen et de l'embryon des angiospermes [6].
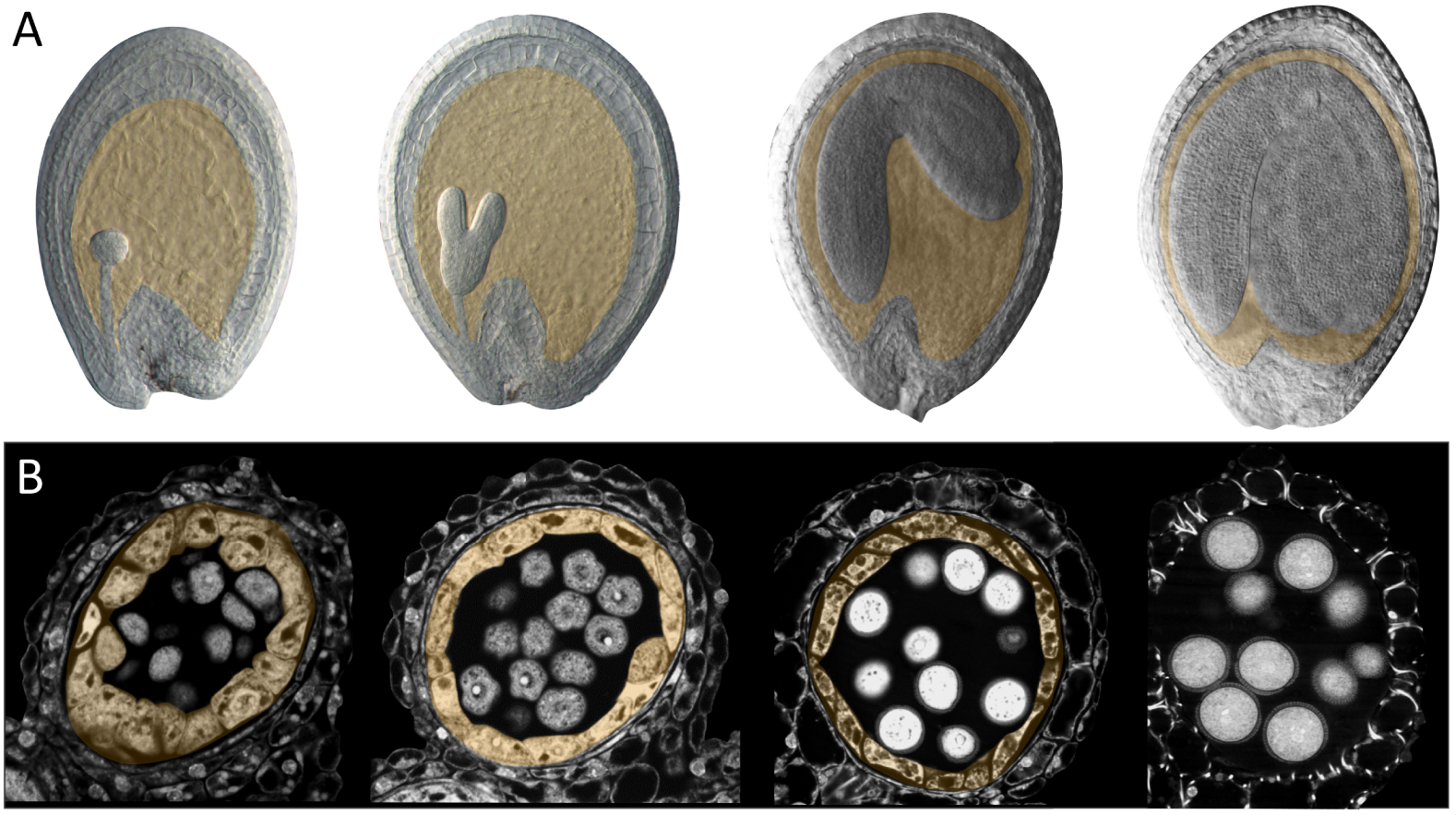
Développement des graines et des anthères chez Arabidopsis thaliana. (A) Développement de la graine d'Arabidopsis. L'albumen (surligné en orange) progresse à partir d'un grand coenocyte multinucléé (premier panneau, embryon au stade globulaire), subit une cellularisation (deuxième panneau, embryon au stade cœur-torpille) et subit ensuite un processus d'élimination progressive au fur et à mesure de l'expansion de l'embryon (troisièmes et quatrièmes panneaux). (B) Développement de l'anthère d'Arabidopsis. Le tapis (surligné en orange) entoure les tétrades post-méiotiques (premier panneau) et les microspores (précurseurs des grains de pollen, deuxième panneau). Au fur et à mesure de la formation du manteau pollinique, le tapis commence à rétrécir (troisième panneau) et finit par être éliminé (quatrième panneau).
2. Le tapis : vue d'ensemble de son développement
Le tapis est la couche de cellules diploïdes entourant le pollen en développement à l'intérieur des anthères (Figure 2B). Le tapis se forme à l'intérieur de la jeune anthère en même temps que d'autres couches cellulaires diploïdes, y compris les précurseurs du futur pollen qui sont situés au centre de l'anthère. Au cours de la différenciation et de la maturation, les cellules du tapis deviennent binucléaires et s’enrichissent de structures complexes, dérivées de l'endomembrane, de vacuoles et d'organites spécifiques au tapis [7]. Les cellules tapétales, initialement entourées d’une paroi cellulaire décelable, procèdent à un remodelage spectaculaire de cette paroi au cours de leur développement. La perte de matière qui en résulte pourraitfaciliter la sécrétion de substances par les cellules du tapis dans l'espace environnant. Ce remodelage coïncide avec un élargissement apparent des connexions cytoplasmiques qui relient les cellules du tapis entre elles, formant ainsi une population fortement interconnectée. Le tapis mature représente donc un continuum symplasmique de cellules sécrétrices hautement actives sur le plan métabolique. Au fur et à mesure du développement des cellules tapétales, les cellules diploïdes voisines, précurseurs du pollen, entrent en méiose et produisent des microspores haploïdes (les précurseurs directs du futur pollen). À ce stade, les cellules du tapis commencent à sécréter de grandes quantités de substances, en particulier en direction des microspores en développement, qui sont en pleine croissance et qui commencent à assembler le manteau pollinique. Par la suite, le tapis est totalement éliminé, libérant davantage de matériel cellulaire qui va être incorporé à la surface du pollen. Là encore, bien que le développement du tapis soit variable d'une angiosperme à l'autre, un schéma général de spécification, d'endoréduplication, de remodelage de la paroi cellulaire, de sécrétion et enfin d'élimination des cellules est observé chez la plupart des espèces [8].
3. Analogies fonctionnelles entre l'albumen et le tapis
L'albumen et le tapis jouent tous deux un rôle de soutien/nourrissage, qui est fondamental pour le développement et la survie respectifs de l'embryon et des grains de pollen. Dans les deux cas, ce rôle peut être divisé en trois fonctions potentiellement distinctes, mais qui se chevauchent probablement : 1) transférer l'énergie et les composants métaboliques depuis les tissus environnants vers l'embryon/les microspores en développement ; 2) assurer la formation et l'intégrité de la surface de l'embryon ou des microspores ; 3) éliminer de façon contrôlée les cellules permettant le recyclage des composants cellulaires (et créer ainsi de l'espace). Chacune de ces fonctions sera abordée tour à tour, en se référant aux stratégies développementales et physiologiques que chaque tissu déploie afin de garantir un résultat optimal (Figure 3).
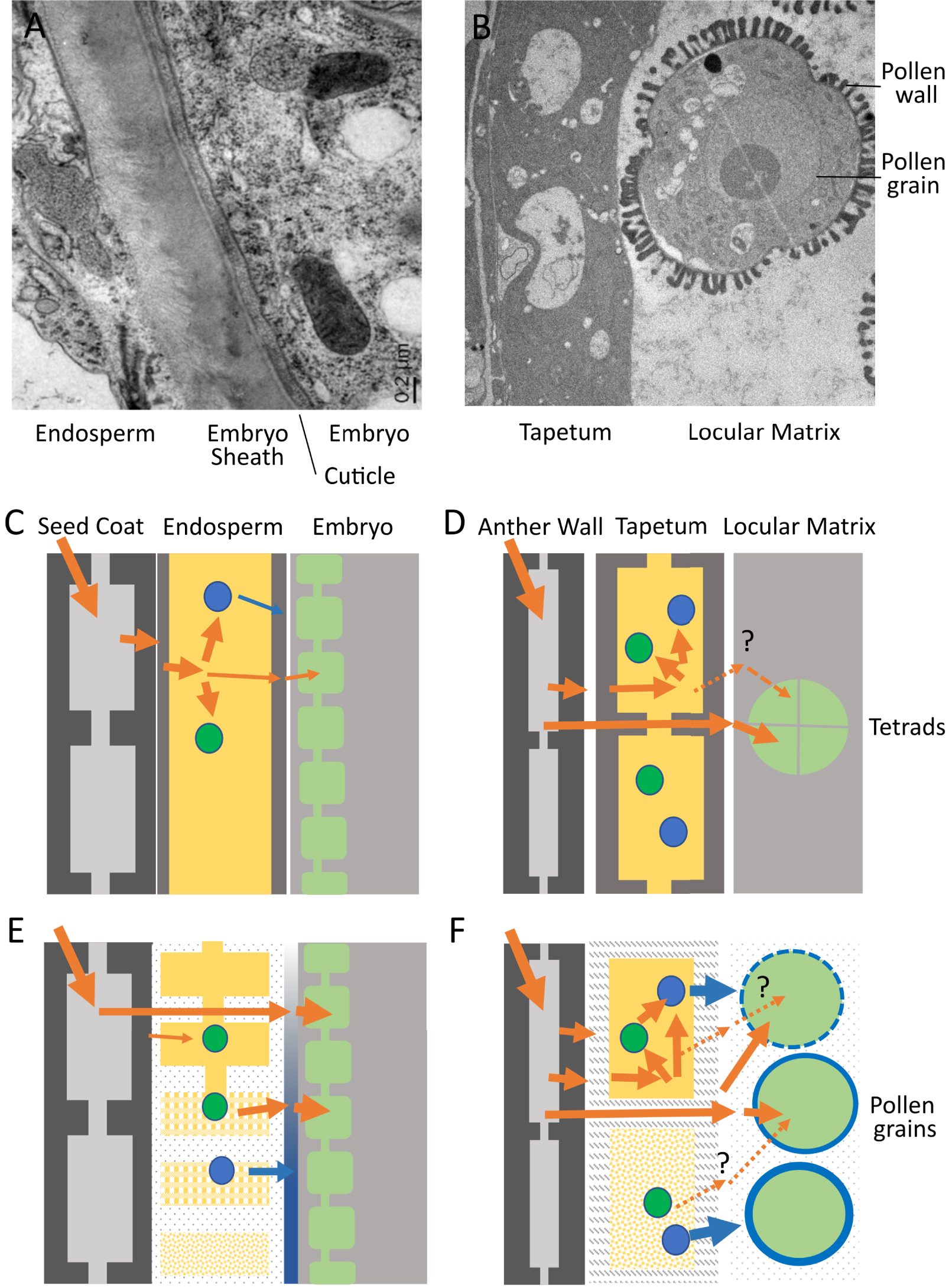
Interfaces albumen-embryon et tapis-pollen chez Arabidopsis thaliana. (A) Micrographie électronique à transmission de l'interface albumen-embryon au stade torpille du développement embryonnaire (pendant l'élimination de l'albumen). (C) Schéma de l'albumen (jaune) et des tissus voisins (tégument et embryon) avant la cellularisation de l'albumen. Les flux de nutriments entrant et sortant de l'albumen coenocytique sont indiqués par des flèches orange. Les nutriments sont stockés transitoirement (sphères vertes) ou convertis en molécules destinées à être déposées à la surface de l'embryon (sphères bleues). (E) Schéma de l'albumen et des tissus voisins après la cellularisation de l'albumen et pendant son élimination (de haut en bas). Les nutriments provenant des tissus maternels peuvent diffuser directement vers l'embryon à travers l'apoplasme de l'albumen qui est progressivement modifié et peuvent, après un stockage transitoire, être remobilisés pour être transférés à l'embryon. Des composants sont sécrétés par l'albumen pour contribuer à la construction de la surface de l'embryon (la gaine, représentée en bleu). (B) Micrographie électronique à transmission de l'interface tapis-pollen pendant le dépôt du manteau pollinique. (D) Schéma du tapis (jaune) et des tissus voisins (paroi de l'anthère et microspores/grains de pollen) avant la libération des microspores. Les flux de nutriments entrant et sortant du tapis sont indiqués par des flèches orange. Les nutriments peuvent être stockés de manière transitoire (sphères vertes) ou convertis en molécules destinées à être déposées dans la paroi du pollen (sphères bleues). Les nutriments provenant des tissus maternels peuvent diffuser directement vers le pollen en développement entre les cellules du tapis. (F) Schéma du tapis et des tissus voisins (paroi de l'anthère et microspores/grains de pollen) après la libération des microspores et pendant l'élimination du tapis (de haut en bas). Les nutriments provenant des tissus maternels peuvent diffuser directement vers le pollen en développement à travers l'apoplasme du tapis et la matrice loculaire progressivement modifiés et, après un stockage transitoire, peuvent être remobilisés pour être utilisés dans la synthèse des composants du manteau pollinique. La question de savoir si les nutriments stockés sont remobilisés et réexportés du tapis pour alimenter le développement du grain de pollen reste ouverte. Des composants spécifiques sont sécrétés par le tapis avant et pendant son élimination pour participer à la construction du manteau pollinique (en bleu).
3.1. Transférer l'énergie et les composants métaboliques depuis les tissus environnants vers l'embryon/les grains de pollen en développement
L'albumen et le tapis agissent comme des conduits par lesquels les nutriments nécessaires au développement de l'embryon et des microspores doivent passer. L'embryon et les microspores emmagasinent des quantités considérables d'énergie au cours de leur croissance et de leur maturation, afin de se préparer à la dormance et à la germination finale. L'énergie, stockée sous forme de lipides, de protéines et de glucides (amidon), entre dans l'embryon et dans les microspores sous forme de sucres et d'acides aminés, qui soit servent de matières premières, soit fournissent l'énergie nécessaire à la conversion enzymatique par le biais de la respiration. La manière dont ces molécules sont transférées à l'embryon et/ou aux microspores a fait l'objet d'un intérêt considérable, notamment en raison de la présence de barrières symplasmiques dans les organes reproducteurs des plantes [9, 10]. Les cytoplasmes de nombreuses cellules végétales voisines sont reliés par des pores régulables appelés plasmodesmes, générant des connexions dites symplasmiques. Peu après la fécondation, l'albumen d'Arabidopsis perd ses connexions symplasmiques avec l'embryon en développement et les tissus maternels environnants [11]. De même, bien que le tapis forme un continuum symplasmique, il est symplasmiquement isolé à la fois des microspores en développement et des couches cellulaires externes de l'anthère, et ce avant même le début de la méiose [12]. L'importance de cet isolement symplasmique pour la physiologie, le développement et/ou la défense n'est pas claire. Par conséquent, il n'existe ni de connexions cytoplasmiques au sein de la graine entre l'albumen et les tissus maternels ou l'embryon, ni au sein de l’anthère entre le tapis et les couches cellulaires externes, ou les microspores pendant les phases les plus métaboliquement actives de leur développement. Cela signifie que tous les sucres, acides aminés et minéraux entrant dans l'embryon et la microspore doivent être absorbés à travers la membrane plasmique à partir de l'espace apoplasmique environnant (la paroi cellulaire). Deux scénarios, non exclusifs, sont donc possibles (Figure 3).
Scénario 1
Les sucres et autres métabolites du phloème sont libérés dans l'apoplasme entourant l'albumen/le tapis et sont ensuite importés au sein des cellules de l'albumen/du tapis. Ils sont ensuite réexportés (souvent après une période de stockage temporaire sous forme d'amidon ou de lipides, suivie d'une remobilisation) par l'albumen ou le tapis vers l'embryon/les microspores. Ce phénomène peut se produire aussi bien dans l'albumen que dans le tapis, mais n'a été démontré de manière concluante que dans le contexte de l'albumen, qui peut être considéré comme un véritable tissu de stockage transitoire d'énergie [13, 14] (Figure 3A). Dans l'anthère, le tapis, comme d'autres cellules de la paroi de l'anthère, peut contenir de l'amidon ainsi que des corps lipidiques. Cependant, il est difficile de savoir si ces composés servent essentiellement à alimenter l'activité frénétique de biosynthèse et de sécrétion qui a lieu dans les cellules du tapis elles-mêmes (voir ci-dessous), ou s'ils peuvent également être remobilisés vers les microspores sous forme de sucres (Figure 3B).
Au cours des premiers stades du développement de la graine, l'albumen absorbe des sucres et d'autres osmolytes qui permettent de soutenir sa croissance initiale particulièrement rapide et qui peuvent également être stockés de manière transitoire, en vue d'une remobilisation ultérieure destinée à alimenter le développement de l'embryon. L'albumen, comme le tapis, est donc en lui-même un puits nutritif/énergétique majeur. En effet, il a été proposé que l'absorption précoce de nutriments par l'albumen, qui stimule sa croissance, puisse être la cible d'un conflit parental chez les Angiospermes en raison de l'introduction d'un génome mâle dans l'albumen par double fécondation, ce qui pourrait placer l'embryon et l'albumen en conflit direct pour les nutriments maternels [15]. Les travaux de Kohler et de ses collègues [16] ont conduit à la proposition que la cellularisation de l'albumen, qui est favorisée par les génomes maternels mais réprimée par les génomes paternels dans l'albumen, pourrait fournir un contrepoids décisif dans ce conflit en favorisant un deuxième scénario de transport des nutriments, décrit ci-dessous.
Scénario 2
Les sucres et autres métabolites du phloème pourraient être libérés dans l'apoplasme entourant l'albumen ou le tapis. Ils pourraient ensuite diffuser entre les cellules de ces tissus, à travers l'apoplasme, et être absorbés directement par l'embryon ou le grain de pollen. Dans ce scénario, l'albumen/tapis peut être efficacement contourné, et l'énergie/les métabolites peuvent se déplacer directement vers leur puits final, l'embryon ou les microspores. Là encore, il existe des preuves de ce scénario dans les graines, basées à la fois sur un traçage des métabolites et sur le suivi de l'expression de transporteurs de sucres [13, 14]. Cependant, la question a été moins étudiée dans les anthères, où les données d'expression génique à résolution spatiale ainsi que les études de traçage métabolique font défaut. Dans le contexte du scénario 2, il est néanmoins intéressant de noter que les interfaces apoplastiques entre les cellules du tapis et entre le tapis et les microspores, ainsi qu'entre les cellules de l'albumen et entre l'albumen et l'embryon, sont considérablement modifiées lorsque les besoins énergétiques de l'embryon/des microspores augmentent [7, 17, 18]. Dans la graine, cela prend la forme d’un amincissement des parois cellulaires de l'albumen et, du moins chez Arabidopsis, à la fragilisation et à l'expansion de l'interface apoplasmique entre l'embryon et l'albumen, impliquant le dépôt d'une matrice riche en glycoprotéines [10] (Figure 3A). Dans l'anthère, cela prend la forme d’une perte apparente de la paroi cellulaire du tapis et à la dégradation de la matrice de callose entourant les microspores qui est remplacée par le fluide loculaire [7] (Figure 3B). La question de savoir si, et le cas échéant comment, ces changements influencent la diffusion moléculaire au sein de ces espaces intercellulaires n'est pas encore tranchée.
3.2. Garantir la formation et l'intégrité de la surface de l'embryon ou des microspores
L'albumen et le tapis ne se contentent pas d'acheminer les métabolites de base nécessaires à la croissance et à la synthèse des composés stockés dans les embryons et les microspores, ils synthétisent et libèrent également des molécules spécialisées indispensables à la construction des surfaces protectrices qui recouvrent les embryons et les microspores à maturité. Certaines de ces molécules sont impliquées dans la communication entre l'albumen et l'embryon, ou entre le tapis et la microspore ; une telle communication est requise pour une bonne coordination de ces tissus lors de la construction de ces surfaces protectrices. Par exemple, des recherches récentes ont révélé que des dialogues médiés par des peptides de la même famille sont essentiels pour, d'une part, garantir l'intégrité de la cuticule et de la gaine anti-adhésive protégeant l'embryon au cours de son développement et lors de la germination [17, 19, 20], et d'autre part pour activer l'activité sécrétrice du tapis au moment de la libération de la microspore et d'autre part pour activer l'activité sécrétrice du tapis au moment de la libération de la microspore [21]. Dans les deux cas, des précurseurs inactifs des peptides de signalisation de la famille CASPARIAN STRIP INTEGRITY FACTOR (CIF) sont libérés par l'embryon dans la graine (TWISTED SEED1) et par le tapis dans l'anthère (CIF3 et CIF4). Ils sont ensuite activés par des protéases de la famille des subtilases, libérées par l'albumen dans la graine (y compris ABNORMAL LEAF SHAPE1) et par les microspores/le pollen en développement dans l'anthère. La détection des peptides actifs par les récepteurs GASSHO1 et GASSHO2 permet la formation correcte de la cuticule et de la gaine de l'embryon, ainsi que la stimulation du tapis et la mise en place de la paroi du pollen dans l'anthère.
En plus de ces dialogues, l'albumen et le tapis sécrètent des composants structurels qui sont intégrés dans les surfaces de l'embryon et de la microspore, respectivement. Dans la graine, ce processus est relativement peu connu, bien que les glycoprotéines qui forment la gaine de l'embryon proviennent clairement de l'albumen [17] (Figure 3A). La question de savoir si d'autres composants de surface, tels que les monomères de la cuticule, pourraient provenir de l'albumen n'a pas encore été étudiée. En revanche, il est clair que le tapis joue un rôle majeur dans la formation complexe du manteau pollinique qui s'assemble à la surface de la microspore [22]. Le tapis participe à la dégradation de la couche de callose qui entoure les microspores pré-méiotiques, un processus indispensable pour permettre un assemblage organisé du manteau pollinique. Il synthétise ensuite de nombreux monomères impliqués dans l'assemblage de ce manteau, y compris les constituants du polymère très résistant qu'est la sporopollénine [23, 24] (Figure 3B). Ces composés sont activement secrétés par le tapis, en même temps que de potentielles protéines chaperonnes telles que les LIPID TRANFER PROTEINS Ces composés sont activement secrétés par le tapis, en même temps que de potentielles protéines chaperonnes telles que les LIPID TRANFER PROTEINS [25], ainsi que d'autres composants de la matrice loculaire entourant les microspores en développement. La production de ces composés inhabituels, dont de grandes quantités sont requises par les microspores en développement, explique probablement une grande partie de la biologie en apparence unique du tapis.
3.3. Élimination contrôlée des cellules et recyclage du matériel cellulaire (et création d'espace)
L'albumen et le tapis sont tous deux des tissus transitoires destinés, à terme, à disparaître. Cependant, la mort cellulaire observée dans ces tissus, du moins chez Arabidopsis, est assez différente de la mort cellulaire associée à la sénescence qui se produit, par exemple, dans les feuilles d'automne, ou des voies de mort cellulaire qui donnent naissance aux vaisseaux creux du xylème. L'élimination des cellules de l'albumen et du tapis implique le démantèlement total des cellules et le recyclage en apparence complet de leur contenu [7, 26]. Ce processus semble nécessaire au succès de la reproduction et est fortement régulé à la fois dans l'albumen et dans le tapis. Dans les deux cas, le démantèlement de la paroi cellulaire se produit bien avant l'élimination des cellules [7, 17, 18]. Dans l'albumen, l'assouplissement de la paroi cellulaire et la séparation cellulaire qui en résulte ont été proposés comme des prérequis importants à la mort cellulaire, puisqu'ils facilitent l'écrasement physique de l'albumen par l'embryon en expansion. En effet, la mort de l'albumen est retardée si la croissance de l'embryon est défectueuse, et ce même si l'assouplissement de la paroi cellulaire a eu lieu [18]. L'élimination cellulaire est strictement régulée, probablement en lien avec les besoins métaboliques de l'embryon en croissance. Une fois libérés des polymères de la paroi cellulaire, les sucres peuvent être absorbés directement par l'embryon en développement et agir comme des métabolites primaires. Pendant ce temps, le contenu cellulaire semble être décomposé en sucres, en acides aminés et en minéraux essentiels, qui sont exportés vers l'apoplasme par l'intermédiaire d'une variété de transporteurs, avant leur vraisemblable absorption par l'embryon [27]. Chez Arabidopsis, le processus d'élimination de l'albumen est régulé par des hétérodimères des facteurs de transcription de type hélice-boucle-hélice ZHOUPI, qui est spécifique de l'albumen, et d’INDUCER OF CBP EXPRESSION 1, qui est ubiquitairement exprimé. Le complexe entre ces deux facteurs de transcription est nécessaire à l'expression de nombreuses enzymes modifiant la paroi cellulaire. Par conséquent, les albumens dépourvus de ce complexe se développent et se cellularisent normalement, mais ne subissent pas d'amincissement/modification de la paroi cellulaire ni d'élimination des cellules, et ne peuvent pas être envahis par l'embryon en expansion, dont la croissance reste donc très limitée et dont la viabilité est considérablement compromise [18, 28, 29]. Bien que l'albumen de ces mutants finisse par mourir lorsque les graines se dessèchent au moment de la maturation, le recyclage du contenu cellulaire ne semble pas se produire.
Dans les anthères, la dégradation du tapis permet de libérer une dernière vague de substances lipidiques et protéiques qui s'intègrent à la surface du manteau pollinique [24, 30]. Ces substances semblent être importantes pour la viabilité du pollen, ainsi que pour les interactions des grains de pollen avec les surfaces réceptives des organes femelles [31]. Cela est notamment souligné par le fait que les mutants défectueux dans l'élimination du tapis présentent des défauts au niveau de la paroi du pollen et une viabilité réduite du grain de pollen [32].
En résumé, les cellules de l'albumen et du tapis correspondent à la définition des "cellules nourricières", dans la mesure où elles fournissent des nutriments, des matériaux de croissance et un soutien physiologique à leurs voisines. Malgré leurs origines ontogénétiques et évolutives très différentes, les cellules du tapis et les cellules de l'albumen partagent des similitudes frappantes, à la fois en termes de fonctions (fourniture de nutriments et d'autres composés structurellement importants aux microspores et à l'embryon en développement) et, ce qui est peut-être plus surprenant, en termes des stratégies cellulaires et développementales qu'elles emploient pour remplir ces fonctions. La manière dont des mécanismes moléculaires similaires ont été sélectionnés dans ces tissus au cours de l'évolution des angiospermes n'est pas encore claire. La visualisation des mouvements moléculaires au sein des organes végétaux et la compréhension du contrôle de la communication intercellulaire entre les compartiments des organes reproducteurs des plantes restent quelques-uns des nombreux défis techniques non résolus qui freinent les travaux dans ce domaine. Relever ces défis et répondre à ces questions devrait constituer un terrain fertile pour les biologistes cellulaires, développementaux et évolutifs au cours des prochaines décennies.
Conflits d’intérêts
Les auteurs n'ont aucun conflit d'intérêts à déclarer.




 CC-BY 4.0
CC-BY 4.0