1 Introduction
Le métabolisme du muscle squelettique joue un rôle important pour l'ensemble de l'organisme [1]. L'étude des réserves lipidiques au niveau musculaire est une question d'intérêt en raison des relations qui existent entre le niveau des lipides et certains syndromes métaboliques [2]. De récentes études montrent que le niveau des lipides musculaires est bien corrélé avec l'insulinorésistance [3,4] et qu'il peut être affecté par le régime alimentaire et par l'exercice musculaire [5,6]. Ces lipides musculaires sont stockés sous forme de lipides intramyocytaires (LIMC) ou extramyocytaires (LEMC). Les LIMC sont stockés sous forme de petites gouttelettes lipidiques dans le sarcoplasme en apposition étroite aux mitochondries. Ils ont une forme sphérique et se répartissent dans les fibres musculaires. Les LEMC, qui se trouvent entre les fibres musculaires participent peu dans le métabolisme et peuvent servir de réserves à long terme. Ils se caractérisent par une distribution spatiale peu homogène, influencée toutefois par la présence des fibres musculaires [7,8].
Différentes techniques biochimiques et histologiques ont été utilisées pour déterminer la concentration des lipides musculaires mais elles nécessitent des biopsies. Les techniques histologiques permettent de discriminer les deux types de lipides mais toute quantification précise reste difficilement réalisable [6]. En outre, la quantification des lipides par des techniques biochimiques reste difficile à cause de la dissection imparfaite des lipides adipocytaires placés entre les fibres musculaires, dissection qui contamine la quantification des LIMC.
Depuis quelques années, la spectroscopie proton RMN est devenue une méthode de choix pour étudier in vivo les deux types de lipides musculaires en se fondant sur la différence entre les susceptibilités magnétiques des gouttelettes lipidiques des myocytes et des dépôts de lipides stockés dans les adipocytes. Cette différence provoque un déplacement relatif des fréquences de résonance des protons de ces deux types de lipides. L'effet est maximal lorsque les fibres musculaires se trouvent parallèles à l'orientation du champ magnétique directeur B0 et sa valeur est égale dans ce cas à 0,2 ppm [8].
La quantification de ces lipides par une méthode spectroscopique, qui s'appuie par exemple sur une technique d'échos de spins à l'acquisition et un traitement du signal imposant des connaissances a priori, nécessite la connaissance de leurs temps de relaxation transversale respectifs. De telles mesures ont été déjà réalisées chez l'homme à différentes valeurs de champ, alors qu'à notre connaissance, aucune étude n'a été réalisée chez le rat.
Par conséquent, l'objectif de cette étude est de mesurer les temps de relaxation transversale in vivo des lipides IMC et EMC chez le rat Zucker afin de disposer de bonnes connaissances a priori lors de la quantification des signaux correspondants.
2 Matériels et méthodes
2.1 Animaux
Cette étude a été réalisée sur une population de six rats Zucker obèses males provenant des laboratoires Charles River (Saint Germain/L'Arbresle, France), pesant entre 380 et 560 g. Ils ont suivi un régime alimentaire standard. La température de l'animalerie était maintenue à 22 ± 2 °C et l'hygrométrie à 50 ± 20% au cours d'un cycle de jour–nuit de 12 heures/12 avec un éclairage de 8 à 20 h. Le rat obèse (porteur de la mutation fatty (fa/fa)) est caractérisé par une obésité avec hyperphagie. Ce modèle développe spontanément l'insulinorésistance et des désordres lipidiques décrits chez les diabétiques de type 2. Les animaux ont été anesthésiés avec un mélange air, oxygène et isoflurane à raison de 3% pendant deux à cinq minutes lors de l'induction et de 1,5 à 2% pendant l'entretien. La température corporelle a été maintenue par un lit à circulation d'eau chaude.
2.2 Spectroscopie RMN in vivo
Les expériences ont été réalisées sur un système Bruker Biospec 7 T avec aimant horizontal, en utilisant pour l'émission une antenne cage d'oiseau (diamètre intérieur de 72 mm) et pour la réception, une antenne de surface (diamètre de 15 mm). La patte postérieure du rat est positionnée sur l'antenne de surface de sorte que les fibres musculaires soient parallèles au champ magnétique statique pour avoir la meilleure séparation possible des LIMC et LEMC. Une série de 16 coupes transversales et jointives de 1 mm d'épaisseur a été réalisée au niveau de la patte de l'animal avec la séquence d'écho de spins (TR/TE = 500/11 ms, un champ de vue de 30 × 30 mm et une matrice 256 × 256) afin d'avoir un bon contraste entre le tissu musculaire et les tissus avoisinants. Ces images servent à positionner le volume d'intérêt au niveau du muscle.
L'acquisition de six séries de sept spectres a été effectuée dans le triceps sural avec la séquence PRESS (voxel de 4 × 4 × 4 mm3, 1024 accumulations, TR = 2500 ms et TE variable de 18, 24, 36, 51, 72, 105 et 150 ms). La correction des inhomogénéités du champ statique au premier et au deuxième ordre a été obtenue par la méthode FASTMAP [9]. La suppression du signal de l'eau a été effectuée par la technique VAPOR (Variable Pulse Power and Optimized Relaxation delay) [10]. Cette méthode de suppression est fondée sur l'utilisation de sept impulsions sélectives dont les puissances et les délais sont combinés de manière à améliorer la suppression de l'eau. Afin d'éliminer la contamination du signal provenant des zones situées à l'extérieur du volume d'intérêt, nous avons utilisé la technique OVS (Outer Volume Saturation) [10].
2.3 Traitement des données
Les séries de données ont été traitées dans le domaine temporel. La suppression des composantes résiduelles de l'eau a été réalisée en utilisant l'algorithme de décomposition en valeurs singulières Hankel Lanczos (HLSVD, j-MRUI) [11]. Le pic de créatine totale a été choisi comme référence et fixé à 3,05 ppm. Les lipides sont quantifiés avec la méthode AMARES [12] en introduisant les déplacements chimiques comme connaissances a priori.
Les temps de relaxation transversale T2 des groupements méthylène des LIMC et LEMC sont évalués par une méthode de type moindre carré non linéaire fondée sur une fonction modèle mono-exponentielle des amplitudes estimées.
3 Résultats
L'acquisition du spectre proton au niveau musculaire a été réalisée avec une largeur à mi-hauteur du pic de l'eau de l'ordre de 16 Hz. La Fig. 1 montre un spectre proton et la localisation du voxel dans le triceps sural. Ce spectre permet d'identifier les différents pics correspondant principalement au groupement méthyle (–CH3) des LIMC (~0,9 ppm) et LEMC (~1,1 ppm), aux groupements -(CH2)n- des LIMC (~1,3 ppm) et LEMC (~1,5 ppm). Les pics larges et mal résolus entre 1,5 et 2,9 ppm correspondent à d'autres groupements –CH2– α et β de la chaîne des triglycérides. Le pic situé à 3,05 ppm correspond au signal total de la créatine et la phophocréatine (Crt3) avec l'apparition vers 3,9 ppm d'un doublet correspondant au signal du groupement –CH2– de créatine (Crt2) et qui est un indicateur de la position parallèle des fibres au champ magnétique statique [7].
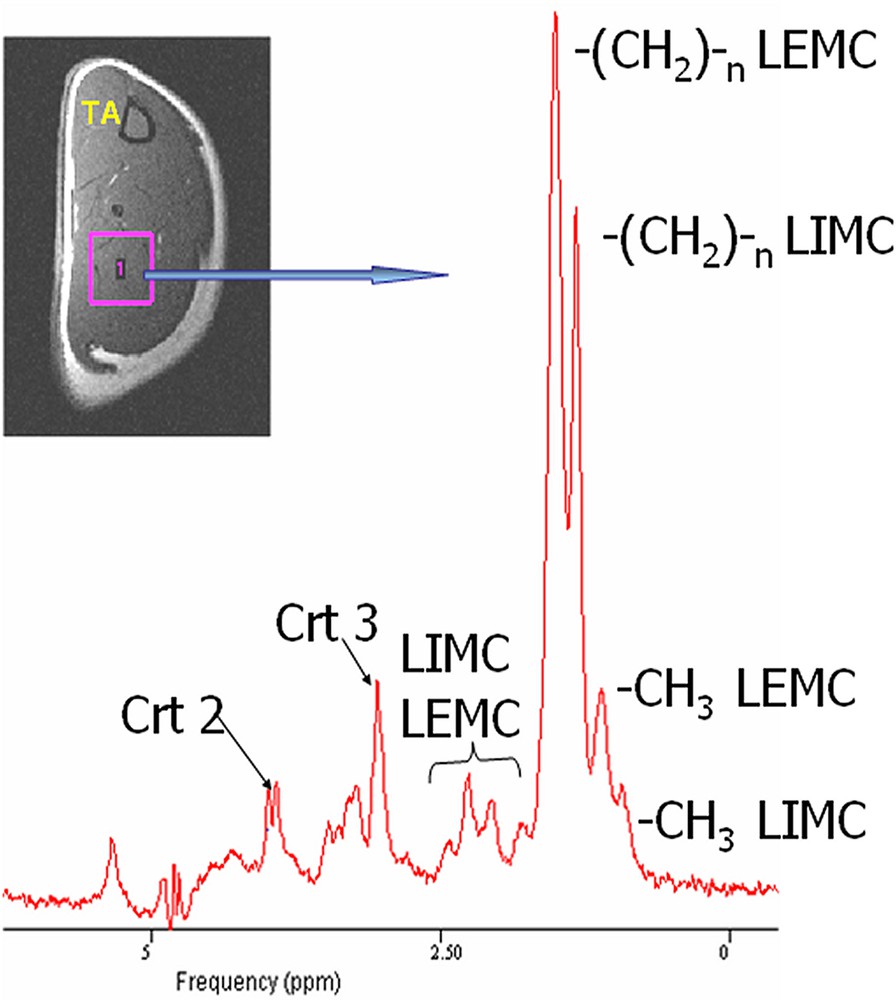
Localisation du voxel d'intérêt dans le triceps sural du rat et spectre proton correspondant réalisé avec une séquence PRESS.
L'évolution du signal RMN en fonction du temps d'écho, ainsi que la modélisation des différentes composantes du spectre par la méthode AMARES sont présentées dans la Fig. 2. Les valeurs de T2 mesurées chez le rat Zucker à 7 teslas sont présentées dans le Tableau 1. Le temps de relaxation transversale des protons –(CH2)n– LEMC est légèrement plus court que celui qui est mesuré pour les LIMC. On peut comparer ces valeurs avec les résultats obtenus chez l'homme à bas champ [13,14] ; les valeurs de T2 sont plus faibles dans notre étude, ce qui correspond à la valeur élevée du champ statique utilisé.
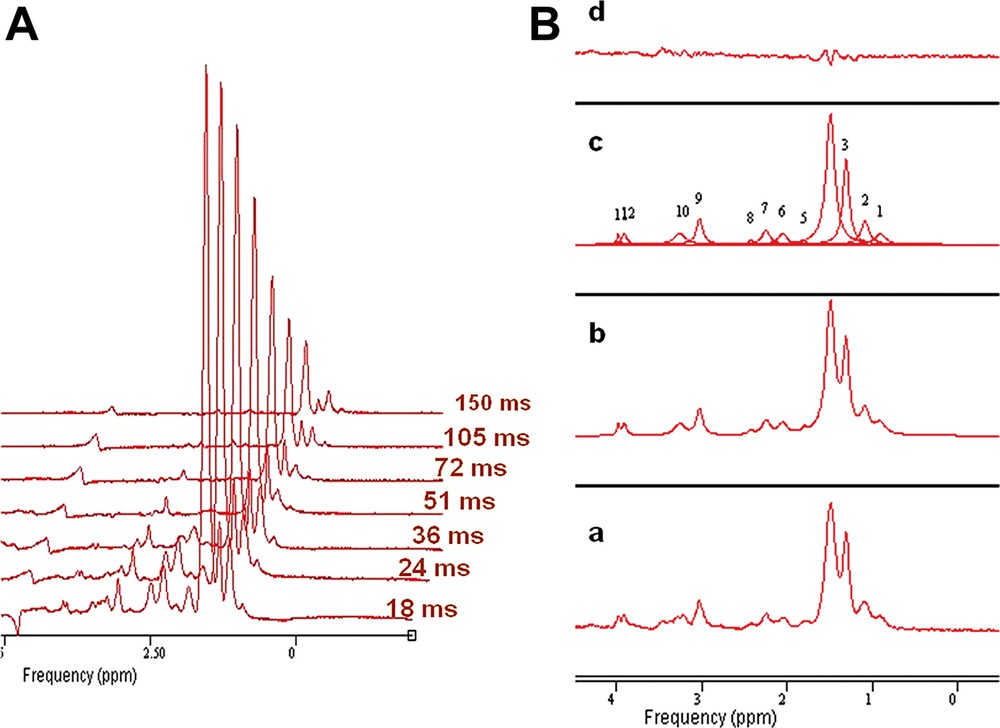
(A) Évolution des amplitudes des spectres obtenues du triceps sural en fonction des différentes valeurs de temps d'écho. (B) Modélisation par j-MRUI des différentes composantes d'un spectre proton au niveau musculaire : (a) spectre original traité, (b) spectre estimé, (c) composantes individuelles et (d) résidu.
4 Conclusion
La spectroscopie proton à 7 teslas des fibres musculaires de la patte postérieure (triceps sural) peut conduire à une bonne discrimination in vivo entre les LIMC et les LEMC chez le rat Zucker. Cette discrimination permet de mesurer séparément les temps de relaxation transversaux des protons des groupements méthylène correspondants.
Dans ce travail, les expériences ont été réalisées par une technique de spectroscopie à voxel unique, associée à une élimination du signal de l'eau. Les valeurs des temps de relaxation ont été extraites à l'aide du logiciel de quantification j-MRUI. Ces valeurs sont du même ordre de grandeur que celles qui sont mesurées chez l'homme, mais à champ plus faible. La connaissance de ces grandeurs représente une donnée utile pour la quantification in vivo de ces deux types de lipides lorsque l'on utilise une séquence faisant intervenir des échos de spins.


