1 Introduction
La transmutation des actinides mineurs (américium, curium) nécessite de les extraire au préalable des solutions de produits de fission issues de la dissolution des combustibles nucléaires usés après extraction de l'uranium et du plutonium par le tributylphosphate (procédé PUREX) [1,2]. Les malonamides ont été retenus pour assurer l'extraction de ces actinides mineurs dans le procédé DIAMEX (diamide extraction) [2,3]. L'un des composés le plus étudié de cette famille est le N-N′-diméthyl-N-N′-dibutyl-2-tétradécylmalonamide (DMDBTDMA) qui possède une longue chaîne alkyle centrale (Fig. 1) lui conférant une forte insolubilité en milieu aqueux, indispensable dans un procédé d'extraction liquide–liquide mais aussi des propriétés surfactantes. De nombreuses études [4] ont été conduites pour appréhender les phénomènes se déroulant lors du processus d'extraction. Une des principales limitations du procédé est liée à l'apparition d'une troisième phase dans certaines conditions telles qu'une concentration en DMDBTDMA de 0,5 mol/L en présence d'une phase aqueuse contenant 3,2 mol/L en HNO3 [5]. L'apparition de cette troisième phase (ou la séparation de la phase organique en deux phases) est précédée d'un phénomène de micellisation de l'extractant [6].
Les malonamides étudiés : le DMDBPMA (R = C5H11) et le DMDBTDMA (R = C14H29).
Une technique privilégiée pour étudier ces phénomènes de micellisation, de façon non intrusive, est l'utilisation des gradients de champ en résonance magnétique nucléaire (RMN). En effet, les séquences d'impulsions du type PFGSE ou pulse-field gradient spin-echo [7,8] permettent de déterminer le coefficient d'autodiffusion des espèces présentes en solution. Un traitement mathématique approprié de ces données de diffusion permet de réaliser des expériences DOSY ou diffusion-ordered spectroscopy, qui se présentent sous la forme de cartes 2D dans lesquels la première dimension représente le spectre proton et la seconde, les coefficients de diffusion de chaque composé (Fig. 2). Ainsi, chaque espèce présente en solution, et dont la durée de vie est suffisamment grande par rapport à l'échelle de temps de la RMN, peut être séparée de façon spectrale suivant son coefficient d'autodiffusion. La diffusion d'une molécule est liée à ses propriétés de taille et de forme ainsi qu'à son environnement (diluant, monomère ou agrégat, température) [9a]. Cette technique permet d'accéder individuellement à des informations d'ordre physique et chimique au sein même d'un milieu complexe [9b].
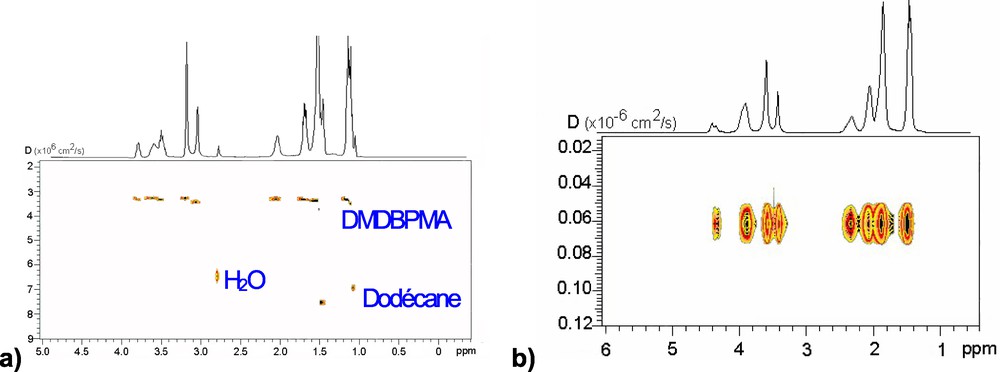
Spectres DOSY : a) du DMDBPMA à 0,75 mol/L dans le dodécane-d26 équilibré avec H2O ; b) du DMDBPMA pur.
La diffusion d'un surfactant est considérablement réduite lorsqu'il se trouve sous forme agrégée. Un processus d'association peut alors être mis en évidence de façon sensible par la mesure du coefficient d'autodiffusion qui résulte généralement d'une population moyenne [10] de surfactants libre et micellisé :
| (1) |
| (2) |
Ce qui donne :
| (3) |
| (4) |
Cette étude a pour but de mesurer les coefficients d'autodiffusion des malonamides afin d'examiner leur comportement micellaire en milieu dodécane. Deux composés, le DMDBTDMA et le DMDBPMA (N-N′-diméthyl-N-N′-dibutyl-2-pentylmalonamide) (Fig. 1), dont la seule différence provient de la longueur de la chaîne alkyle centrale (14 et 5 atomes de carbone, respectivement), sont étudiés dans le but d'explorer l'influence de la partie hydrophobe sur le comportement des micelles. La différence de structure entre ces deux molécules permet également de modifier les conditions d'apparition d'une troisième phase.
2 Conditions opératoires
Les deux malonamides, synthétisés par la société PANCHIM, ont été utilisés sans purification supplémentaire. À température ambiante, ces deux composés sont des liquides translucides très visqueux (environ 120 Cp). Les solutions ont été préparées avec du dodécane deutéré (viscosité d'environ 1,55 Cp), dont la pureté en deutérium est égale à 98 % (société Cortecnet). Les concentrations varient de 10−3 à 2,8 mol/L pour le DMDBPMA et de 10−3 à 1,8 mol/L pour le DMDBTDMA dans le dodécane-d26. La phase organique ainsi obtenue est mise en contact avec une phase aqueuse (eau ultrapure) afin de saturer le malonamide en eau. Après agitation et centrifugation, les deux phases sont séparées. Pour les expériences réalisées en milieu anhydre, les solutions ont été préparées sous atmosphère inerte (argon) après que les différents malonamides aient séjourné dans une étuve, à 110 °C, pendant trois jours.
Les spectres RMN 1H ont été enregistrés à 399,94 MHz sur un spectromètre Varian unity INOVA 400 à 25 °C. Les gradients ont, dans un premier temps, été calibrés en mesurant le coefficient d'autodiffusion du signal résiduel HDO dans un échantillon contenant 100 % de D2O, à 25 °C [12]. Pour les malonamides, les coefficients de diffusion ont, ensuite, été déterminés à partir des signaux entre 3,4 et 4 ppm des protons H1 et H2 (respectivement, N–CH2 et CH central), des signaux entre 3 et 3,5 ppm des protons H3 (N–CH3) et des signaux vers 2 ppm des protons H4 (protons situés sur la chaîne pentyle ou tétradécyle, en bêta de la fonction amide) (Fig. 3) [13]. Pour les solutions de malonamide pures, un capillaire contenant du benzène deutéré a été rajouté afin de permettre le réglage en champ du spectromètre. Les valeurs des coefficients de diffusion sont calculées par régression linéaire des décroissances exponentielles des signaux, à l'aide de l'équation 5 [9]. Les erreurs obtenues sur les valeurs n'excédent pas 2 % (moyenne des écarts standards).
| (5) |
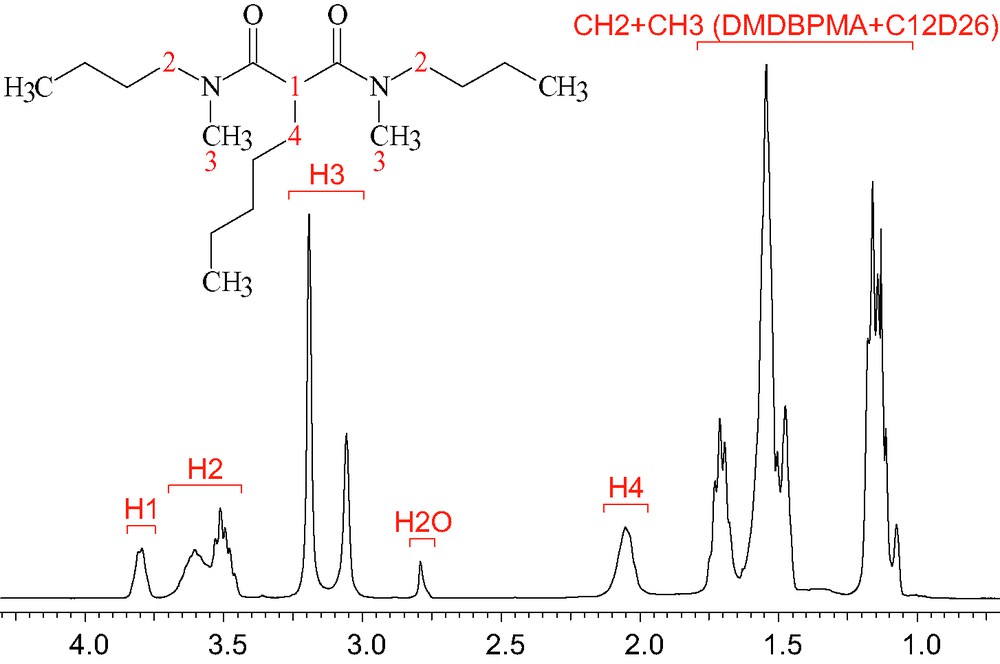
Spectre RMN-1H du DMDBPMA à 0,75 mol/L dans le dodécane-d26 équilibré avec de l'eau.
Le coefficient d'autodiffusion du dodécane deutéré, déterminé dans les mêmes conditions, est égal à (6,80 ± 0,05) × 10−6 cm2/seconde à 25 °C. Par ailleurs, la viscosité des différentes solutions n'étant pas encore mesurée au moment de la rédaction de ce document, les rayons hydrodynamiques des agrégats n'ont pas pu être calculés à partir de la relation de Stokes-Einstein.
Dans le cas du système malonamide–dodécane-d26–eau, les molécules d'eau présentes en phase organique, suite à leur extraction par le malonamide, sont caractérisées par un signal assez fin et peu intense, dont le déplacement chimique varie entre 2 et 4 ppm. L'intégration de ce signal n'a pas permis de suivre avec précision la concentration en eau dans la phase organique en raison, dans certains cas, de la superposition de ce signal avec ceux du malonamide. Les quantités d'eau présentes en phase organique ont donc été déterminées par coulométrie, par la méthode de Karl-Fischer. Ces dosages ont été réalisés à l'aide du coulomètre Methrom E547.
La séquence Dbppste ou DOSY bipolar pulse pair stimulated echo [8] utilisée pour la détermination des coefficients d'autodiffusion est fondée sur l'utilisation des gradients bipolaires. Quelques paramètres, parmi lesquels le délai de diffusion
3 Résultats et discussion
3.1 Coefficients d'autodiffusion des malonamides
Dans le cas des surfactants classiques, les coefficients d'autodiffusion en fonction de la concentration totale
- • pour de faibles concentrations (inférieure à la
- • au-delà de la
Dans le cas des malonamides étudiés (DMDBPMA et DMDBTDMA), l'allure des courbes
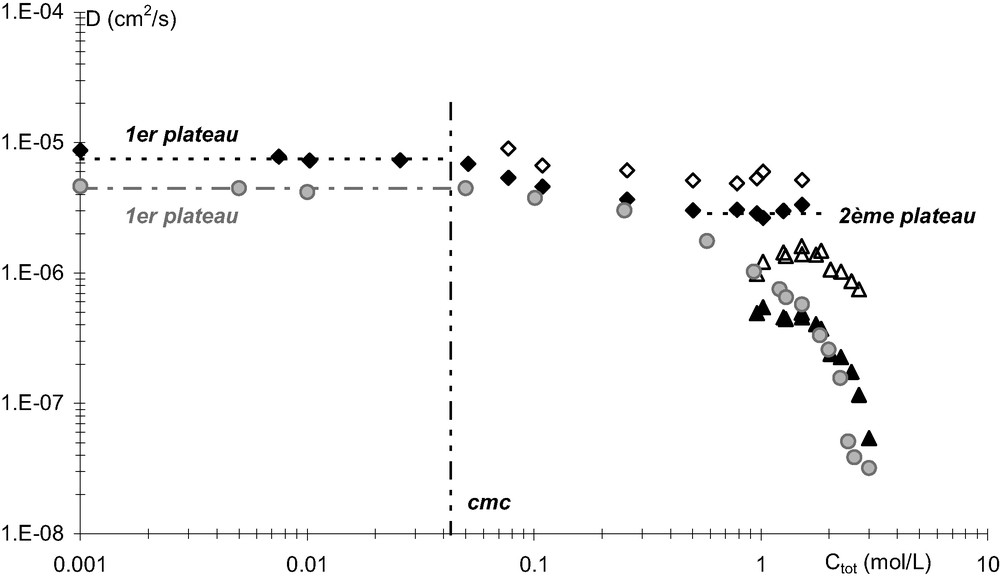
Coefficients d'autodiffusion du DMDBPMA saturé en eau (motifs noirs) et de l'eau (motifs blancs) dans les deux phases organiques (losanges : phase la moins dense ; triangles : phase la plus dense) et du DMDBPMA en milieu anhydre (triangles gris) dans le dodécane, à 25 °C.
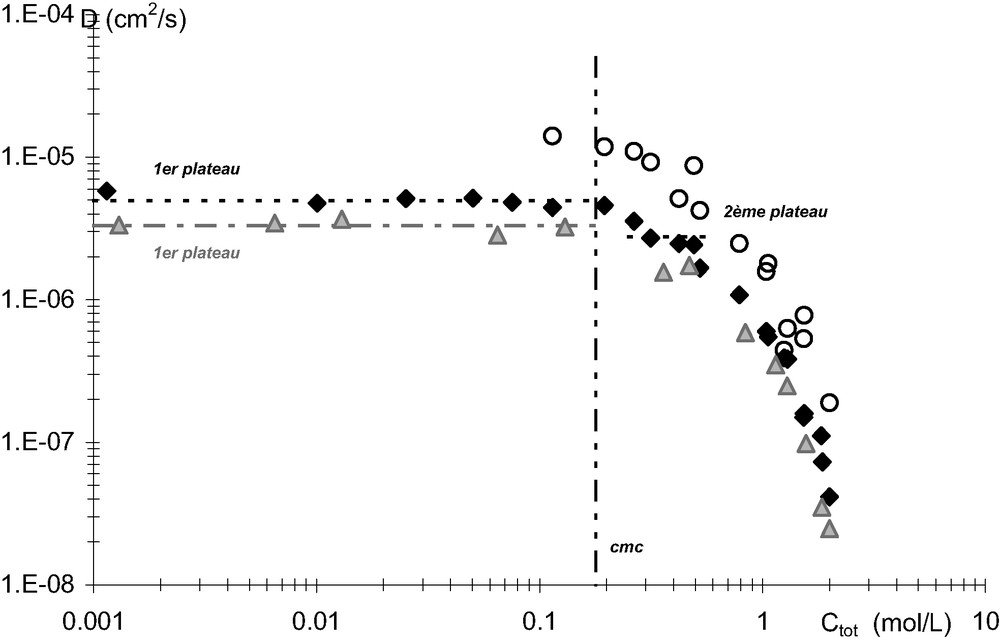
Coefficients d'autodiffusion du DMDBTDMA saturé en eau (losanges noirs), de l'eau (ronds blancs) et en milieu anhydre (triangles gris) dans le dodécane, à 25 °C.
Pour des concentrations totales en malonamide comprises entre 10−3 et 0,5 mol/L, il est toutefois possible de caractériser un comportement de surfactant (Fig. 6). L'équation 2 est appliquée et permet de déterminer les valeurs des coefficients d'autodiffusion de la molécule sous sa forme monomère et micellisée ainsi que la
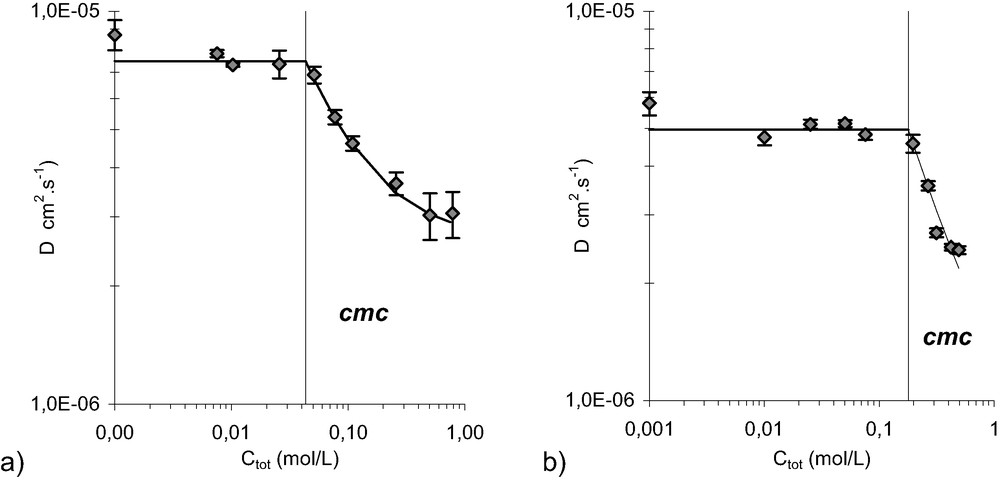
Coefficients d'autodiffusion observés (motifs gris avec barre d'erreur) et calculés (courbe) : (a) pour le DMDBPMA saturé en eau ; (b) pour le DMDBTDMA saturé en eau.
Coefficients d'autodiffusion des malonamides DMDBPMA et DMDBTDMA sous leur forme monomère (
| DMDBPMA | DMDBTDMA | |||
| saturé | anhydre | saturé | anhydre | |
| Dmono (× 106 cm2/seconde) | 7,48 ± 0,21 | 4,43 ± 0,13 | 4,96 ± 0,18 | 3,31 ± 0,21 |
| Dmic (× 106cm2/seconde) | 2,63 ± 0,06 | — | 0,60 ± 0,08 | ≈ 0,4 |
| cmc (mol/L) | 0,043 ± 0,005 | 0,179 ± 0,005 |
La différence de structure entre le DMDBTDMA et le DMDBPMA qui ne porte que sur la différence de longueur de chaîne alkyle centrale, confère au DMDBTDMA une structure plus typique de surfactant que pour le DMDBPMA. À partie hydrophile identique, le comportement micellaire devrait être plus prononcé pour une molécule dont la partie hydrophobe est plus importante lorsque sa concentration totale dans le dodécane augmente. Or, les résultats du Tableau 1 montrent que ce n'est pas le cas : la
Pour des concentrations totales de malonamide supérieures à 0,5 mol/L, le comportement du DMDBPMA diffère de celui du DMDBTDMA lorsque les phases organiques sont équilibrées avec de l'eau. En effet, dans le cas du DMDBPMA une troisième phase apparaît (deuxième phase organique). Nous aborderons ce point dans le paragraphe 3.3.
En absence de démixtion, les coefficients d'autodiffusion des deux malonamides chutent très rapidement de deux décades. Un équilibre chimique entre deux espèces agrégées de malonamides ne suffit pas à modéliser
La Fig. 7 montre qu'une élévation de 10 °C de la température de la phase organique (de 25 à 35 °C) augmente
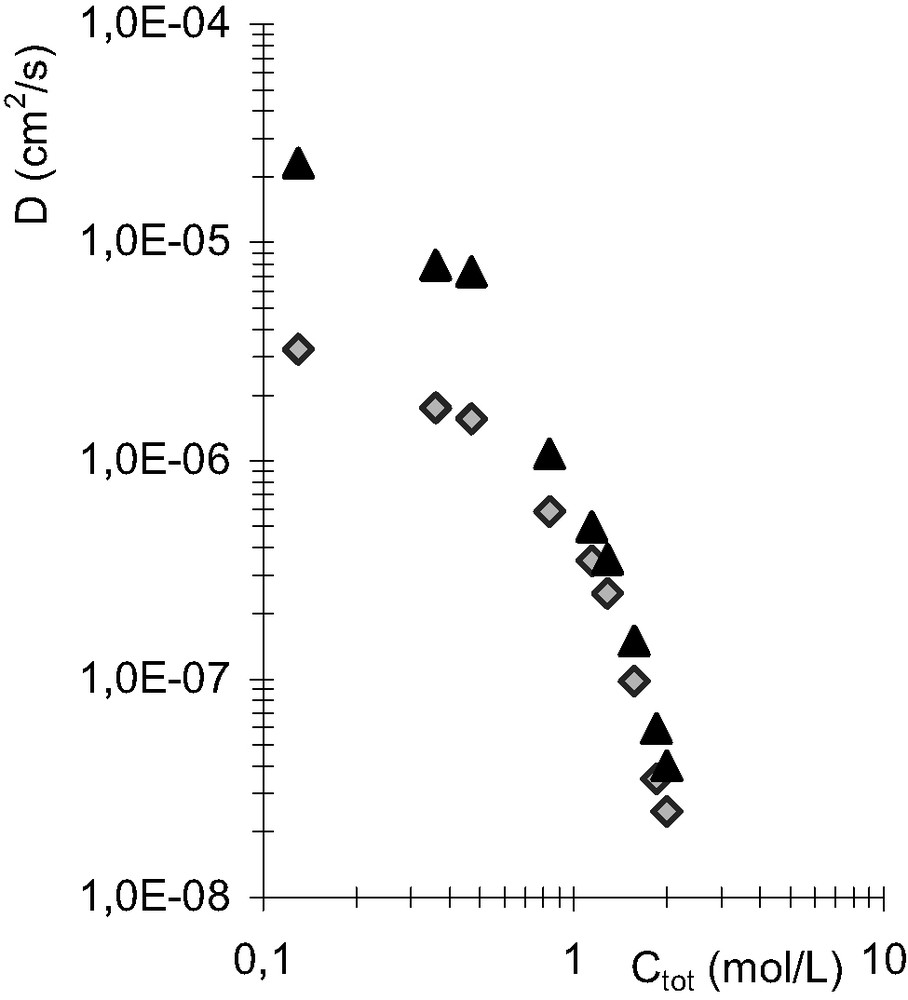
Coefficients d'autodiffusion du DMDBTDMA anhydre à 25 °C (losanges gris) et à 35 °C (triangles noirs), dans le dodécane.
Sur les Figs. 4,5, nous pouvons observer que la présence d'eau dans la phase organique provoque une légèrement augmentation des coefficients d'autodiffusion des malonamides.
3.2 Coefficients d'autodiffusion de l'eau
Sur les Figs. 4 et 5 sont représentées les coefficients d'autodiffusion des molécules d'eau présentes en phase organique en fonction de la concentration totale en malonamide. Ils diminuent lorsque que la concentration en malonamide augmente mais restent toujours plus élevés que ceux des malonamides (DMDBTDMA ou DMDBPMA). Les valeurs des coefficients d'autodiffusion de l'eau sont toutefois inférieures à celui d'une molécule d'eau au sein d'une phase aqueuse à 25 °C,
L'eau extraite en phase organique est dépendante de la concentration en malonamide dans le dodécane (Fig. 8) : à faibles concentrations, il y a environ une molécule d'eau pour dix de DMDBTDMA mais lorsque que le malonamide est plus concentré, la concentration d'eau dans la phase organique tend vers celle de la concentration en DMDBTDMA. Si l'eau était libre dans le dodécane, l'augmentation importante de sa concentration dans la phase organique devrait s'accompagner d'une évolution du coefficient d'autodiffusion de l'eau extraite vers celui d'une molécule d'eau en phase aqueuse
- • par la résidence des molécules d'eau dans un domaine topologiquement clos (micelles inverses) dont la diffusion est globalement plus faible. La détermination ultérieure des rayons hydrodynamiques moyen
- • par l'interaction des molécules d'eau avec des édifices topologiquement ouverts (agrégats aplatis ou allongés) perturbant ainsi les chemins de diffusion naturels (autodiffusion) de l'eau.
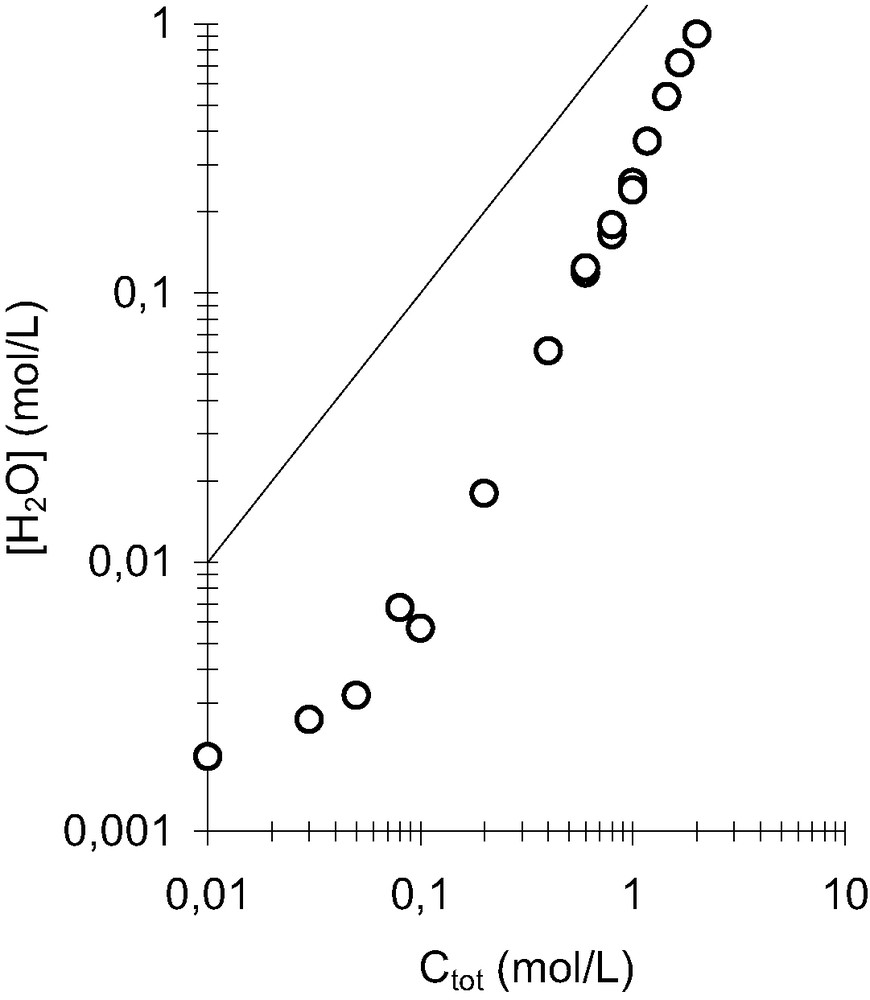
Concentration en eau présente en phase organique en fonction de la concentration de DMDBTDMA dans le dodécane à 25 °C. La droite illustre un rapport
L'importante quantité d'eau présente dans la phase organique pour des concentrations élevées en malonamides conduit à une démixtion de la phase organique dans le cas du système DMDBPMA–dodécane–eau.
3.3 Apparition de la troisième phase
Le phénomène d'apparition d'une troisième phase a déjà été constaté dans certaines conditions expérimentales (en présence d'acide et/ou d'ions métalliques) pour le DMDBTDMA [4]. Il s'agit de la séparation de la phase organique en deux autres phases non miscibles. La phase la moins dense est généralement riche en solvant alors que la phase lourde est riche en malonamide.
Dans le cadre de cette étude sur les systèmes malonamide–dodécane–eau, la démixtion de la phase organique n'est observée que lors de la préparation de solutions de DMDBPMA pour des concentrations supérieures à 1 mol/L dans le dodécane. Elle n'a pas lieu lorsque ces préparations sont effectuées en absence d'eau sous atmosphère d'argon et à partir de DMDBPMA préalablement déshydraté.
Les deux phases organiques sont étudiées séparément et les coefficients d'autodiffusion de chaque espèce (DMDBPMA et eau) reportés sur la Fig. 4.
D'après les spectres protons, la phase organique la moins dense est essentiellement constituée de dodécane deutéré (d ≈ 0,864) avec une faible concentration en DMDBPMA (d ≈ 0,93) et en eau (d ≈ 1) (concentrations non déterminées lors de la rédaction du document). Les valeurs des coefficients d'autodiffusion du DMDBPMA ainsi que ceux de l'eau sont dans la continuité des valeurs obtenues avant la démixtion. Le comportement du malonamide dans cette phase de faible densité peut donc être assimilé à un surfactant globalement micellisé.
Les phases les plus denses présentent des spectres de protons dont les signaux du DMDBPMA et de l'eau ont une intensité relative plus grande que ceux du dodécane (concentrations non déterminées lors de la rédaction du document). La proportion de dodécane deutéré est si faible qu'il devient difficile d'obtenir le signal du lock. La courbe
4 Conclusion
Le choix des molécules extractantes s'est porté sur le DMDBPMA et le DMDBTDMA afin de connaître le rôle de la chaîne alkyle située entre les deux fonctions amides dans la diffusion de ces composés, pour le système ternaire malonamide–dodécane–eau. Pour ce dernier ainsi que pour le système binaire malonamide–dodécane, les deux molécules présentent un comportement similaire vis-à-vis de la diffusion. Les valeurs des coefficients d'autodiffusion du DMDBTDMA sont plus faibles que pour le DMDBPMA, ce qui est cohérent avec sa structure plus volumineuse. De plus, la grande similitude dans l'allure des différentes courbes
De plus, l'eau joue un rôle déterminant lors de la démixtion de la phase organique contenant du DMDBPMA mais aucune conclusion ne peut être portée sur le rôle structurant des malonamides en phase organique.


