Dans la famille des molécules fluorescentes, celle des difluoro-boradipyrrométhène ou bora-indacènes (notée F-Bodipy) a gagné en notoriété, et est particulièrement attractive pour les chimistes, les biochimistes et les physiciens. Depuis leur découverte, faite par le Pr. Treibs en Allemagne en 1968 [1], le nombre d'applications n'a cessé de croître, et comprend plusieurs volets aussi éclectiques que l'utilisation en tant que sondes pour les biomolécules [2], dans les capteurs [3], dans la livraison ciblée de médicaments [4], dans les interrupteurs fluorescents [5], pour les films électroluminescents [6], en tant que pigments laser [7], dans les capteurs de lumière [8], ou encore la photosensibilisation de cellules photovoltaïques [9]. D'un point de vue fondamental, les F-Bodipy ont été utilisés à bon escient comme piège à électron dans des paires électron/trou générées électriquement [10], et comme promoteurs d'états quartet à spin polarisé [11]. Dotées de propriétés exceptionnelles, comme un rendement de fluorescence élevé, l'impossibilité de former des états triplets de façon classique, un profil d'absorption intense et unique, une excellente solubilité et une robustesse chimique, photochimique et thermique, les Bodipy captent l'attention de nombreux scientifiques sur la scène internationale. De plus, la panoplie des molécules disponibles a augmenté de façon significative depuis qu'il a été rendu possible de lier de façon covalente différentes fonctions et groupes fonctionnels sur les unités pyrroles [12], sur la position méso pontant les deux sous-unités pyrroles [13], ainsi que sur les positions N-ortho de ces mêmes pyrroles [14]. Récemment, le laboratoire a développé une chimie nouvelle et innovante de l'atome de bore, qui est à l'origine de progrès significatifs dans l'ingénierie de nouveaux fluorophores aux propriétés ciblées. En particulier, il a été montré que certaines molécules possèdent une grande différence d'énergie entre celle absorbée et réémise [15], qu'elles sont capables de transporter favorablement des électrons et des trous et de générer de la lumière par électroluminescence.
Afin d'illustrer les progrès réalisés dans le domaine des sondes fluorescentes, on peut considérer le problème du faible déplacement de Stokes inhérent aux fluorophores organiques. Ce problème est fondamental pour les utilisateurs de la technique de cytométrie de flux, qui utilise une détection par fluorescence. Récemment, deux équipes, celle du Pr. Burgess, aux États-Unis [16], et celle du Dr Ziessel, en France [17], ont proposés de façon indépendante de nouveaux prototypes, dans lesquels des polycycles aromatiques ont été greffés de façon covalente sur des sondes à base de F-Bodipy. L'irradiation dans le polycycle aromatique anthracène pour les molécules 1 et 2 et pyrène pour les molécules 3 et 4 engendre un processus de transfert d'énergie excitonique extrêmement rapide vers le fragment F-Bodipy, qui fluoresce alors avec des rendements quantiques supérieurs à 60%. Le bilan de ces processus intramoléculaires est l'obtention virtuelle d'une différence d'énergie entre la lumière incidente et la lumière émise supérieure à 10 900 cm−1 dans le cas du composé 3. Une caractéristique intéressante de ces systèmes est l'arrangement orthogonal des chromophores polyaromatiques liés à un atome de bore tétraédrique, évitant ainsi un recouvrement orbitalaire entre les différents fragments. Ce concept est le moteur même du raisonnement développé dans cette revue. Notons que la vitesse du transfert d'énergie dépend de la structure du système tandem et que celle-ci décroît avec une augmentation de la distance centre à centre. Ce phénomène est parfaitement en accord avec un mécanisme de transfert d'énergie par dipôle induit, ou mécanisme de résonance. Pour l'ensemble des molécules exposées, l'efficacité est supérieure à 90%, et ceci même dans les systèmes les plus élaborés et très délocalisés [17]. Il est à noter que la vitesse de transfert d'énergie est plus rapide lorsque le fragment anthracène est connecté le long de l'axe moléculaire de l'accepteur F-Bodipy, comme c'est le cas dans la molécule 2, à l'inverse de la molécule 1, dans laquelle le centre donneur est connecté sur le petit axe ou en position méso [16].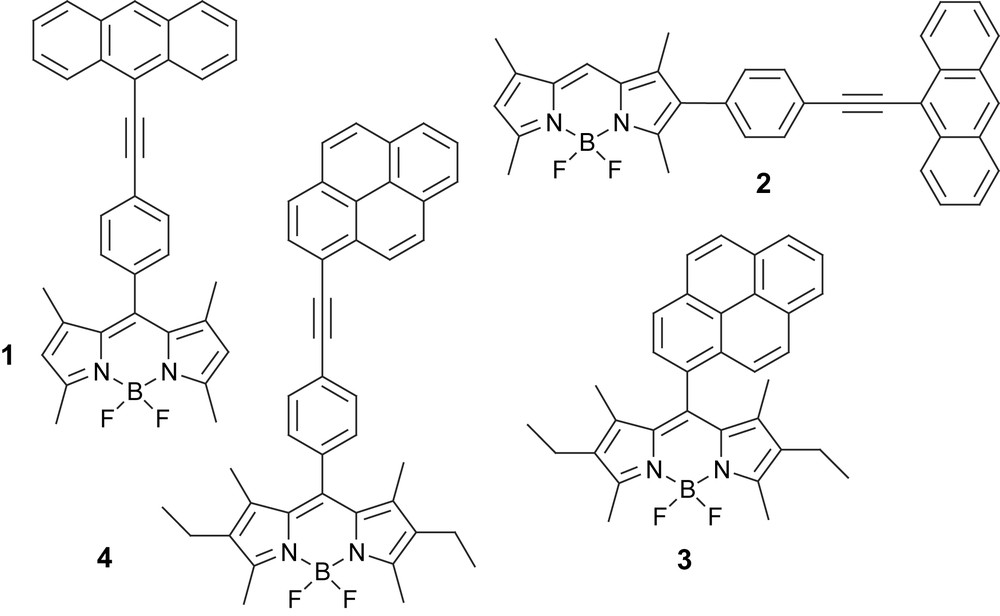
De façon surprenante, la fonctionnalisation de l'atome de bore de la plateforme Bodipy a été complètement négligée jusqu'alors par la communauté des chimistes, laissant la porte ouverte à une méthodologie rationnelle de substitution [15]. Le remplacement des atomes de fluore par des groupes aryle or acétylénique aryle permet d'accéder à une librairie de molécules inconnues jusqu'à leur découverte, faite par le laboratoire de chimie moléculaire de Strasbourg, qui les a récemment identifiées sous l'appellation de C-Bodipy (avec un lien direct entre le carbone de l'aryle et l'atome de bore) et A-Bodipy (A pour acétylène). Pour l'ensemble de ces dyades, un transfert d'énergie en cascade particulièrement rapide (>1010 s−1) a été mis en évidence. Il a été possible de découvrir un ensemble de molécules nouvelles, dans lesquelles le transfert d'énergie est directionnel, rapide et quantitatif. Pour ces molécules, seule la partie Bodipy fluoresce à température ambiante comme à basse température, phénomène qui, en soi, est remarquable et sans précédent rationnel. Le réglage de la vitesse du transfert a été réalisé par optimisation du recouvrement spectral entre le résidu polyaromatique et son partenaire Bodipy. À titre d'exemple, un recouvrement optimal a été obtenu entre l'absorption du second état excité localisé sur le A-Bodipy et le pyrène pour la molécule 8, tandis que, pour la molécule 9, le recouvrement est optimal avec le premier état excité du chromophore A-Bodipy. Un tel ajustement a rarement été obtenu avec des molécules artificielles, et laisse présager un avenir fringant pour des systèmes ajustables à souhait.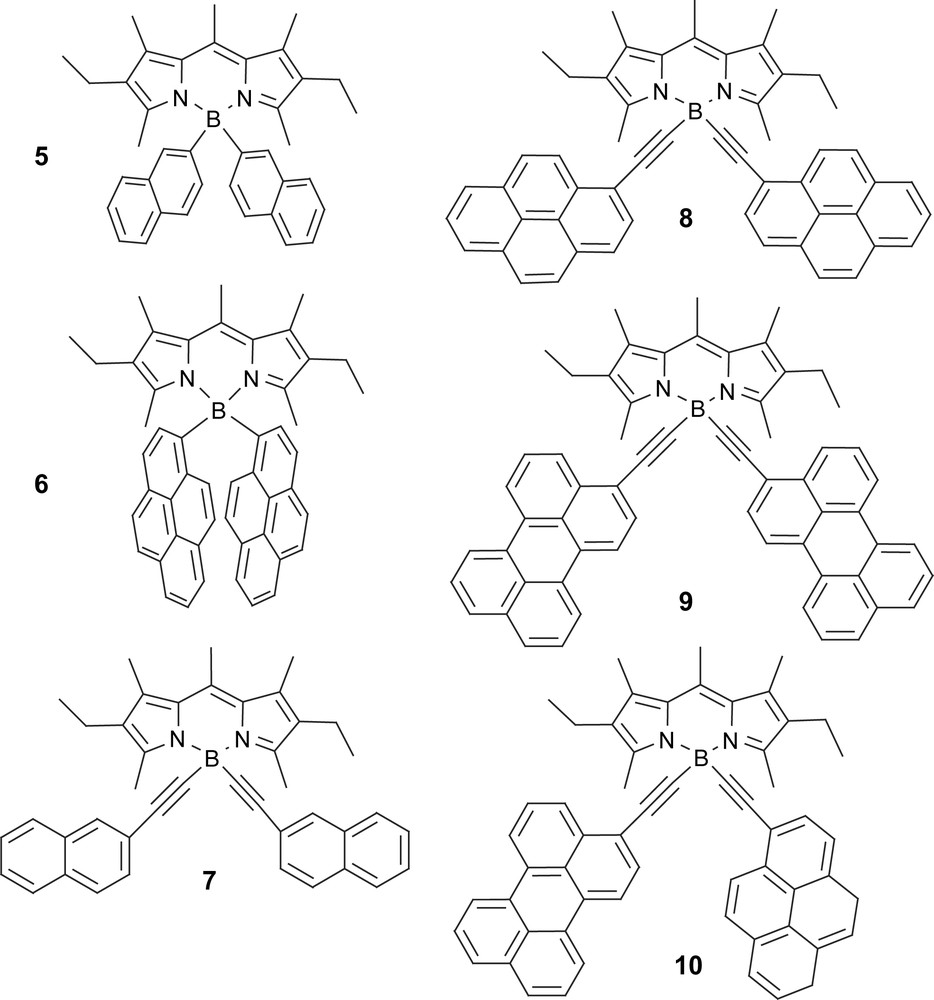
Un comportement particulier a été observé pour le composé 6, pour lequel la désactivation non radiative du premier état singulet est obtenue thermiquement, de manière à ce que le rendement quantique de fluorescence augmente avec l'abaissement de la température. Il n'y a aucune indication du peuplement d'un état intermédiaire à transfert de charge dans lequel les substituant aryles jouent le rôle d'entité donneuse d'électron et le fragment C-Bodipy d'entité accepteuse d'électron. Nous avons rationalisé le comportement photophysique en concluant que les chemins de désactivation non radiatifs étaient liés à la rotation interne du fragment polyaromatique, due à un effet solvatophobe. En effet, nous pensons que, pour l'ensemble des composés C-Bodipy, la conformation des cycles aromatiques varie en fonction de la solvatation, qui est à l'origine d'une variation importante des vitesses de désactivation non radiative [18]. Cet effet non commun n'a jamais été observé auparavant dans cette série de composés moléculaires. Il est à souligner que, dans de nombreux autres dérivés F-Bodipy, des états à transfert de charge ont été mentionné sous irradiation dans des solvants polaires.
Dans un deuxième temps, nous avons réussi à préparer un composé hybride 10 pour lequel les deux sous-unités pyrène et pérylène sont liés de façon covalente à l'atome de bore. Ce composé, présentant des transferts d'énergies multiples en cascade, était un défi synthétique majeur, et a nécessité de faire appel au savoir-faire de chimistes de synthèse expérimentés et à des techniques de séparations analytiques modernes, mais chronophages. Le profil d'absorption du composé 10 appartenant à la famille des A-Bodipy est une addition quasi linéaire des absorptions molaires, démontrant l'absence souhaitée de recouvrement orbitalaire. Toutefois, quelle que soit la longueur d'onde d'excitation de 350 à 500 nm, le fragment Bodipy est le seul à émettre la lumière absorbée à la longueur d'onde unique de 540 nm. Notons que, pour l'ensemble des composés 8 à 10, le transfert d'énergie est extrêmement efficace, malgré la modeste intégrale de recouvrement spectrale entre les différentes portions de la molécule. En effet des vitesses de 4,7 × 1010, 1,7 × 1012, 5,0 × 1010 s−1 ont été mesurées expérimentalement pour les composés 8, 9 et 10, respectivement, et ceci malgré des forces motrices modestes. Aucun état à transfert de charge lié à un transfert d'électron intramoléculaire n'a été mis en évidence sous irradiation, et ce quelle que soit la température de mesure.
Cependant, une problématique intéressante a émergé à propos du composé dissymétrique 10, dans lequel, en fait, plusieurs chemins de désactivation en cascade sont possibles. En effet, l'énergie excitonique du pyrène a au moins deux chemins possibles de relaxation, soit via le pérylène, soit directement via le A-Bodipy. La réponse à cette question reste ouverte et, pour l'instant, les limites de la technologie nous empêchent de répondre à cette question. Des calculs théoriques basés sur des études statistiques laissent à penser que les probabilités de transfert d'énergie pyrène/pérylène/Bodipy et pyrène/Bodipy sont de 50% [19]. Cette incertitude est une source supplémentaire de défis synthétiques, pour lesquels le chimiste doit concevoir des systèmes ciblés, dans lesquels les vitesses de transfert sont moins grandes, tout en maintenant le concept de l'orthogonalité des orbitales frontières. Sur la base de ces pré-requis, de tels objets sont actuellement en cours d'élaboration et sont appelés à éclairer les recherches avancées dans ce domaine passionnant. Notons que, tout récemment, des dérivés à base d'acétylène-fluorène, acétylène-thiophène et acétylène-carbazole ont été caractérisés et montrent tous une émission unique du fragment A-Bodipy [20]. Il est également intéressant de noter, à ce stade, que des concentrateurs très efficaces de photons ont été optimisés, puisque des dispositifs moléculaires adéquats permettent de concentrer la gamme de photons allant de 290 à 500 nm sur un émetteur unique à 540 nm.
Des molécules hybrides à base de F-Bodipy ont été récemment étudiées et comportent des fragments pérylènediimide (PDI) originaux. En effet, dans le composé 11, la fenêtre spectrale d'absorption est très vaste, ouvrant la possibilité de concentrer les photons sur une longueur d'onde unique d'émission à 618 nm, centrée sur l'entité pérylène [21]. Ce travail étonnamment novateur mérite une attention particulière quant à l'étude des vitesses de transfert de l'énergie.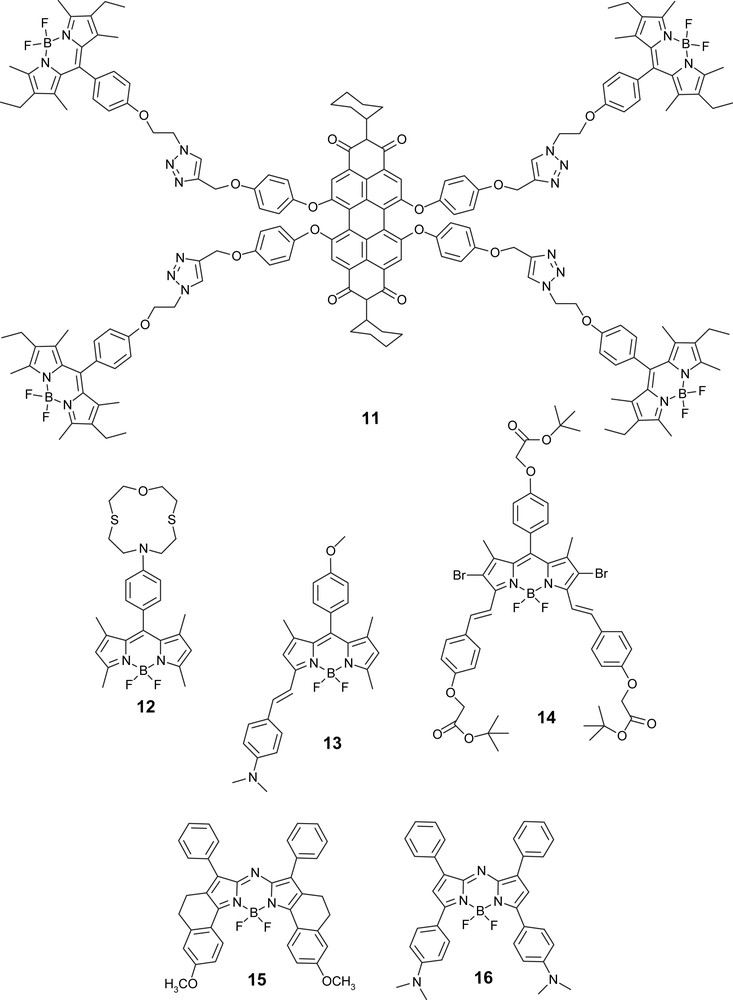
Récemment, des phénomènes de modulation et d'amplification ont été étudiés avec des Bodipy couplés à des fluoro-ionophores. En particulier, les composés 12 et 13 se comportent comme des détecteurs et/ou des interrupteurs fluorométriques, respectivement en présence de sels de métaux de transition et de protons. La présence d'un macrocycle de taille restreinte, comme dans la molécule 12, offre la possibilité de complexer le Fe(III) et d'amplifier de façon significative la fluorescence du singulet émetteur localisé sur le Bodipy [22]. En effet, en raison de la présence d'un état à transfert de charge généré par le récepteur, et en particulier par le fragment anilino substitué (groupe donneur) et le Bodipy (groupe électro-accepteur), la fluorescence du composé 12 est sévèrement éteinte. En revanche, lorsque le doublet de l'atome d'azote est engagé dans la complexation avec un cation spécifique, le transfert photoinduit d'électron est inhibé et la fluorescence se rallume [23]. Des titrages spectrofluorométriques en présence de protons indiquent que la protonation est effective et révèlent un déplacement hypsochrome du signal de fluorescence de l'amine neutre par rapport à la forme protonée. Ces mesures ratiométriques ont permis de déterminer un pseudo pKa de 2,27 ± 0,05 pour le composé 13 [23].
La couleur orange/rouge (λabs ≈ 515 nm, ɛ = 68,000 M−1 cm−1) ou jaune marqué (λabs ≈ 493 nm, ɛ = 79 000 M−1 cm−1) des F-Bodipy construits à partir du kryptopyrrole (2,4-diméthyl-3-éthyl-pyrrole) ou du pyrrole de Knorr (2,4-diméthyl-pyrrole) peut être décalée vers les couleurs bleues ou vertes par des modifications chimiques rationnelles. Ceci peut, en particulier, être mené à bien en remplaçant les groupes méthyles en ortho des atomes d'azote des pyrroles par des groupes vinyle-aryle, comme dans le composé 14 [24], ou par la construction d'aza-dipyromethènes tels que 15 [25] et 16 [26]. Ces synthèses multi-étapes sont linéaires et nécessitent en particulier la préparation relativement délicate d'unités pyrrole polysubstituées. Toutefois, les investigations photophysiques révèlent que le colorant 14 absorbe à 646 nm et fluoresce à 668 nm, avec 44% d'efficacité [24]. De manière similaire, le composé de couleur verte 15 émet de la lumière à 751 nm, avec 28% de rendement quantique, tandis que le composé 16 fluoresce dans le proche infrarouge à 823 nm [24,26]. Le façonnage du cœur dipyrrométhène central en bis-indolométhène offre de nombreuses variations moléculaires et spectrales, et ouvre de réelles perspectives pour la construction d'une nouvelle génération de molécules fluorescentes à caractères spécifiques, permettant de promouvoir des propriétés d'absorption et d'émission ciblées, une stabilité importante dans des conditions physiologiques et une grande aptitude à pouvoir être modulées en fonction du cahier des charges imposé par l'analyse biomédicale envisagée. En particulier, les acteurs du laboratoire ont réalisé la synthèse de molécules à base de bis-indolométhène substitué en position ortho des atomes d'azotes par des résidus anisole et éthylthiophène. Ces groupes, riches en électrons, sont propices à l'extension de la délocalisation orbitalaire et permettent de déplacer les maxima d'absorption à 653 et 727 nm, respectivement, pour les colorants 17 et 18. En bon accord avec la loi d’énergie de seuil, les rendements quantiques de luminescence diminuent à 49 et 20% respectivement pour 17 et 18, en raison principalement d'une augmentation marquée des vitesses de désactivation non radiative des états excités liés à un couplage fort avec l’état fondamental. La chimie innovante développée au laboratoire sur l'atome de bore tétraédrique a été transposée dans cette série de composés et permet également de construire des cascatelles (petites cascades) performantes, dans lesquelles un transfert d'énergie intramoléculaire favorable des sous-unités polyaromatiques vers le A-Bodipy permet d'obtenir des déplacements de Stokes supérieurs à 13 000 cm−1 [27].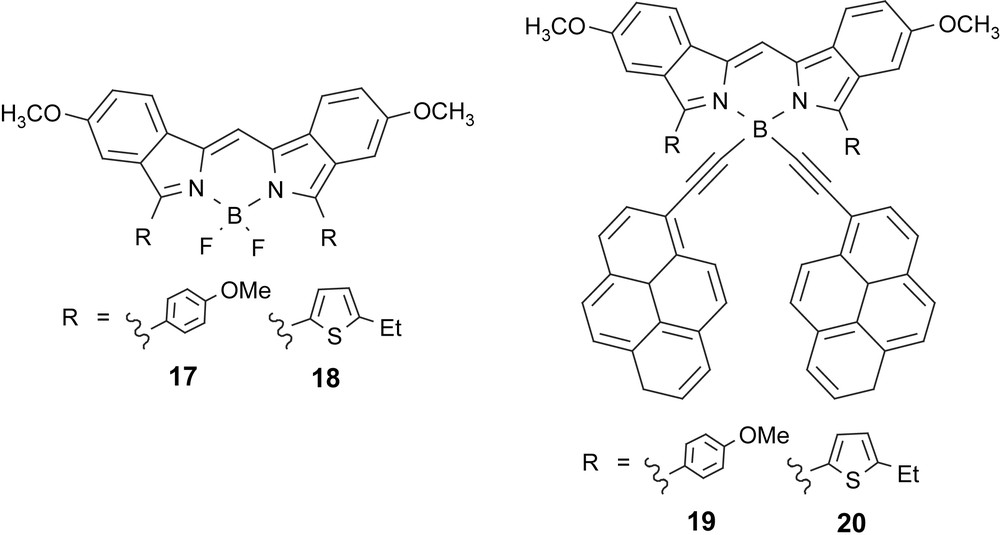
De plus, la substitution sur l'atome de bore permet de faire varier les propriétés électrochimiques de façon sensible. En particulier, le remplacement des atomes de fluor par des atomes aryles ou acétylènes-aryle translate les potentiels d'oxydation et de réduction du cœur bis-indolométhène dans le sens cathodique, et ceci malgré l'absence d'orbitales vacantes sur l'atome de bore. De telles perturbations des niveaux HOMO et LUMO sont particulièrement recherchées dans la mise au point rationnelle de dispositifs électroluminescents visant à ajuster les potentiels aux fonctions de travail des électrodes de contact utilisées. Ce riche potentiel est actuellement utilisé et valorisé par de grands groupes industriels leaders dans les domaines de l'éclairage, de l'électroluminescence, des diodes et transistors à émission de lumière [28].
La modularité importante, la singularité de ces objets et la maîtrise des protocoles synthétiques nous ont permis de modifier l'architecture de ces Bodipy pour former des assemblées supramoléculaires, comme les cristaux liquides et les organogélateurs [29]. À ce jour, nous avons réussi à produire des réseaux de fibres entrelacées qui emprisonnent et gélifient les solvants, organiques en particulier. Une telle découverte a été possible grâce à l'ajout de chaînes paraffiniques sur des plates-formes préorganisées, comportant des fonctions amides secondaires [30]. Dans la molécule 21, les positions et la nature des substituants ont été choisies selon notre souhait de produire un réseau infini de liaisons hydrogène capables de se développer dans plusieurs dimensions et d'augmenter la stabilité des réseaux. Le groupe méthyle central dans la molécule 21 favorise l'orientation des dipôles amide dans des directions opposées, facilitant ainsi les interactions intermoléculaires multiples.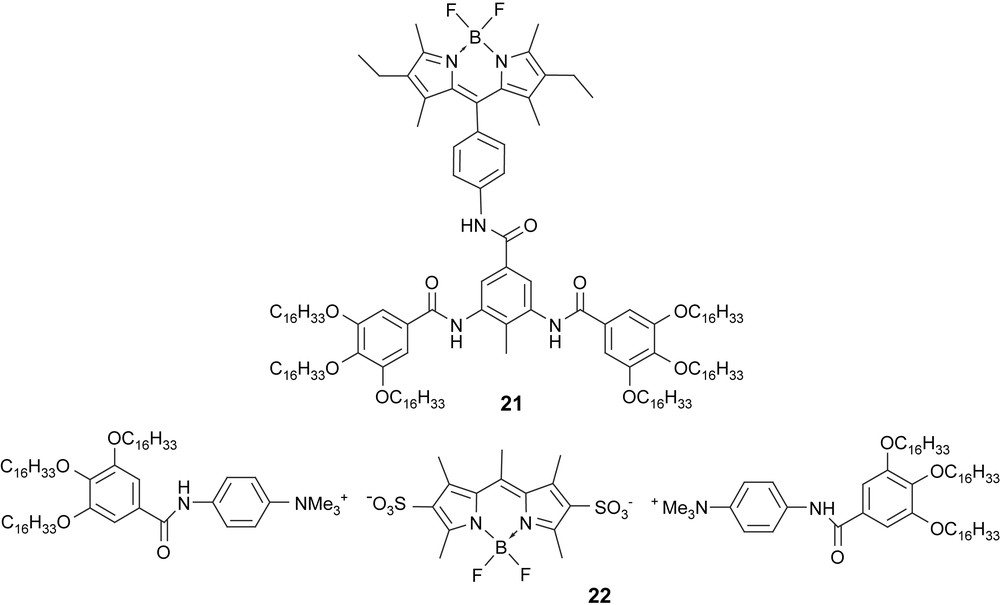
Finalement, l'utilisation de processus d'auto-organisation ionique comme présenté dans l'adduit 22 permet de générer facilement des cristaux liquides luminescents et de former des films biréfringents stables sur une vaste gamme de températures [31]. La flexibilité des synthèses et le caractère non directionnel des dipôles électrostatiques permettent d'obtenir des textures mésomorphes fluorescentes observables par lumière polarisée sans l'aide de polariseurs croisés [31].
En guise de résumé, on peut dire que l'évolution des structures à base de Bodipy a permis d'obtenir de nouvelles structures délocalisées et stables, dans lesquelles les propriétés structurales, optiques et électrochimiques ont grandement pu être modulées. Les applications de ces nouveaux systèmes, qui résultent d'une méthodologie propre aux chimistes organiciens des laboratoires pluridisciplinaires, sont aussi nombreuses que variées et ont une portée considérable et en partie encore insoupçonnée. Toutefois, l'attrait suscité par la communauté a permis de préparer et de caractériser de nouvelles molécules avec méthodologie et audace, et à conduit les photophysiciens à manipuler les états émissifs et les processus de transfert de l'information. Par ailleurs, les biochimistes ont été amenés à marquer des protéines, des anticorps monoclonaux, des séquences de gènes, les supramolécularistes ont dû produire, parfois de façon spontanée ou en forçant la cinétique, des gels, des couches minces organisées, des phases mésomorphes et des dispositifs. Les pré-requis et les quelques exemples décrits dans cette mise au point laissent envisager un développement à venir rapide, ciblé et professionnel de ces substances. La nouvelle classe de composé C-Bodipy et A-Bodipy ouvre un champ d'exploration immense à la frontière de la chimie et de la physique, en particulier de l'optique et de la matière molle. À n'en pas douter, les choix rationnels mais chronophages fait par les chimistes laissent entrevoir de belles applications, dans un avenir proche, dans l'imagerie multicouleur et les dispositifs de conversion d'énergie.
Remerciements
Je tiens à remercier mes collaborateurs, en particulier le Dr Gilles Ulrich, ainsi que les étudiants et toutes les personnes ayant participé, de près ou de loin, à la réalisation des ces travaux, car ils sont à l'origine d'une avancée considérable dans le passionnant domaine des sondes fluorescentes. Le CNRS, l'ULP, l'ECPM et le ministère de la Recherche et de l'Enseignement supérieur sont remerciés pour leurs apports financiers respectifs. Ce travail a été réalisé dans le cadre d'un contrat européen IFET-ILO (contrat 2001-33057). Les contributions allemande, suisse, italienne et belge ont été particulièrement appréciées par l'ensemble des acteurs de ce travail. Enfin, je tiens à remercier sincèrement Martine Ziessel pour la mise en forme littéraire de ce manuscrit.


