1 Introduction
Les réactions de Friedel et Crafts sont également la base de la chimie organique classique et permettent de créer des liaisons C–C [1]. Ces réactions sont habituellement utilisées en catalyse homogène, en utilisant des acides de Lewis dans la phase liquide tels que : FeCl3, ou des chlorures de métaux de transition ou de terres rares, en quantité au moins stœchiométrique [2].
L'application de ces catalyseurs en catalyse homogène pose quelques problèmes, entre autres, ils sont : irrécupérables parce qu'ils forment assez souvent des complexes avec les réactifs d'alkylation ou avec les produits. Pour pallier à ces difficultés, il est donc plus avantageux d'utiliser ces réactions en catalyse hétérogène, en utilisant des acides solides qui ne forment pas de complexes stables avec les produits, ce qui permet en fin de réaction de pouvoir régénérer et réutiliser facilement ces catalyseurs. De plus, cela permettrait de réduire la corrosion des installations. Le remplacement des acides liquides par des matériaux acides solides permettrait aussi de diminuer les rejets polluants [3,4].
Par ailleurs, les composés polyaromatiques obtenus (benzyltoluènes, benzylbenzène…) sont utilisés comme des polymères spéciaux dans le domaine de la chimie macromoléculaire ainsi comme des fluides diélectriques après élimination du catalyseur et distillation d'un ou de l'ensemble des produits de condensation suivie de conditionnement.
En 1992, une nouvelle famille de tamis moléculaires mésoporeux, désignée M41S a été découverte par la société Mobil Oil [5,6]. Le solide appelé MCM-41 (Mobil Composition of Matter n°41) est le plus connu. Ce composé possède une grande surface spécifique, une bonne stabilité thermique et une porosité relativement bien contrôlée avec des pores de 1.8 à 10 nm de diamètre [5–7]. Quatre méthodes principales de synthèse ont été développées. Elles sont basées sur des interactions électrostatiques entre les phases organique et inorganique [8,9]. En 1994, Tanev et Coll. [10,11] ont proposé la synthèse de silices mésostructurées à température ambiante à l'aide d'un tensioactif neutre (S0 I0). Dans ce cas, le structurant n'est pas un ammonium quaternaire mais une amine primaire et l'assemblage se fait par liaisons hydrogènes entre les amines primaires et le précurseur inorganique neutre.
Ces matériaux, dénommés HMS (pour Hexagonal Mesoporous Silica) possèdent un réseau de canaux bien moins structuré que celui des MCM-41. Les murs sont généralement plus épais [11] que pour une MCM-41, ce qui leur confère une meilleure stabilité thermique et hydrothermale. Un autre avantage de ces matériaux par rapport aux MCM-41 est que la phase organique peut être totalement éliminée par extraction dans l'éthanol, ce qui n'est pas le cas dans les MCM-41 préparées en milieu basique, où les interactions électrostatiques entre la phase organique et inorganique sont très fortes.
Dans ce papier, nous rapportons la synthèse, la caractérisation de matériaux silicates dopés par le zinc et leurs applications dans la réaction d'alkylation du toluène. La cinétique de cette réaction a été étudiée et la réaction a été prolongée à d'autres substrats comme : le benzène, le p-xylène, le chlorobenzène et l'anisole.
2 Partie expérimentale
2.1 Produits
Les produits utilisés dans la synthèse sont : Hexadécylamine (HDA, Aldrich), orthosilicate (TEOS, Aldrich), Zinc - nitrate (Zn (NO3)2·4H2O, Merck) et éthanol (Rhône - Poulenc).
2.2 Préparatioan des catalyseurs
Les catalyseurs type Zn-HMS-n avec n = Si/Zn = 60, 30, 15, ont été préparés suivant la méthode rapportée par Tanev et Pinnavaia [10,11]. Cette méthode consiste à mélanger une solution contenant : l'hexadécylamine (HDA) ; l'eau H2O ; l'éthanol EtOH, à une solution de : tétraéthyl orthosilicate (TEOS) ; d'éthanol EtOH ; de nitrate de zinc (Zn (NO3)2·4H2O).
Le milieu réactionnel est ensuite agité à température ambiante pendant 24 h. Le solide obtenu est ensuite mélangé avec l'éthanol (5 g de solide/100 ml EtOH) contenant une petite quantité de NH4Cl (1 g/100 ml EtOH) pendant 2 h à 353 K. En effet, la présence des cations NH4+ dans l'éthanol est nécessaire dans les échanges des protons d'amines formés durant la synthèse et balance l'excès des charges négatives qui résultent à partir de la substitution des Si IV par les espèces de ZnII [7,12]. Le solide est récupéré par filtration et lavé 3 à 4 fois avec l'éthanol. Le solide obtenu est séché à l'étuve à 393 K pendant une nuit. Après, séchage, celui-ci est broyé et calciné sous courant d'air (2l.h−1) à 823 K pendant 6 h avec une montée en température de 1° min−1.
2.3 Procédures et techniques d'analyse
La réaction d'alkylation du toluène par le chlorure de benzyle est réalisée, à la pression atmosphérique, dans un réacteur fermé. Nous chauffons le mélange réactionnel jusqu'à la température de réaction, et nous introduisons le catalyseur dans le réacteur et nous notons le temps de départ t°. Ensuite, et à chaque 30 min nous prélevons 0.5 μl de la solution par une seringue et nous injectons dans le chromatographe. La masse catalytique déposée est égale à 100 mg. L'activation du catalyseur consiste en une calcination sous air avec un débit de 2 l.h−1 à la pression atmosphérique pendant 3 h. La température de calcination étant de 573 K. Elle est atteinte après 50 min de chauffage. L'analyse des réactifs et des produits est réalisée par chromatographie en phase gazeuse dans un appareil Shimadzu GC-14B, équipé d'un détecteur d'ionisation de flamme (FID). La colonne utilisée est une colonne capillaire RTX-1, non polaire de faible sélectivité. L'analyse élémentaire, par absorption atomique, des catalyseurs permet de déterminer les teneurs réelles de leurs différents constituants. Les mesures ont été effectuées sur un spectromètre de flamme Spectro- Analytical Instruments ICP- D. Les aires spécifiques ont été déterminées par la technique BET en adsorption et désorption d'azote. Les mesures ont été effectuées à 77 K sur 100 mg d'échantillon préalablement dégazé à 573 K sous vide. L'appareillage automatisé est de type ASAP2010 de Micromeritics. Les diffractogrammes de rayons-X des catalyseurs sont collectés en utilisant le goniomètre de poudre automatique vertical Bruker D5005 avec la radiation CuKα (λ = 1,54184 Å, 50 kV, 35 mA). Le mode d'acquisition est réalisé par balayage continu (pas de 0,02°(2θ)), durée d'acquisition 10s par pas, fente de divergence et d'antidiffusion 0,2° pour le domaine 1–10°(2θ) et 0,02°(2θ), durée d'acquisition 1s par pas, fente de divergence et d'antidiffusion 1° pour le domaine 3–80°(2θ).
3 Résultats et discussion
3.1 Caractérisations
Les résultats d'analyse chimique des catalyseurs après calcination sont rassemblés dans le Tableau 1. A partir de ces résultats, nous constatons que les teneurs réelles en éléments, sont proches de celles que nous avons fixées avant la préparation excepté, le solide Zn-HMS-60. Ce qui prouve que pratiquement tout le zinc introduit dans le gel de préparation se trouve dans les catalyseurs. Par ailleurs, nous constatons que tous les solides présentent des grandes surfaces spécifiques. L'augmentation du taux de zinc dans le matériau entraîne une diminution de la surface spécifique. En effet, une silice mésoporeuse possède une surface spécifique de plus de 1170 m2/g alors que celle de Zn-HMS-60 est environ 1143 m2/g et celle de Zn-HMS-15 est de 965.7 m2/g. Les diffractogrammes de rayons X de tous les solides Zn-HMS-n dans le domaine des petits angles de diffraction (1–10° (2θ)) montrent que nos solides HMS ne sont pas bien structurés par rapport aux MCM-41. Ils montrent un seul pic de réflexion correspondant à la première raie (100) à (2θ) = 2.1 (Fig. 1). Par contre, nous n'arrivons pas à observer facilement les deux autres raies (110) et (200) habituellement observées dans le cas des MCM-41. En outre, nous ne constatons pas l'apparition des petits pics dans le domaine des grands angles de diffraction (10–80°(2θ)) (Fig. 2).
Résultats d'analyse chimique des catalyseurs après calcination.
| Catalyseurs | Rapport Si/Zn | % en poids de Zinc | Surface BET (m2/g) | ||
| Théorique | Mesuré | Théorique | Mesuré | ||
| HMS | – | – | – | – | 1170 |
| Zn-HMS-60 | 60 | 80,0 | 1,0 | 0,78 | 1143 |
| Zn-HMS-30 | 30 | 29,6 | 3,5 | 3,51 | 1035 |
| Zn-HMS-15 | 15 | 14,5 | 6,5 | 6,24 | 965,7 |

Diffractogrammes DRX des catalyseurs Zn-HMS-n dans le domaine 1–10°(2θ). n = Si/Zn = (a) 60, (b) 30, (c)15.

Diffractogrammes DRX des catalyseurs Zn-HMS-n dans le domaine 10–80°(2θ). n = Si/Zn = (a) 60, (b) 30, (c) 15.
3.2 Activité catalytique
3.2.1 Etude cinétique et mécanistique
Dans notre cas, les données cinétiques pour la réaction d'alkylation du toluène par le chlorure de benzyle avec : un rapport molaire Tol/BzCl = 15 et sur le catalyseur Zn-HMS-30 à Tr = 343, 348, 353 K, pourrait bien être parfaitement ajustées par une loi de vitesse de pseudo - premier ordre : ln[ClBz] = &minuskat + ln[ClBz]0. Les graphiques de ln[ClBZ] en fonction du temps de la réaction donnent une ligne droite sur une très grande gamme de conversions du chlorure de benzyle avec une pente de −ka (Fig. 3). La droite d'Arrhenius de ln ka en fonction de 1/T pour la réaction d'alkylation du toluène par le chlorure de benzyle sur le catalyseur Zn-HMS-30 donne une valeur de l'énergie apparente d'activation Ea égale à 94,8 KJ mol−1. Cette valeur est inférieure aux valeurs enregistrées pour les catalyseurs In2O3/H-ZSM-5 [13] et Ga2O3/Hβ [14]. Par ailleurs, nous avons étudié la réaction d'alkylation du toluène par le chlorure de benzyle à Tr = 348 K en présence de 0,1 g du catalyseur Zn-HMS-30 avec deux rapports molaires Tol/ClBz différents = 5 et 15. Les résultats de cette étude sont rassemblés dans le Tableau 2. Il ressort de ces résultats expérimentaux, que la valeur du rapport molaire affecte sensiblement les performances catalytiques. En effet, quand le rapport molaire entre le toluène et le chlorure de benzyle augmente, la sélectivité en benzyltoluène (Btol) augmente. Ceci veut dire qu'un faible rapport molaire entre le toluène et le chlorure de benzyle favorise la production des produits secondaires tels que le dibenzyltoluène (dBTol) et le tribenzyltoluène (tBTol). Ces résultats sont en accord avec ceux obtenus sur des zéolithes de type H-ZSM-5, H-Beta et HY [15]. Un rapport molaire Tol/ClBz = 15 sera utilisé par la suite dans l'étude de l'influence des autres paramètres. En outre, nous avons étudié l'influence des substituants sur la réactivité en utilisant les différents substrats aromatiques illustrés dans le Tableau 3 suivant le Schéma 1.
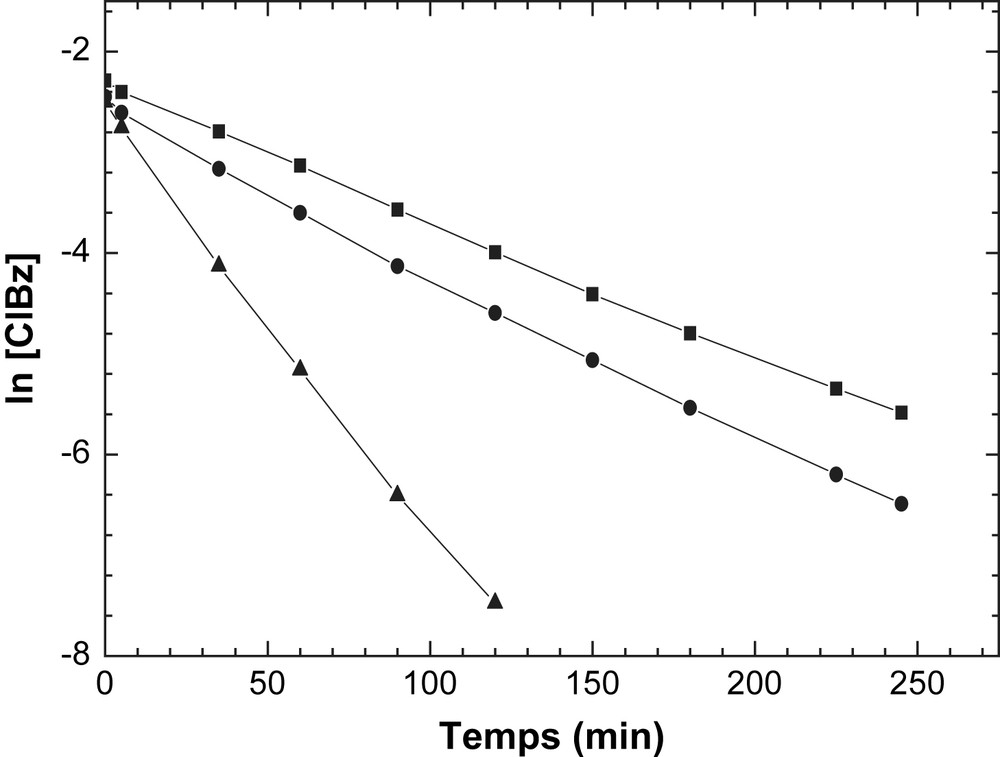
Courbes du pseudo - premier ordre pour le solide Zn-HMS-30 à différentes températures de réaction Tréa = (■) 343, (●) 348 et (▸) 353 K.
Influence du rapport molaire Tol/ClBz sur les propriétés catalytiques du solide Zn-HMS-30 à une température de réaction de 348 K.
| Rapport molaire Tol/ClBz | Temps de réactiona (min) | Sél. en benzyltoluène (Btol) (%) |
| 5 | 437,5 | 68,9 |
| 15 | 306,2 | 100 |
a Temps de réaction à la conversion totale du chlorure de benzyle.
Effet des substrats sur la vitesse de réaction en présence du solide Zn-HMS-30 à une température de réaction Tréa. = 353 K et avec un rapport Substrats/ClBz = 15.
| Substrats | R | Const. Apparente de vitesse Ka (×104 min−1) |
| Benzène | H | 265,4 |
| Toluène | CH3 | 242,5 |
| p-Xylène | 2CH3 | 229,1 |
| Chlorobenzène | Cl | 198,8 |
| Anisole | OCH3 | 185,0 |

Influence des substituants sur la réactivité en utilisant les différents substrats aromatiques. Dans lequel n1 et n2 valent 0, 1 ou 2, n1 + n2 est inférieur ou égal à 3 et R = H, CH3, 2CH3, 3CH3, OCH3, Cl.
A partir des résultats expérimentaux présentés dans ce Tableau, nous constatons que la constante de vitesse apparente du pseudo-premier ordre suit l'ordre suivant : Benzène > Toluène > p-Xylène > Chlorobenzène > Anisole. Cet ordre de réactivité indique que le mécanisme réactionnel dans ce cas est différent de celui d'un mécanisme acide classique habituellement observé dans les réactions de Friedel–Crafts : Anisole > p-Xylène > Toluène > Benzène. Par ailleurs, aucune corrélation du type Hammett n'est observée (Fig. 4). Ce résultat confirme que le mécanisme réactionnel est peu sensible aux effets électroniques.
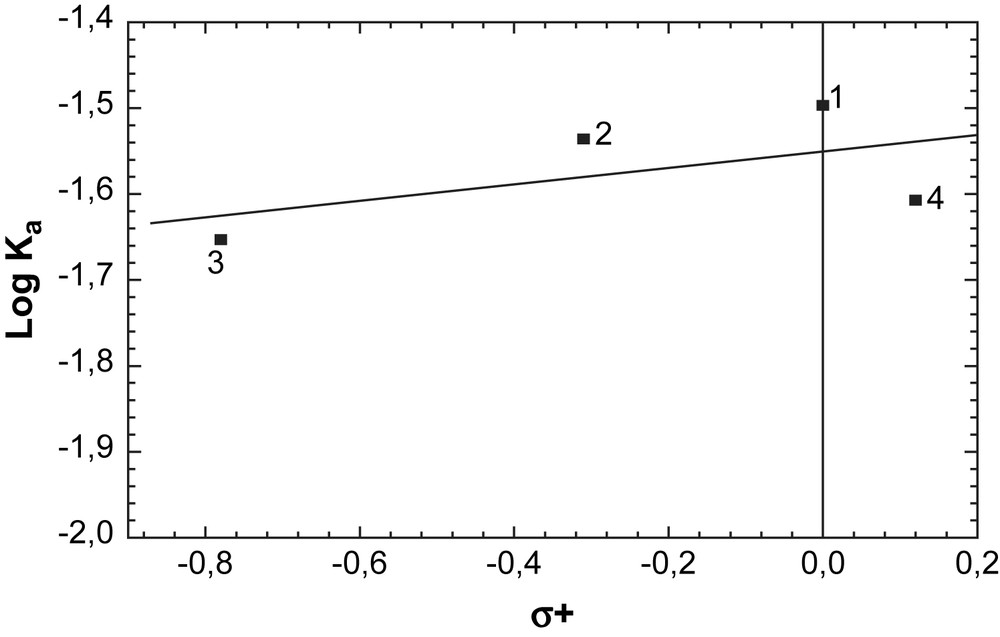
Graphique de Hammett pour l'alkylation du toluène par le chlorure de benzyle sur le solide Zn-HMS-30 comme catalyseur. : 1 : Benzène ; 2 : Toluène ; 3 : Anisole ; 4 : Chlorobenzène.
D'autre part et dans le but d'étudier l'influence de l'effet stérique sur la vitesse de réaction, nous avons appliqué la relation de Taft qui consiste à tracer les constantes apparentes de vitesse Ka en fonction des paramètres Es qui représentent la taille des groupements substituants des composés aromatiques étudiés (Fig. 5). A partir de cette figure, nous constatons aussi qu'aucune corrélation linéaire n'est observée. Ce résultat prouve clairement que la vitesse de réaction est indépendante de la taille des groupements substituants des composés aromatiques étudiés, ce qui exclut la possibilité d'une éventuelle influence des effets stériques sur la réactivité. A partir de tous ces résultats précédents, nous avons envisagé un mécanisme RedOx qui consiste :
- - En une rupture homolytique de la liaison carbone- chlore.
- - A oxyder le radical (ϕ–CH2 à ϕ–CH2+) et réduire le Zinc, qui passe de la valence Zn+2 à Zn+.
- - A réoxyder le Zinc, qui repasse à sa valence initiale Zn+2.

Graphique de Taft pour l'alkylation du toluène par le chlorure de benzyle sur le solide Zn-HMS-30 comme catalyseur : 1 : Benzène ; 2 : Toluène ; 3 : Anisole ; 4 : Chlorobenzène.
Cette étape peut être considérée comme l'étape déterminante de la vitesse de réaction (l'étape lente) et elle sera suivie par la formation d'un complexe intermédiaire σ dans lequel le carbone du site de substitution est lié à la fois à l'électrophile et au groupe partant, ce qui entraîne qu'une liaison σ soit formée sur ce site. Un mécanisme semblable a été proposé pour les propriétés catalytiques des argiles échangées ainsi que pour le solide TlOx/zirconia, testées dans la réaction de benzylation par le chlorure de benzyle [14,15]. Le mécanisme proposé est :
- 1. Étape lente : Activation du chlorure de benzyle
| ϕ–CH2Cl → ϕ–CH2 + Cl, |
| ϕ–CH2 + Zn2+ → ϕ–CH2+ + Zn+, |
| Zn+ + Cl → Zn2+ + Cl−. |
- 2. Étape rapide : La formation d'un complexe intermédiaire σ :
| R–Ar–H + ϕ–CH2+ → ϕ–CH2–ArR–H+ |
| ϕ-CH2–ArR–H+ → ϕ–CH2–ArR + H+ |
| H+ + Cl− → HCl. |
3.2.2 Étude de l'influence de la teneur en Zinc des catalyseurs
Dans cette partie, nous avons entrepris de montrer l'influence de la teneur en zinc sur le processus réactionnel à une température de 353 K, avec un rapport molaire Toluène/chlorure de benzyle de 15 (Tableau 4). Il apparaît que le composé purement silicate (HMS) ainsi que le solide contenant une faible quantité de zinc (Zn-HMS-60) sont totalement inactifs dans la réaction d'alkylation du toluène par le chlorure de benzyle par contre l'activité catalytique des autres solides augmente avec la teneur en zinc. Ceci indique, que le zinc dans ces catalyseurs joue un rôle important dans la réaction d'alkylation du toluène. Par ailleurs, nous constatons aussi que ces catalyseurs contrôlent bien la sélectivité ortho/para de cette réaction. En effet, une distribution des isomères similaire a été trouvée pour le catalyseur FeCl3 testé dans la même réaction [2].
Conversion du chlorure de benzyle, Sélectivité en benzyltoluène, Constante apparente de vitesse et distribution des isomères sur les catalyseurs Zn-HMS-n (avec n = Si/Zn = 60, 30, 15) à Tréa = 348 K, Bz/ClBz = 15.
| Catalyseurs | Temps de réactiona (min) | Sél. en benzyltoluène (BTol) (%) | Const. apparente de vitesse Ka (×104 min−1) | Distribution des isomèresb | ||
| o-BTol | m-BTol | p-BTol | ||||
| HMS | – | – | – | – | – | – |
| Zn-HMS-60 | – | – | – | – | – | – |
| Zn-HMS-30 | 306,2 | 100 | 129,1 | 42,2 | 2,5 | 55,3 |
| Zn-HMS-15 | 216,2 | 90,5 | 275,3 | 40,1 | 2,5 | 57,4 |
a Temps de réaction correspondant à la conversion totale du chlorure de benzyle.
b Distribution à l'équilibre thermodynamique.
3.2.3 Effet du recyclage et du vieillissement
Nous avons examiné l'effet du recyclage et du vieillissement sur la stabilité et les propriétés catalytiques du solide Zn-HMS-30. Cette étude a été effectuée à Tréa = 353 K avec un rapport molaire Tol/ClBz = 15 sans régénération entre deux réutilisations. La première utilisation du solide (catalyseur frais) dans la réaction a été réalisée dans les conditions opératoires standard jusqu'à la conversion complète du chlorure de benzyle. Huit minutes après la fin de la première utilisation, une autre quantité de chlorure de benzyle a été introduite dans le mélange réactionnel pour obtenir le même rapport molaire entre le toluène et le chlorure de benzyle que dans la première utilisation. Après la première réutilisation, le même protocole est répété une deuxième fois (deuxième réutilisation).
Les résultats obtenus dans le Tableau 5, montrent que le catalyseur peut être utilisé plusieurs fois dans le processus d'alkylation du toluène par le chlorure de benzyle sans une perte importante de ses propriétés catalytiques. En effet, le temps de réaction à la conversion totale du chlorure de benzyle ainsi que la constante apparente de la vitesse valent respectivement 510 min et 264,5 × 10−4 min−1 pour la première utilisation, 525 min et 257 × 10−4 min−1 pour la première réutilisation et pour la deuxième réutilisation 532 min et 259,5 × 10−4 min−1.
Effet du recyclage sur les propriétés catalytiques du solide Zn-HMS-30 à Tréa = 353 K, Tol/ClBz = 15.
| Catalyseurs | Temps de réactiona (min) | Sél. en benzyltoluène (BTol) (%) | Const. apparente de vitesse Ka (×104 min−1) |
| Frais | 510 | 78,8 | 264,5 |
| Première réutilisation | 525 | 80,9 | 257,0 |
| Deuxième réutilisation | 532 | 79,3 | 259,5 |
a Temps de réaction à la conversion totale du chlorure de benzyle.
4 Conclusions
En conclusion, les catalyseurs à base de zinc sont actifs dans la réaction d'alkylation du toluène par le chlorure de benzyle. Par contre, le solide contenant une faible quantité de zinc (Zn-HMS-60) ainsi que le composé purement silicate HMS sont totalement inactifs dans cette réaction. Par ailleurs, nous avons constaté que le mécanisme réactionnel est différent de celui d'un mécanisme acide classique habituellement observé dans les réactions de Friedel-Crafts, ce qui suggère probablement l'intervention d'un mécanisme Redox. Ce type de mécanisme montre une très grande indépendance aux effets électroniques des substituants ainsi qu'aux effets stériques, et par conséquent, ces catalyseurs peuvent être utilisés avec des substrats qui montrent de faibles réactivités. Ces catalyseurs peuvent être utilisés plusieurs fois dans le processus d'alkylation du toluène par le chlorure de benzyle sans perte importante de leurs propriétés catalytiques.


