1 Introduction
Les apatites constituent une large famille de composés de formule générale Me10(XO4)Y2 où Me représente un cation divalent (Ca2+, Sr2+, Ba2+, etc.), XO4 un anion trivalent (PO43−, VO43−, etc.) et Y un anion monovalent (Cl−, F−, OH−, etc.). Elles cristallisent généralement dans le système hexagonal (groupe d’espace P63/m) [1,2]. Dans cette structure, les groupements XO4, agencés en un empilement quasi compact forment deux types de tunnels parallèles à l’axe c dans lesquels sont localisés les cations Me2+. Les tunnels de premier type, de plus petite taille, sont occupés par quatre Me2+ (sites 4f, Me(1)). Ces cations sont entourés par neuf atomes d’oxygène. Les tunnels de deuxième type sont bordés par des atomes d’oxygène et les six Me2+ restants (sites 6h, Me(2)). Ces cations se trouvant aux sommets de deux triangles équilatéraux alternés à la cote 1/4 et 3/4 sont entourés par six atomes d’oxygène et un atome Y [3]. Cette structure permet de nombreuses substitutions aussi bien anioniques que cationiques conduisant à la formation de solutions solides totales ou partielles. Des substitutions couplées sont aussi possibles.
Ainsi, les britholites de formule chimique Me10−xLnx(PO4)6−x(SiO4)xY2 sont des dérivés apatitiques phosphosilicatés obtenus par substitution couplée du cation divalent par une terre rare trivalente (Ln) et des groupements XO4 (PO43−) par les groupements silicate (SiO44−). Des britholites naturelles renfermant depuis des centaines de millions d’années des actinides, lanthanides et des produits de fission ont été découvertes dans le réacteur nucléaire naturel d’Oklo au Gabon [4] et sur le site du Hoggar en Algérie [5]. Ainsi, ces matériaux ont résisté pendant des millions d’années à l’altération aqueuse et thermique, les fortes irradiations subies ont provoqué une élévation de leur température de centaines de degrés Celsius [6]. De plus, il a été constaté que ces apatites sont capables de guérir les dégâts induits par les irradiations [5].
Ces observations ont donné à penser que ces matériaux peuvent être envisagés comme matrice pour le confinement des déchets radioactifs tels que le césium et les actinides mineurs. C’est pourquoi, de nombreux travaux se sont intéressés à l’étude de leurs propriétés physico–chimiques, thermodynamiques [7–11] ainsi qu’à leur dissolution [12–14]. Les résultats obtenus ont montré que ce sont les britholites monosilicatées qui sont les plus stables et par conséquent susceptibles de constituer une matrice pour le confinement des radionucléides [15–19]. Par ailleurs, des études qui se sont attachées à l’incorporation du césium dans des britholites calciques ou strontiques ont montré qu’uniquement la composition monosilicatée (Me7La2Cs(PO4)5(SiO4)F2, avec Me = Ca ou Sr) a été obtenue à l’état pur [20,21]. La connaissance de la répartition du césium entre les deux sites cationiques peut contribuer à une meilleure compréhension de la fixation de cet élément par les britholites.
Dans ce travail, nous avons procédé à l’affinement structural de la composition Sr7La2Cs(PO4)5(SiO4)F2 par la méthode de Rietveld. Cette composition a été aussi caractérisée par résonance magnétique nucléaire.
2 Protocole expérimental
2.1 Préparation de la poudre
La composition Sr7La2Cs(PO4)5(SiO4)F2 a été préparée par réaction à l’état solide en deux étapes à partir de carbonate de strontium [SrCO3], d’oxyde de lanthane [La2O3], de silice [SiO2], de fluorure de strontium [SrF2], de carbonate de césium [Cs2CO3], de fluorure d’ammonium [NH4F] et de diphosphate de strontium [Sr2P2O7].
2.2 Préparation du diphosphate de strontium
Il a été préparé selon l’équation chimique suivante :
| 2SrCO3 + 2(NH4)2HPO4 → Sr2P2O7 + 4NH3 (↑) + 2CO2 (↑) + 3H2O (↑) | (1) |
Après avoir été broyés et mélangés dans un mortier d’agate, les réactifs de départ ont été mis en forme par pressage uniaxial à froid puis traités à 900 °C pendant dix heures.
2.2.1 Préparation de la composition intermédiaire
Avant de procéder à l’incorporation du césium, nous avons préparé une composition intermédiaire de formule Sr7La2(PO4)5(SiO4)F selon l’équation chimique :
| 1/2SrF2 + 3/2SrCO3 + 5/2Sr2P2O7 + La2O3 + SiO2 → Sr7La2(PO4)5(SiO4)F + 3/2CO2 (↑) | (2) |
Les réactifs broyés et homogénéisés manuellement dans un mortier d’agate ont été mis en forme par pressage uniaxial sous forme de pastille de 30 mm de diamètre et de 4 mm d’épaisseur. Après un premier traitement thermique à 900 °C pendant 12 heures sous atmosphère dynamique d’argon, la pastille a été broyée et homogénéisée puis traitée de nouveau à 1400 °C durant 12 heures.
2.2.2 Incorporation du césium
La composition intermédiaire obtenue a été mélangée avec du carbonate de césium (Cs2CO3) et du fluorure d’ammonium (NH4F), puis broyée et compactée selon le même protocole opératoire que précédemment. Après avoir subi un premier traitement à 800 °C pendant deux heures, l’échantillon sous forme de pastille a été de nouveau broyé, homogénéisé et mis en forme. Afin de limiter la volatilisation du césium [21], la pastille a été placée dans une nacelle munie de couvercle, enrobée par une poudre de même nature mais enrichie en carbonate de césium (20 % en masse), pour créer une atmosphère autostabilisante, puis calcinée à 1100 °C pendant quatre heures. L’équation de réaction est la suivante :
| Sr7La2(PO4)5(SiO4)F + 1/2Cs2CO3 + NH4F → Sr7La2Cs(PO4)5(SiO4)F2 + NH3 (↑) + 1/2H2O (↑) + 1/2CO2 (↑) | (3) |
2.3 Caractérisation de la poudre
Le diagramme de DRX a été obtenu au moyen d’un diffractomètre à poudre PHLIPS PW 1800. La radiation utilisée de longueur d’onde λ = 1,54056 Å (Kα) est produite par une anticathode de cuivre. L’intervalle exploré en 2θ varie entre 10°et 90° avec un pas de 0,02° et un temps de comptage égal à 12 secondes.
Les spectres RMN-MAS du solide de 31P et 29Si ont été acquis à l’aide d’un spectromètre de type BRUKER MSL 300 aux fréquences respectives de 121,5 et 59,6 MHz. Les références utilisées sont l’acide phosphorique (85 %) pour 31P et le tétraméthylsiliane pour 29Si.
3 Résultats et discussion
L’analyse chimique de la composition étudiée a été réalisée par spectroscopie à fluorescence X. Les résultats obtenus sont consignés dans le Tableau 1 [21].
Résultat des analyses chimiques de la composition Sr7La2Cs(PO4)5(SiO4)F2.
| Sr2+ | Cs+ | La3+ | PO43− | SiO44− | F− |
| 7,10(0,20) | 0,97(0,10) | 1,80(0,10) | 5,10(0,15) | 0,90(0,10) | 1,67(0,20) |
L’affinement structural a été réalisé par la méthode de Rietveld [22] à l’aide du programme Fullprof [23]. Le groupe d’espace P63/m [2,3] et les paramètres de maille et les positions atomiques de la composition monosubstituée (Sr9La(PO4)5(SiO4)F2) ont été introduits comme modèle structural initial [24]. Le bruit de fond a été traité par un polynôme de cinquième ordre, alors que les pics ont été ajustés par une fonction pseudo-Voigt. Les paramètres affinés sont : le facteur d’échelle, le décalage du zéro, les positions atomiques, les paramètres de maille, la largeur à mi-hauteur, l’orientation préférentielle, les facteurs d’occupation et les facteurs d’agitation thermique isotrope. L’affinement des facteurs d’occupation des cations Sr2+, La3+ et Cs+ a été réalisé en supposant que les trois cations se répartissent entre les deux sites 4f et 6h. Etant donné qu’il n’est pas possible de distinguer par diffraction des rayons X les deux cations Cs+ et La3+, les deux étant iso-électroniques, un facteur d’occupation égal à deux a été considéré pour l’ensemble de ces deux cations, alors que le strontium a été utilisé pour compléter les deux sites 4f et 6h respectivement à quatre et six. Evidemment, il n’a pas été possible de distinguer les positions des différents cations. Les facteurs d’occupation de l’oxygène, fluor, phosphore et silicium ont été supposés constants. En raison d’une forte corrélation entre la position atomique « z » de l’atome F et son coefficient d’agitation thermique isotrope, « Beq », la même valeur que celle relative aux atomes d’oxygène a été initialement attribuée à ce coefficient. Signalons enfin que l’affinement a été réalisé en plusieurs étapes et que les paramètres obtenus après chaque étape ont été introduits pour réaliser l’étape suivante. Au cours des dernières étapes de l’affinement, tous les paramètres ont été libérés. Faut-il signaler que l’affinement de la structure a été réalisé en considérant, dans un premier temps, que la poudre est pure et, dans un second temps, qu’elle renferme des impuretés. Ainsi, dans le cas où la phase apatitique a été considérée comme pure, le nombre des paramètres affinés est égal à 33, alors qu’il est de 37 dans le cas contraire.
Partant de l’hypothèse que la poudre était pure, l’affinement avait conduit aux résultats regroupés dans le Tableau 2. Les valeurs des facteurs de fiabilité Rwp, Rp, RBragg et RF sont respectivement égales à 14,4, 10,7, 9,3 et 7,4. Quant au coefficient d’agitation thermique isotrope de l’atome F, il est relativement important, « Beq » = 2,23. Les diagrammes DRX observés, calculés et leur différence sont présentés sur la Fig. 1. Sur cette figure, les raies observées à 19,5°, 40,0°, 44,10°, 51,5°, 54,0° et 59,7°, de faible intensité, n’ont pu être interprétées par le groupe d’espace P63/m. Il est à noter que ces raies n’étaient pas visibles sur le diffractogramme acquis avec un pas de 0,02° et un temps de comptage égal à une seconde. Tous ces résultats donnent à penser que la phase Sr7La2Cs(PO4)5(SiO4)F2 n’était pas réellement pure et qu’elle renfermait des impuretés. Rappelons que la préparation de la phase Sr8LaCs(PO4)6F2 s’était accompagnée de la formation de la phase secondaire SrCsLa(PO4)2 de structure rhabdophane, alors que celle de Sr2La7Cs(SiO4)6F2 des phases CsLaSiO4 et Sr2SiO4 [21]. La comparaison des raies indiquées ci-dessus avec le fichier ICDD donne à penser qu’elles sont relatives à la phase SrCsLa(PO4)2 (fiche n° 00-035-0426). Étudiant l’insertion du césium dans les britholites calciques, Senamaud et al. ont constaté que la phase Ca7La2Cs(PO4)5(SiO4)F2 préparée apparaissait pure, mais après frittage à une température égale à 900 °C, ils ont relevé la formation de CaCsLa(PO4)2 [20] ; alors que Campayo a montré que quelle que soit la composition, le système obtenu est toujours polyphasé [25].
Paramètres et facteurs de fiabilité de l’affinement de la composition Sr7La2Cs(PO4)5(SiO4)F2.
| Formula | SrLaCsFa | SrLaCsFb | SrLaCs(PO4)2 |
| Masse molaire (g) | 1629,025 | 1629,025 | 549,383 |
| Système | hexagonal | hexagonal | hexagonal |
| Groupe d’espace | P63/m | P63/m | P6222 |
| Z | 1 | 1 | 1 |
| Paramètres cristallins | |||
| *a (Å) | 9,732(3) | 9,732(3) | 7,332(6) |
| *c (Å) | 7,287(2) | 7,287(2) | 6,499(2) |
| Volume, V (Å3) | 597,802(3) | 597,753(3) | 301,791(5) |
| Densité calculée (g/cm3) | 4,523 | 4,252 | 3,021 |
| Zéro point 2θ (°) | 0,0707(6) | −0,0384(6) | −0,0552(2) |
| Nombre de paramètres affinés | 33 | 37 | 37 |
| Facteurs de confiance | |||
| Rp | 10,7 | 8,94 | 8,94 |
| Rwp | 14,4 | 11,7 | 11,7 |
| RB | 9,3 | 6,61 | 14,5 |
| RF | 7,41 | 5,08 | 11,06 |
a Affinement en supposant que la phase apatitique est pure.
b Affinement en supposant que la phase apatitique renferme des impuretés.
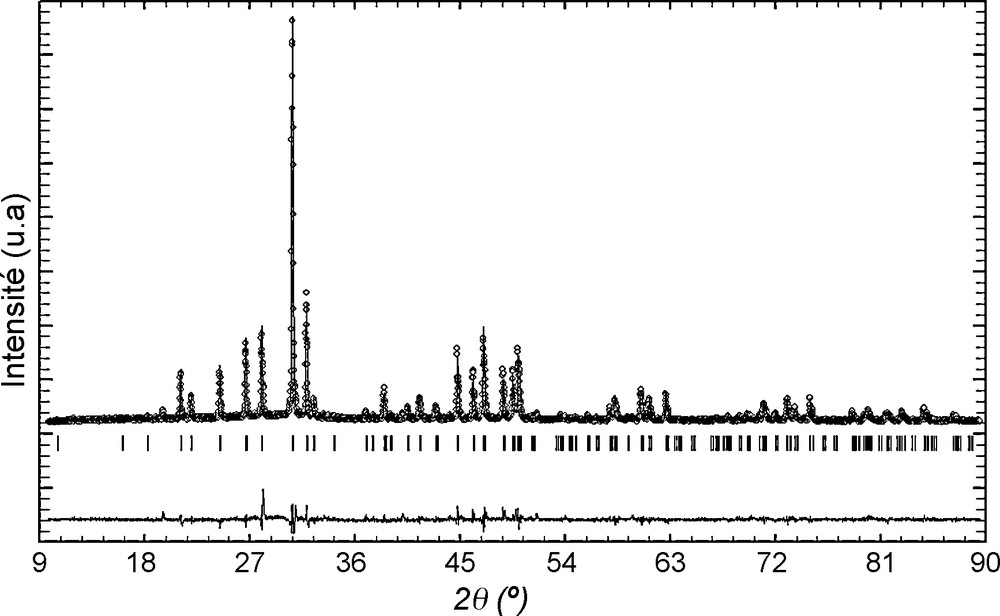
Diagrammes DRX observé, calculé et leur différence pour le composé Sr7La2Cs(PO4)5(SiO4)F2 en supposant qu’il est pur.
Une hypothèse structurale dérivant de celle de la phase LaPO4 qui est de symétrie hexagonale et de groupe d’espace (P6222) a permis d’interpréter le diffractogramme de la fiche ICDD 00-035-0426. Ainsi, en tenant compte de ce modèle structural pour la phase SrCsLa(PO4)2, il a été possible d’améliorer l’affinement entrepris et d’obtenir les résultats suivants : Rwp = 11,7, Rp = 8,94, RBragg = 6,6 et RF = 5,08. Les diagrammes DRX observé, calculé et leur différence sont présentés sur la Fig. 2. Par ailleurs, les résultats obtenus montrent que la poudre est constituée de 95,60 (0,82) % en masse de Sr7La2Cs(PO4)5(SiO4)F2 et de 4,40 (0,11) % en masse de SrCsLa(PO4)2. Les paramètres cristallographiques a et c de la maille apatitique déterminés à l’aide du programme Fullprof, respectivement 9,732(3) et 7,287(2), sont voisins de ceux calculés par la méthode des moindres carrés (a = 9,746(1) et c = 7,289(2)) [21].

Diagrammes DRX observé, calculé et leur différence pour le composé Sr7La2Cs(PO4)5(SiO4)F2 en supposant qu’il renferme des impuretés.
Dans le Tableau 3 sont consignés les positions atomiques, les facteurs d’occupation et les coefficients d’agitation thermique isotrope déterminés au cours des deux opérations d’affinement. Comme le montre ce tableau, un décalage notable de l’ion fluorure le long de l’axe z, en dehors des triangles formés par les cations Me(2), est observé, que l’affinement structural soit réalisé en absence (z = 0,219) ou en présence (z = 0,215) de la phase secondaire. Il est à noter qu’en tenant compte de la présence de la phase secondaire, on constate une diminution notable du facteur d’agitation thermique de l’atome F, sa nouvelle valeur est 0,907.
Positions atomiques, facteur d’occupation et paramètres d’agitation thermique de la composition Sr7La2Cs(PO4)5(SiO4)F2.
| Apatite | Atom | Symbole de Wyckoff | x | y | z | Facteur d’occupation de Site | Beq[Å2] |
| SrLaCsFa | Sr(I) | 4f | 0,333 | 0,666 | −0,0017(5) | 0,810(0) | 1,03 (4) |
| La(I) | 4f | 0,333 | 0,666 | −0,0017(5) | 0,126(0) | 1,03(4) | |
| Cs(I) | 4f | 0,333 | 0,666 | −0,0017(5) | 0,063(0) | 1,03(4) | |
| Sr(II) | 6h | 0,2365(3) | −0,0151(5) | 0,250 | 0,626(0) | 1,03(4) | |
| La(II) | 6h | 0,2365(3) | −0,0151(5) | 0,250 | 0,248(0) | 1,03(4) | |
| Cs(II) | 6h | 0,2365(3) | −0,0151(5) | 0,250 | 0,124(0) | 1,03(4) | |
| P/Si | 6h | 0,3997(2) | 0,3691(4) | 0,250 | 1 | 0,69(2) | |
| O1 | 6h | 0,3447(3) | 0,4854(7) | 0,250 | 1 | 2,23(4) | |
| O2 | 6h | 0,5620(5) | 0,4595(6) | 0,250 | 1 | 2,23(4) | |
| O3 | 12i | 0,3354(4) | 0,2583(4) | 0,0732(4) | 1 | 2,23(4) | |
| F | 4e | 0,000 | 0,000 | 0,2155(7) | 0,5 | 2,23(4) | |
| SrLaCsFb | Sr(I) | 4f | 0,333 | 0,666 | 0,0006(5) | 0,831(6) | 1,01(5) |
| La(I) | 4f | 0,333 | 0,666 | 0,0006(5) | 0,114(4) | 1,01(5) | |
| Cs(I) | 4f | 0,333 | 0,666 | 0,0006(5) | 0,057(2) | 1,01(3) | |
| Sr(II) | 6h | 0,2371(3) | −0,0147(5) | 0,250 | 0,612(6) | 1,01(3) | |
| La(II) | 6h | 0,2371(3) | −0,0147(5) | 0,250 | 0,258(4) | 1,01(3) | |
| Cs(II) | 6h | 0,2371(3) | −0,0147(5) | 0,250 | 0,129(2) | 1,01(3) | |
| P/Si | 6h | 0,3983(7) | 0,3674(5) | 0,250 | 1 | 0,25(11) | |
| O1 | 6h | 0,3354(7) | 0,4758(13) | 0,250 | 1 | 0,90(3) | |
| O2 | 6h | 0,5683(4) | 0,4585(12) | 0,250 | 1 | 0,90(3) | |
| O3 | 12i | 0,3442(6) | 0,2635(8) | 0,0706(8) | 1 | 0,90(3) | |
| F | 4e | 0,000 | 0,000 | 0,2199(3) | 0,5 | 0,90(3) |
a Affinement en supposant que la phase apatitique est pure.
b Affinement en supposant que la phase apatitique renferme des impuretés.
La détermination des taux d’occupation des sites 4f et 6h montre que les atomes de lanthane et césium se répartissent entre les deux sites cationiques, avec une préférence marquée pour les sites 6h, 23 % de césium et lanthane son logés dans les sites 4f (% Cs = 0,057 et % La = 0,114), alors que 77 % de ces éléments sont logés dans les sites 6h (% Cs = 0,129 et % La = 0,258). Cette occupation préférentielle des sites 6h par La3+ a été expliquée par l’établissement de liaisons fortes entre les ions La3+ et l’ion occupant le centre des triangles équilatéraux [24,26,27]. Quant à l’occupation préférentielle des sites 6h par Cs+ (coord. 6 : r = 1,67 Å ; coord. 8 : r = 1,74 Å ; coord. 9 : r = 1,78 Å) [28] elle peut être expliquée par l’effet stérique. En effet, ces sites sont plus larges que les sites 4f.
Les distances interatomiques calculées sont rassemblées dans le Tableau 4. La distance P/Si-O varie de 1,434(3) Å à 1,573(3) Å avec une valeur moyenne de 1,510 Å. Cette distance est plus courte que celles déterminées dans Sr8La2(PO4)4(SiO4)2F2 (1,552 Å) ou Sr10(PO4)6F2 (1,550 Å) [24]. Les cations localisés dans les sites 4f sont coordonnés chacun à neufs atomes d’oxygènes [3 × O(1), 3 × O(2), 3 × (O(3)], six atomes se répartissent au-dessus et en dessous du plan contenant le cation Me2+, alors que les trois autres, plus éloignés, se placent presque dans le même plan. Les distances Sr/LaCs(1)-O correspondantes sont respectivement de 2,605(5) Å, 2,627(16) Å, et 2,906(6) Å. Leur valeur moyenne égale à 2,713 Å est plus grande que celle observée pour Sr8La2(PO4)4(SiO4)2F2 (2,676 Å) ou Sr10(PO4)6F2 (2,683 Å). Quant aux cations Me(2), ils sont coordonnés chacun par six atomes d’oxygène et un atome de fluor. La valeur moyenne des distances Sr/LaCs(2)-O (2,616 Å) est légèrement supérieure à celle calculée pour la composition Sr8La2(PO4)4(SiO4)2F2 (2,600 Å) ou Sr10(PO4)6F2 (2,580 Å). Cette différence peut être expliquée par la taille de l’ion Cs+ qui est plus grande que celle de Sr2+ (coord. 7 : r = 1,21 Å) et La3+ (coord. 7 : r = 1,10 Å) [28]. Ainsi, la diminution de la distance moyenne < P/Si-O > peut être liée à l’extension des sites cationiques suite à l’incorporation du césium dans ces sites. De la même manière, on peut expliquer la diminution de la distance Sr/LaCs-F (2,393(5) Å) par rapport à celles observées dans les phases Sr8La2(PO4)4(SiO4)2F2 (2,440(3) Å) et Sr10(PO4)6F2 (2,419(4) Å).
Distances interatomiques (Å) et angles (°) de la composition Sr7La2Cs(PO4)5(SiO4)F2.
| SrLaCsFa | SrLaCsFb | |
| (P, Si)-(O1) | 1,461(9) | 1,461(5) |
| (P, Si)-(O2) | 1,385(3) | 1,434(3) |
| (P, Si) (O3) (× 2) | 1,592(7) | 1,573(3) |
| <(P, Si)-O> | 1,508 | 1,510 |
| (O1)- (P, Si)-(O2) | 104,50(31) | 108,92(23) |
| (O1)-(P, Si)-(O3) (× 2) | 111,19 (20) | 109,72(15) |
| (O2)-(P, Si)(O3) (× 2) | 111,01(23) | 108,03(16) |
| (O3)-(P, Si)-(O3) | 107,94(15) | 112,33(11) |
| < O-(P, Si)-O > | 109,47 | 109,46 |
| (Sr1, La1)-O(1) (× 3) | 2,585(6) | 2,605(5) |
| (Sr1, La1)-O(2)(×3) | 2,659(2) | 2,627(16) |
| (Sr1, La1)-O(3) (× 3) | 2,973(4) | 2,906(6) |
| < (Sr1, La1)-O > | 2,739 | 2,713 |
| (Sr2, La2)-O(1) | 2,857(2) | 2,772(3) |
| (Sr2, La2)-O(2) | 2,583(3) | 2,579(7) |
| (Sr2, La2)-O(3) (× 2) | 2,467(6) | 2,470(6) |
| (Sr2, La2)-O(3) (× 2) | 2,665(5) | 2,703(5) |
| < (Sr2, La2)-O > | 2,617 | 2,616 |
| (Sr2, La2)-F | 2,393(6) | 2,393(5) |
| DI ((P, Si)-O) | 0,0560 | 0,0492 |
| DI (O-(P, Si)-O) | 0,019 | 0,0100 |
a Affinement en supposant que la phase apatitique est pure.
b Affinement en supposant que la phase apatitique renferme des impuretés.
Les spectres RMN de 29Si et 31P présentés respectivement aux Fig. 3 et 4 comportent un pic fin pour chaque noyau avec un deuxième signal de faible intensité dans le cas du phosphore. L’allure fine des pics dont les déplacements chimiques sont respectivement −75,85 ppm et 3,53 ppm est caractéristique de l’homogénéité du matériau et suggère que Si et P occupent des sites cristallographiques équivalents. La valeur −75,85 ppm relative au silicium est du même ordre de grandeur que celles déterminées pour les compositions Sr10−xLax(PO4)6−x(SiO4)xF2 avec x = 1, 2 et 4, respectivement −74,8, −75,83 et −76,09 ppm [24], mais elle est légèrement plus faible que celles obtenues pour les échantillons La8M2(SiO4)6O2 (M = Ca, Sr et Ba), soit respectivement −77,2 ; −77,8 et −78,3 ppm [29]. Par ailleurs, comme il est attendu, cette valeur est conforme à une connectivité de type Q0 pour les groupements SiO4, c’est-à-dire que les tétraèdres SiO44− sont isolés [30]. Sur le spectre 31P le pic de faible intensité à 1,62 ppm est attribué au noyau du phosphore dans la phase SrLaCs(PO4)2. Cela confirme les résultats obtenus par diffraction des rayons X. D’après Campayo et al., son analogue CaNdCs(PO4)2 ne serait pas rédhibitoire pour le conditionnement du césium [25,31].

Spectre RMN 29Si en phase solide de la composition Sr7La2Cs(PO4)5(SiO4)F2.

Spectre spectres RMN du 31P en phase solide de la composition Sr7La2Cs(PO4)5(SiO4)F2.
4 Conclusion
Une britholite strontique dopée au césium préparée par réaction à l’état solide a été caractérisée par diffraction des rayons X et résonance magnétique nucléaire. L’affinement structural du diagramme DRX par la méthode de Rietveld a montré que la poudre renferme en réalité la phase secondaire SrLaCs(PO4)2 dont le pourcentage en masse est de 4,40(0,11). En se référant à des travaux antérieurs, cette phase ne serait pas rédhibitoire pour le conditionnement du césium. Il a été aussi montré que la répartition des ions La3+ et Cs+ entre les deux sites cristallographiques (4f et 6h) de l’apatite est non statistique, les deux ions occupent préférentiellement les sites 6h. Les spectres RMN de 31P et 29Si comportent un pic fin pour chaque noyau avec un deuxième signal de faible intensité dans le cas du phosphore. Les signaux fins et intenses observés respectivement 3,53 et −75,85 ppm indiquent que P et Si occupent des sites cristallographiques équivalents quant au signal de faible intensité, il serait relatif au noyau du phosphore de la phase SrLaCs(PO4)2.


