1 Introduction
Les lipases sont des catalyseurs très attrayants pour accéder à un grand nombre de substrats spécifiques, hautement énantiosélectifs et facilement valorisables d’un point de vue pratique [1]. Le dédoublement cinétique de racémiques par les lipases est un mode de synthèse commode, actuellement très exploité dans la production industrielle d’énantiomères purs [2]. Récemment, l’utilisation des lipases en milieu non aqueux s’étend aux fluides supercritiques [3] et aux liquides ioniques [4], solvants non toxiques qui contribuent au développement de la « chimie verte ». La sélectivité enzymatique dépend de plusieurs facteurs [5] ; la structure du substrat [6], la nature de l’agent acylant [7], du solvant [8] ou l’introduction d’additifs [9], susceptibles d’agir sur le site actif de l’enzyme. La nécessité du choix convenable du système agent acylant/enzyme pour parvenir à de hautes énantiosélectivités avec les arylalkylcarbinols dans la réaction de transestérification enzymatique a été montrée précédemment [10] et l’intérêt d’utiliser l’anhydride succinique comme agent acylant a été étendu à d’autres substrats [11].
Dans la littérature, peu de travaux montrent une influence directe de la quantité de l’enzyme sur l’énantiosélectivité du dédoublement enzymatique et cela peut être un facteur de contrôle important. Des effets sont décrits par Kanerva en 1998 avec la CAL-B [12] et en 2003 avec la CAL-A [13] et l’acétate de vinyle comme agent acylant. Lors de travaux antérieurs [14], nous avons montré un effet important de la variation de la quantité de la lipase de Candida Antarctica fraction B (CAL-B) sur la sélectivité de la réaction de transestérification avec l’acétate d’isopropényle comme agent acylant lors de la déracémisation d’alcools secondaires par résolution cinétique enzymatique combinée à la réaction de Mitsunobu. Récemment, nous avons optimisé le dédoublement cinétique du (±) - 2-hydroxymethyl phenylthioferrocene, en divisant par deux la quantité de la CAL-B, la sélectivité et la réactivité sont considérablement augmentées [15]. Cette influence de la quantité de lipase mise en jeu sur la sélectivité est peu commentée, peu décrite, les éléments intervenant sur son mode d’action dans l’acylation ne sont pas clairs. Avec le développement industriel de l’utilisation des biocatalyseurs en catalyse énantiosélective, il est particulièrement intéressant, sur le plan économique, d’optimiser la réactivité et la sélectivité en diminuant la quantité d’enzyme. Dans ce travail, nous avons examiné cet effet sur une large gamme de substrats. Les modèles d’étude sont des alcools de type arylalkylcarbinols dont un alcool ferrocénique. Les arylalkylcarbinols sont précurseurs de molécules à visée thérapeutique [16] et servent également de synthons chiraux dans les réactions catalysées au palladium [17]. Les alcools ferrocéniques, plus difficiles à dédoubler, sont des précurseurs de ligands performants en catalyse homogène [18].
L’acylation enzymatique des alcools 1–8 (Schéma 1) est réalisée avec divers agents acylants induisant l’irréversibilité de la réaction de transestérification [19] (Schéma 2). Dans la continuité des travaux précédents, nous avons étudié l’effet de la quantité de la CAL-B sur l’acylation des alcools benzyliques 1–7 et comparé deux types d’agents acylants ; l’acétate d’isopropényle et l’anhydride succinique, mieux valorisable sur un plan pratique, et permettant un accès aisé aux deux énantiomères, par simple extraction liquide–liquide [20].
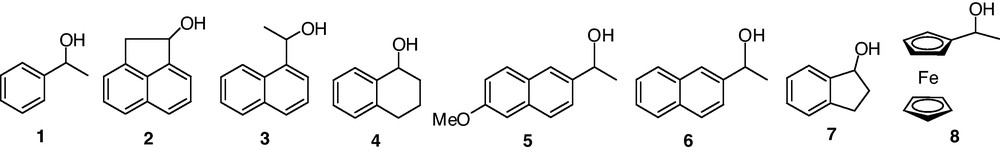
Modèles étudiés.
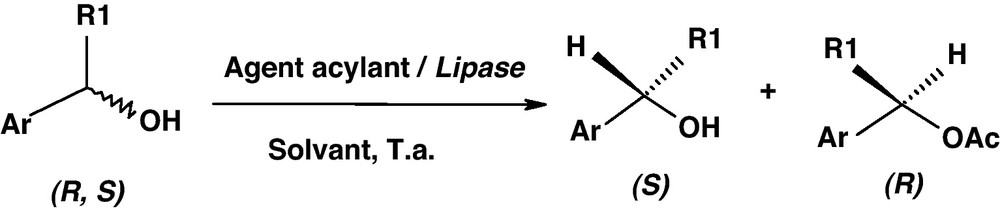
Acylation enzymatique des alcools 1–8.
Nous avons ensuite étudié l’effet du taux catalytique de différentes enzymes pour optimiser le dédoublement enzymatique de l’α-hydroxyferrocene racémique 8, faiblement dédoublé antérieurement [21]. Pour cela, nous avons sélectionné trois lipases microbiennes : la lipase de Candida Cylindracea (CCL), la lipase de Pseudomonas cepacia (PSL) et la lipase de Candida Antarctica-B (CAL-B).
2 Résultats et discussion
Les réactions d’acylation enzymatique ont été réalisées sur 1 mmole d’alcool racémique dissous dans le solvant, l’agent acylant est additionné à la solution. La lipase est ajoutée ensuite avec une quantité qui varie selon les cas de 200 mg à 3 mg, quantité minimale encore active avec certains substrats, l’activité spécifique des lipases est précisée dans chaque cas. Pour l’étude de l’effet de la quantité de lipase sur la réactivité et la sélectivité de l’acylation enzymatique des alcools 1–8 avec divers agents acylants, nous avons sélectionné la lipase de Candida Antarctica-B qui a montré les effets les plus significatifs dans nos travaux précédents [14].
2.1 Acylation des arylalkylcarbinols 2–7 : effet de la quantité de CAL-B
L’acylation des alcools benzyliques 2–7 est réalisée avec la CAL-B en présence des deux agents acylants, l’acétate d’isopropényle et l’anhydride succinique. Une millimole d’alcool racémique est dissoute dans 5 ml de solvant pour 2 millimoles d’acétate d’isopropényle, et d’une quantité équimolaire pour l’anhydride succinique. Les quantités de lipase varient de 150 mg à 3 mg. L’évolution des réactions est suivie par chromatographie liquide à haute performance. Les résultats sont réunis dans le Tableau 1.
Effet de la quantité de CAL-B lors de l’acylation des alcools 2–7.
| Entrée | Substrat | Agent acylanta | CAL-Bb (mg/mmole) | Substrat eesc (S) (%) | Produit eepc (R) (%) | Cd (%) | Ed |
| 1 | 2 | AI | 150 | 95 | 93 | 51 | 90 |
| 2 | 60 | > 99 | > 99 | 50 | > 500e | ||
| 3 | 30 | 42 | > 99 | 30 | > 100e | ||
| 4 | 6 | 7 | 98 | 7 | > 100e | ||
| 5 | AS | 150 | 15 | 67 | 18 | 6 | |
| 6 | 60f | 17 | 61 | 22 | 5 | ||
| 7 | 3 | AI | 150 | > 99 | > 99 | 50 | > 500e |
| 8 | 60 | > 99 | > 99 | 50 | > 500e | ||
| 9 | 25 | 53 | > 99 | 35 | 240 | ||
| 10 | 6 | 20 | > 99 | 17 | 100 | ||
| 11 | AS | 150 | 4 | 82 | 5 | 10 | |
| 12 | 60f | 2 | 34 | 6 | 2 | ||
| 13 | 4 | AI | 150 | > 99 | > 99 | 50 | > 500 |
| 14 | 50 | > 99 | > 99 | 50 | > 500 | ||
| 15 | AS | 150 | 79 | 91 | 46 | 50 | |
| 16 | 50 | 50 | > 99 | 34 | 140 | ||
| 17 | 5 | AI | 150 | > 99 | > 99 | 50 | > 500 |
| 18 | 20 | > 99 | > 99 | 50 | > 500 | ||
| 19 | AS | 150 | 69 | 47 | 60 | 6 | |
| 20 | 20f | – | – | – | – | ||
| 21 | 6 | AI | 150 | 73 | 97 | 43 | > 140 |
| 22 | 25 | > 99 | > 99 | 50 | > 500 | ||
| 23 | AS | 150 | 81 | 96 | 46 | 123 | |
| 24 | 25 | 38 | 96 | 28 | 134 | ||
| 25 | 7 | AI | 150 | > 99 | 85 | 54 | 60e |
| 26 | 3 | 92 | > 99 | 48 | > 500e | ||
| 27 | AS | 150 | 79 | > 99 | 44 | 480 | |
| 28 | 6 | 82 | 77 | 51 | 20 |
a Sur une millimole de substrat dans 5 ml d’éther éthylique à température ambiante durant 24 heures.
b CAL-B (Chirazyme®, L-2, c.-F, C2, Lyo, lipase de Candida antarctica, fraction B, fournie par Boehringer Mannheim UA = 4500 U/g).
c ee mesurés par HPLC sur Chiracel OD-H et OB-H pour l’alcool 4 ; les rendements chimiques isolés sont supérieurs à 30 % avec l’acétate d’isopropényle et supérieurs à 20 % avec l’anhydride succinique.
d La conversion C = eeS/eeS + eeP, la sélectivité E = Ln[(1−C)(1−eeS)]/Ln[(1−C)(1 + eeS)] [22].
e [14].
f La durée de réaction est de 3 à 6 jours.
Les résultats du Tableau 1 montrent l’influence considérable de la quantité de la CAL-B sur la réactivité et la sélectivité enzymatique selon la nature de l’agent acylant utilisé. Avec l’acétate d’isopropényle, la diminution de la quantité d’enzyme a été testée graduellement sur les substrats, 2 et 3, à partir d’une valeur initiale de 150 mg de lipase, pour une millimole d’alcool, jusqu’à une quantité 25 fois plus faible. Une influence de la structure du substrat est constatée sur la performance de la CAL-B en diminuant sa quantité, pour l’acenaphthenol 2 et le 1-(naphthalen-1-yl) ethanol 3, une quantité minimale de 60 mg de CAL-B est nécessaire pour améliorer la réactivité. Pour le substrat 2, quand on passe de 150 mg à 6 mg, la conversion baisse considérablement 51 % < C < 7 % (entrées 1–4), pour le composé 3 également avec 50 % < C < 17 % (entrées 7–10). Le facteur de sélectivité reste élevé pour l’alcool 3, dans tous les cas, pour l’alcool 2, la meilleure réactivité est observée pour 60 mg de lipase (entrée 2), les ee des substrats et produits diminuent légèrement pour 150 mg (entrée 1) E = 90 pour C = 51 %. Pour les alcools 4, 5, et 6, l’étude de l’influence de ce paramètre a été réalisée en comparant la quantité maximale de 150 mg de CAL-B et la quantité minimale d’enzyme nécessaire pour une réactivité optimale. Des sélectivités E > 500 sont obtenues pour l’alcool 4 avec 50 mg de lipase (entrée 14), pour l’alcool 5, avec 20 mg de lipase (entrée 18), pour l’alcool 6, avec 25 mg de lipase (entrée 22). Un effet bénéfique de la diminution de la quantité de CAL-B est observé dans tous les cas avec l’acétate d’isopropényle. Les sélectivités restent élevées pour les substrats 4 et 5, elles sont améliorées dans tous les autres cas. L’effet bénéfique est constaté également avec l’alcool 7 et l’acétate d’isopropényle, quand on passe de 150 mg à 3 mg de CAL-B, la sélectivité augmente considérablement 60 < C < 500 (entrées 25–26). Dans le cas de l’anhydride succinique, les résultats du Tableau 1 montrent que la diminution du taux catalytique entraîne des effets différents de ceux obtenus avec l’acétate d’isopropényle pour les mêmes composés. Ces résultats sont spécifiques à cet agent acylant et dépendent de la structure du substrat.
Avec les alcools 2 et 3, les réactivités et sélectivités de la CAL-B sont inchangées que ce soit avec 150 mg ou 60 mg (entrées 5–6 et 11–12). Dans le cas de l’alcool 4, la sélectivité passe d’une valeur de E = 50 avec 150 mg d’enzyme (entrée 15) à une haute sélectivité E =140 avec une quantité de lipase trois fois plus faible (entrée 16). Par ailleurs, la CAL-B reste totalement inactive vis-à-vis de l’alcool 5 quand on diminue la quantité d’enzyme à 20 mg (entrée 20) alors qu’avec 150 mg on a une bonne réactivité C = 60 % et une faible sélectivité E = 6 (entrée 19). Pour le substrat 6 la sélectivité reste élevée E > 120 (entrée 23 et 24) mais la réactivité de la CAL-B est réduite quand on passe de m = 150 mg de lipase C = 46 % (entrée 23) à m = 25 mg C = 28 % (entrée 24). Pour le 1-indanol 7, l’utilisation d’une quantité 25 fois plus faible de CAL-B permet de conserver une bonne réactivité, mais la sélectivité chute de façon très nette de E = 480 pour 150 mg (entrée 27) à E = 20 pour m = 6 mg (entrée 28) à l’inverse de ce que l’on obtient avec l’acétate d’isopropényle. On constate un seuil d’efficacité catalytique de l’enzyme pour chaque substrat dépendant de la nature de l’agent acylant. L’effet de la quantité d’enzyme est lié à la nature du substrat et à celle de l’agent acylant mis en jeu. Nous avons tenté d’optimiser le dédoublement enzymatique de l’α-hydroxyferrocene 8 racémique par l’étude de la diminution du taux catalytique et cela avec plusieurs lipases commerciales, non exploitées précédemment pour dédoubler ce substrat. Dans l’étude qui suit, nous recherchons l’effet de la quantité des lipases et le seuil optimal d’activité et de sélectivité pour l’α-hydroxyferrocene 8 que nous comparons avec le 1-phenylethanol 1 considéré par Boaz [21b] comme analogue de structure pour les modèles de reconnaissance chirale.
2.2 Acylation l’α-hydroxyferrocene 8 : effet de la quantité d’enzyme
L’acylation de l’alcool 8 est effectuée avec l’acétate de vinyle qui a donné, selon une étude préliminaire, les meilleures réactivités et sélectivités comparativement à l’acétate d’isopropényle et à l’anhydride succinique. Deux des lipases utilisées sont sous forme libre : la Lipase de Candida Cylindracea (CCL) fournie par Fluka (3,85 UA/mg) et la Lipase de Pseudomonas cepacia (ps. Amano) (PSL) (> 30 000 UA/g) ; la troisième, sous forme immobilisée, est la Lipase de Candida Antarctica-B immobilisée sur résine acrylique (CAL-B) fournie par Fluka (2 UA/mg). Les résultats sont réunis dans le Tableau 2. Leur analyse montre un effet de la quantité de lipase lors de l’acylation l’α-hydroxyferrocene 8 par l’acétate de vinyle avec la PSL, effet non observé avec la CAL-B dans ces conditions. La CCL n’est pas sélective pour 8, sa réactivité chute de C = 23,5 % à C = 0 % (entrées 1et 4) si la quantité de CCL augmente de 50 mg à 200 mg par milli mole de substrat. La conversion optimale C = 40 % est obtenue pour 100 mg de CCL (entrée 2). Ce taux catalytique de CCL est peu efficace pour l’acylation du phényléthanol 1, C = 7 %, E = 3 (entrée 11). La PSL est inactive pour des quantités inférieures à 100 mg (entrées 5 et 6), elle devient réactive et énantiosélective à partir de 150 mg de lipase où la conversion atteint C = 42 % et E > 400 (entrée 7) ; le (R)-ferrocenylethyl acétate est obtenu avec une excellente énantiosélectivité ee > 99 %. Si on augmente la quantité de lipase à 200 mg/mmole, la réactivité est maintenue, en revanche, une chute importante de l’énantiosélectivité est observée à E = 13 (entrée 8). Avec ce taux catalytique, la PSL montre une bonne sélectivité et réactivité vis-à-vis de l’alcool 1 obtenu avec une conversion C = 50 % et E > 500 (entrée 12).
Étude de l’effet de la quantité et la nature de lipase lors du DCE de (+/−)-8.
| Entrée | Substrat | Qté lipase (mg/mmole) | Temps (h) | Produit | Substrat | C(%)d | Ed | ||
| eeP (%)c | Rdt (%)e | eeS (%)c | Rdt (%)e | ||||||
| 1 | (+/−)-8a | CCL (50 mg) | 144 | 31 (R) | 10 | 9,6 (S) | 40 | 23,5 | 2 |
| 2 | CCL (100 mg) | 144 | 4,5 (R) | 20 | 3 (S) | 35 | 40 | 1 | |
| 3 | CCL (150 mg) | 144 | 5 | – | 0,4 | 65 | 9 | 1 | |
| 4 | CCL (200 mg) | 144 | – | – | 0,2 | 90 | — | — | |
| 5 | Ps. Amano mg) | 144 | – | – | 0,4 | 90 | — | — | |
| 6 | Ps. Amano (100 mg) | 144 | – | – | 6,5 | 87 | — | — | |
| 7 | Ps. Amano (150 mg) | 144 | 99 | 28 | 71 (S) | 35 | 42 | 425 | |
| 8 | Ps. Amano (200 mg) | 144 | 72 (R) | 25 | 72,6 (S) | 40 | 50 | 13 | |
| 9 | CAL-B (40 mg) | 24 | 99 (R) | 30 | 99,5 (S) | 45 | 50 | > 500 | |
| 10 | CAL-B (334 mg)f | 2 | > 99 (R) | 49 | 98 (S) | 42 | 50 | > 438 | |
| 11 | (+/−)-1b | CCL (100 mg) | 170 | 50 (R) | – | 4 | – | 7 | 3 |
| 12 | Ps. Amano (100 mg) | 16 | 99,9 (R) | 47 | 99,5 (S) | 48 | 50 | > 500 | |
| 13 | CAL-B (20 mg) | 64 | > 99 | 45 | > 99 | 46 | 50 | > 500 | |
| 14 | CAL-B (40 mg) | 24 | 99 (R) | 48 | 97 (S) | 47 | 49,5 | > 500 | |
| 15 | CAL-B (150mg)g | 24 | > 99 (R) | 3 | 5 (S) | 62 | 5 | 40 |
a Sur 1 mmole d’alcool racémique, 3 mmoles d’AV dans 6 mL de DIPE à température ambiante.
b Sur 1 mmole de phényl éthanol, 3 mmoles d’AI dans 5 mL d’Et2O à température ambiante.
c Excès énantiomérique mesurés par HPLC sur colonne Chiralpak pour le (+/−)-8, et GC chirale CHIRALSIL-DEX CB (25m ; 0,25mm, 25mm) isotherme 140̊C pour le (+/−)-1.
d Taux de conversion : C = eeS/eeP + eeS. Facteur de sélectivité : E = Ln[(1−C)(1−eeS)]/Ln[(1−C)(1 + eeS)] [22].
e Rendements chimiques isolés par flach chromatographie.
f [21d].
g [14].
L’acylation de l’α-hydroxyferrocène 8 avec la CAL-B est très rapide et sélective, et ce, quelle que soit la quantité d’enzyme. Pour m = 334 mg de lipase, la réaction est plus lente, elle passe d’une durée de deux heures où C = 50 % E > 400 (entrée 10) à 24 heures pour une quantité environ dix fois plus faible de m = 40 mg de CAL-B on obtient C = 50 % et E > 500 et le (R)-ferrocénylethyl acétate, ainsi que l’alcool résiduel (S) sont obtenus avec des énantiosélectivités très élevées ee > 99 % (entrée 9). Les résultats sont différents en ce qui concerne le phényléthanol 1, pour lequel la réactivité et la sélectivité de la CAL-B varient selon la quantité de lipase mise en jeu. Nous observons un effet considérable de la diminution de la quantité de lipase sur la réactivité et la sélectivité enzymatique quand on passe de 150 mg où la conversion C = 5 % et E = 40 (entrée 15) à 40 mg de lipase ou conversion et sélectivité décuplent ; C = 49,5 et E > 500 (entrée 14) ; les mêmes résultats sont obtenus quand on divise par deux la quantité à m = 20 mg de CAL-B (entrée 13).
La lipase de CAL-B permet d’obtenir les sélectivités les plus élevées aux taux catalytiques les plus faibles. Pour tenter d’expliquer comment la quantité de la lipase intervient sur la sélectivité, nous avons examiné si la nature du solvant interfère avec la quantité d’enzyme sur la sélectivité de la réaction. Nous avons étudié l’effet de la diminution de la quantité de CAL-B, lors de l’acylation enzymatique de l’alcool ferrocénique 8, avec deux solvants d’hydrophobicité différentes, l’éther de di-isopropyle (DIPE) et le toluène. L’évolution des réactions est suivie par chromatographie liquide à haute performance (CLHP). Les résultats obtenus sont réunis dans le Tableau 3.
Effet de solvant lors de l’acylation de 8 avec la CAL-B.
| Entrée | Substrat | Quantité lipase mg/mmole | Solvant (logP) | Temps (h) | Produit | Substrat | C(%)d | Ed | ||
| eeP (%)c | Rdt (%)e | eeS (%)c | Rdt (%)e | |||||||
| 1 | 8a | CAL-B (40 mg) | DIPE (1,4) | 24 | 99 (R) | 30 | 99,9 (S) | 45 | 50 | > 500 |
| 2 | CAL-B (334 mg)f | 2 | > 99 (R) | 30 | 98 (S) | 42 | 50 | > 430 | ||
| 3 | CAL-B (40 mg) | PhCH3 (2,5) | 24 | 99 (R) | 28 | 99,9 (S) | 35 | 50 | > 500 | |
| 4 | CAL-B (334 mg)f | 4 | 81 (R) | 47 | 69 (S) | 28 | 46 | 20 | ||
| 5 | 1b | CAL-B (40 mg) | 16 | 99(R) | 48 | 99 (S) | 47 | 50 | > 500 |
a Sur 1 mmole d’alcool racémique, 3 mmoles d’AV à température ambiante.
b Sur 1 mmole d’alcool racémique, 3 mmoles d’AI, à température ambiante.
c Excès énantiomérique mesurés par HPLC sur colonne Chiralpak pour le (+/−)-8, et GC chirale, isotherme 140̊C pour le (+/−)-1.
d Conversion : C = eeS/eeP + eeS. Facteur de sélectivité : E = Ln [(1−C)(1−eeS)]/Ln[(1−C)(1 + eeS)] [22].
e Rendements chimiques des produits isolés.
f [21d].
Les résultats du Tableau 3 montrent une dépendance importante du taux catalytique mis en jeu avec la nature du solvant et la structure du substrat. Dans le toluène, la diminution de la quantité de la CAL-B de 334 mg à 40 mg, conduit à une élévation considérable de la sélectivité enzymatique du ferrocényléthanol 8, de E = 20 à E > 500 pour une conversion 46 % < C < 50 % (entrée 3 et 4). Cet effet n’apparaît pas dans l’éther de di-isopropyle où dans les mêmes conditions de réaction, les conversions et sélectivités restent identiques C = 50 % et E > 400 (entrées 1 et 2). Lorsque l’on passe de l’éther de di-isopropyle (log P = 1,4), au toluène (log P = 2,5), on observe un effet important du taux catalytique sur la sélectivité vis-à-vis du substrat 8, lié à l’hydrophobicité du solvant. Dans les deux cas, la durée de réaction est plus élevée quand la quantité d’enzyme diminue. Pour le phényléthanol 1, la réaction dans le toluène, avec 40 mg de CAL-B, ne modifie ni la réactivité, ni la sélectivité (entrée 5). Nous avons pu optimiser le système biocatalytique pour le dédoublement cinétique enzymatique de l’α-hydroxyferrocene 8. Quelques hypothèses sont avancées pour expliquer ce phénomène ; la première serait le rôle de l’eau dans le milieu réactionnel. Les résultats obtenus dans cette étude confortent une implication des molécules d’eau présentes dans le milieu réactionnel, dont l’activité est plus importante dans les solvants hydrophiles. L’influence de l’eau sur l’énantiosélectivité de la lipase de Candida Antarctica-B a été rapportée récemment sur une série d’alcools linéaires secondaires [23], une activité aqueuse importante entraine une diminution de l’énantiosélectivité. Une autre explication avancée par Paizs et al. [13] serait la présence d’agrégats de l’enzyme qui, interviendraient négativement sur l’énantiosélectivité. Ces différences d’activité et d’énantiosélectivité des lipases seraient liées à des effets de limitation de diffusion de l’enzyme en milieu organique [24].
L’efficacité réelle du dédoublement enzymatique est multifactorielle. Selon le taux catalytique mis en jeu, plusieurs phénomènes interagissent simultanément, sur la sélectivité de la lipase, dans le milieu réactionnel. L’augmentation de la quantité d’enzyme conduit à une présence plus importante de « l’eau constitutive » de l’enzyme qui se trouve, en concentration d’autant plus importante que la quantité d’enzyme est grande. Ce paramètre est nécessaire à l’enzyme afin de lui assurer sa structure active optimale, mais un excès d’eau, donnerait lieu à des réactions d’hydrolyse compétitives décrites dans la littérature [25]. Par ailleurs, les problèmes de limitation de transport de masse gênent probablement la diffusion de l’enzyme dans le milieu réactionnel et peuvent intervenir également sur sa stéréospécificité.
2.3 Tentative d’interprétation de l’amélioration de la sélectivité avec la diminution de la quantité d’enzyme mise en jeu
Avec l’acétate d’isopropényle comme agent acylant, la diminution de quantité de lipase CAL-B mise en jeu n’entraîne pas de diminution notable de l’énantiosélectivité, qui demeure supérieure à 100, pour la plupart des substrats (substrats 2, 3, 4, 5, 6, Tableau 1, entrées 1–4, 7–10, 13–14, 17–19, 21–22 ; substrat 8, Tableau 2, entrées 9–10) ; seule la conversion est parfois affectée.
Quelques exemples montrent une amélioration de l’énantiosélectivité consécutive à une diminution de la quantité d’enzyme mise en jeu. (substrat 7 avec CAL-B, Tableau 1, entrées 25–26 ; substrat 8 avec Ps Amano, Tableau 2, entrées 7–8 ; substrat 8 avec CCL, Tableau 2, entrées 1–4).
On observe pour quelques cas une augmentation de la conversion et de l’énantiosélectivité apparentes. Le cas le plus significatif concerne le dédoublement du phényléthyl carbinol 1 par acylation en présence de CAL-B (Tableau 2, entrées 13–15), où l’on observe une augmentation de la conversion apparente et de l’énantiosélectivité. La pureté énantiomérique de l’acétate formé est toujours très élevée (99 % ou plus de 99 %), cependant la quantité recueillie diminue fortement lorsque la quantité de lipase mise en jeu est élevée, la conversion apparente est faible (évaluée à 5 %) et la quantité de substrat récupéré est importante.
Ces résultats pourraient être interprétés en considérant que la réaction de déacylation de l’acylenzyme par l’alcool 1 est très énantiosélective : seul l’énantiomère R est actif (Schéma 3). Cela rend compte de la très bonne pureté énantiomérique de l’acétate formé. La faible quantité d’acétate produit lors de l’utilisation de quantité importante d’enzyme pourrait provenir de la réversibilité de cette réaction de déacylation [26] qui serait d’autant plus efficace que la quantité d’enzyme est élevée. Ce pourrait être le cas quand l’eau apportée par une grande quantité d’enzyme provoque la déacylation de l’enzyme, entrant en compétition avec la déacylation par l’alcool-R et concourant à produire une forte concentration d’enzyme (Schéma 3) et ainsi la réversibilité importante de la réaction de déacylation, diminuant l’efficacité de celle-ci.
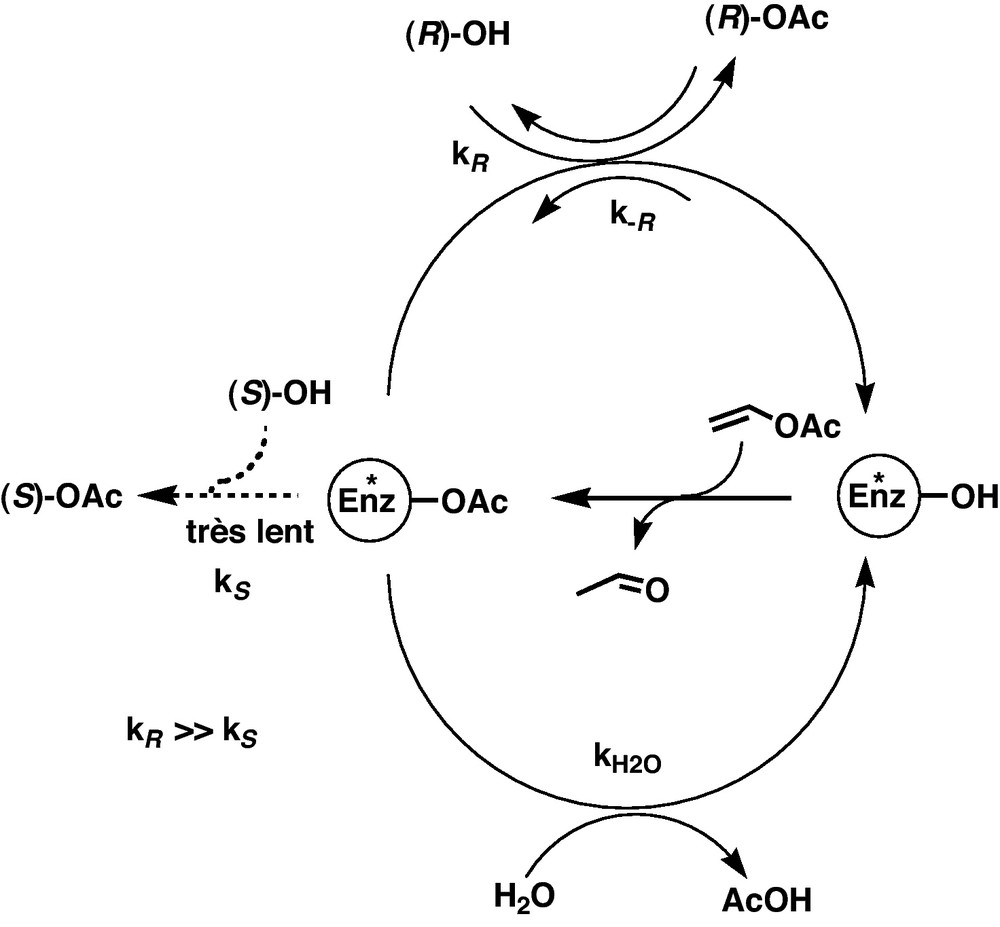
Hypothèse de mécanisme interprétant la diminution d’activité apparente et de sélectivité lors de la mise en jeu de grande quantité d’enzyme.
Ainsi, une faible quantité d’enzyme apporte une faible quantité d’eau assurant un bon dédoublement de l’alcool 1. Au contraire, une forte quantité d’enzyme apporte une quantité importante d’eau, provoquant une compétition entre l’alcool et l’eau pour la déacylation de l’enzyme. Cela ralentit la déacylation par l’alcool-(R)-1, d’une part, et augmente la concentration d’enzyme, d’autre part, favorisant l’acylation de l’enzyme par l’acétate de (R)-1, réaction inverse de la déacylation, avec pour conséquences l’apparente faible conversion de l’alcool 1 et la faible pureté énantiomérique de l’alcool récupéré. Un raisonnement semblable permet d’expliquer que ce n’est qu’avec de faible quantité de lipase (CCL) que l’on observe une formation conséquente (quoique faible) d’acétate de pureté énantiomérique non négligeable dans le dédoublement de 8 avec cette enzyme (Tableau 2, entrées 1–4).
3 Partie expérimentale
3.1 Généralités
Les alcools 1, 2, 6 et 7 sont commerciaux, les alcools 3, 4, et 6 sont obtenus par la réduction des cétones commerciales correspondantes. La lipase de Candida antartica fraction B (ChirazymeR L-2, c.-F, C2, Lyo) fournie par Boehringer Mannheim présente une activité spécifique de 4,5 ku/g). Les chromatographies sur couche mince (CCM) sont réalisées à l’aide des plaques pré enduites de gel de silice Merck Si 60 F254. Les chromatographies sur colonne ont été réalisées avec le gel de silice Merck Kieselgel 60 (40–63 μm). La CLHP est effectuée à l’aide d’une pompe Spectra Series P100 ; les colonnes chirales sont de type Chiralcel OD-H et OB-H et sont reliées à un détecteur UV réglé à la longueur d’onde λ = 254 nm.
3.2 Synthèse de l’α-hydroxyéthyl ferrocène 8
Dans un ballon tricol de 1L, muni d’un réfrigérant, sont disposés 4,2 g (soit 2,5 éq, 109,6 mmol) d’hydrure de lithium et d’aluminium (LiAlH4) en solution avec 150 mL d’éther diéthylique anhydre. Le mélange est soumis à une agitation magnétique sous 0 °C. Après quelques minutes, une solution de 10 g d’α-acétylferrocène (43,8 mmol) dans 50 mL d’éther diéthylique anhydre, est additionnée goutte à goutte, à l’aide d’une seringue, au mélange réactionnel. L’évolution de la réaction est suivie par chromatographie sur couche mince avec un mélange : cyclohexane/acétate d’éthyle : 80/20 (Rf = 0,38). Après consommation totale de l’α-acétylferrocène, une hydrolyse est réalisée avec une solution de soude (NaOH, 2 N) lentement et à froid jusqu’à l’obtention d’une solution limpide et d’un précipité d’oxyde d’aluminium. Le mélange est filtré, lavé avec une solution saturée du chlorure de sodium (NaCl) et extrait à l’éther. La phase organique est séchée sur sulfate de magnésium puis évaporée sous pression réduite. Le produit de masse 7,82 g (31,6 mmoles) est obtenu sous forme de cristaux orange, soit un rendement chimique de 72 %.
Caractéristiques spectroscopiques de l’α-hydroxyéthyl ferrocène 8
RMN1H (300 MHz, CDCl3) : δ (ppm) = 1,45 –1,47 (d, 2H, J = 6,2 Hz, CH3) ; 1,89 (s, 1H, –CH–OH) ; 4,20–4,22 (ma, 9H, CP) ; 4,52 (q, 1H, J = 6,2 Hz, –CH–OH). RMN13C (75 MHz, CDCl3) : δ (ppm) = 23,7 ; 65,6 ; 66,3 ; 68,1 ; 68,2 ; 68,6 ; 68,9 ; 76,6 ; 77,0 ; 77,5 ; 95,1. MS (EI ; m/z) : 230 ([M] +, 100 %).
3.3 Dédoublement cinétique enzymatique avec les esters d’énol
Dans un Schlenk muni d’un barreau aimanté, 2 mmoles d’alcool racémique et 4 mmoles d’acétate d’isopropényle sont dissoutes dans 10 ml d’éther diéthylique. Une quantité catalytique de la lipase de Candida antarctica-B est additionnée au mélange qui est soumis à une agitation magnétique, à température ambiante, pendant un temps qui varie entre 22 et 64 heures. La suspension est filtrée sur célite pour éliminer l’enzyme et le solvant est évaporé. Les constituants du mélange sont séparés par chromatographie sur colonne de gel de silice avec un éluant composé d’éther de pétrole et d’acétate d’éthyle (80/20).
3.4 Dédoublement cinétique enzymatique avec l’anhydride succinique
Dans Schlenk muni d’un barreau aimanté, 2 mmoles d’alcool racémique et 2 mmoles d’anhydride succinique sont solubilisés dans 15 mL d’éther diéthylique. Une quantité catalytique de l’enzyme CAL-B est ajoutée au mélange qui est soumis à une agitation magnétique, à température ambiante, pendant un temps qui varie selon le substrat entre 1 et 6 jours. La suspension obtenue est ensuite filtrée sur célite pour éliminer l’enzyme. On y ajoute 2 mL d’une solution saturée de Na2CO3 (2 M) et on agite vigoureusement le mélange. L’énantiomère n’ayant pas réagi avec l’agent acylant reste dans la phase organique tandis que celui qui a réagi, est récupéré sous forme d’ester acide dans la phase aqueuse. La phase éthérée où se trouve l’alcool résiduel, est séchée avec MgSO4, puis filtrée et concentrée. La phase aqueuse subit un traitement basique par addition de 4 mL d’une solution d’hydroxyde de sodium NaOH (1 M) afin de saponifier l’ester acide. Au bout de deux heures d’agitation magnétique, on procède à l’extraction avec l’éther éthylique suivie du séchage sur MgSO4. Après filtration et évaporation du solvant, on obtient l’énantiomère alcool qui a réagi avec l’anhydride succinique.
3.5 Analyse chromatographique chirale
3.5.1 Alcools racémiques
1-phényléthanol 1 : HPLC colonne Chiracel OB-H, éluant : hexane/i-PrOH = 94/6 ; débit : 1 mL/min ; 254 nm ; température 25 °C ; temps de rétention : tS = 7,7 min ; tR = 11,2 minutes.
Acénaphthénol 2 : HPLC colonne Chiracel OD-H, éluant : hexane/i-PrOH : 97/3 ; débit : 0,5 mL/min ; 254 nm ; température 25 °C ; temps de rétention : tS = 38,2 min ; tR = 41,5 minutes.
1-(1-naphthyléthanol) 3 : HPLC colonne Chiracel OD-H, éluant : hexane/i-PrOH : 90/10 ; débit : 0,5 mL/min ; 254 nm ; température 25 °C ; temps de rétention : tS = 17,9 min ; tR = 28,1 minutes.
1,2,3,4-tétrahydro-1-naphthol 4 : HPLC colonne Chiracel OB-H, éluant : hexane/i-PrOH : 96/4 ; débit : 0,5 mL/min ; 254 nm ; température 25 °C ; temps de rétention : tS = 9,1 min ; tR = 16,3 minutes.
1-[2-(6-méthoxynaphthyl)] éthanol 5 : HPLC colonne Chiracel OD-H, éluant : hexane/i-PrOH : 90/10, débit : 0,5 mL/min ; 254 nm ; température 25 °C ; temps de rétention : tS = 17,7 min ; tR = 22,6 minutes.
1(2-naphthyl)éthanol 6 : HPLC colonne Chiracel OD-H, éluant : hexane/i-PrOH : 95/5, débit : 0,5 mL/min ; 254 nm ; température 25 °C ; temps de rétention : tS = 33,5 min ; tR = 35,4 minutes.
1-indanol 7 : HPLC colonne Chiralcel OD-H, éluant : hexane/i-PrOH : 98/2, débit : 0,8 mL/min ; 254 nm ; température 25 °C ; temps de rétention : tS = 20,7 min ; tR = 24,3 minutes.
α-hydroxyéthyl ferrocène 8 : HPLC colonne Chiralpak AS, éluant : hexane/iPrOH : 99/1, débit de 1 mL/min ; 254 nm ; température 25 °C ; temps de rétention : tS = 24,9 min ; tR = 32,8 minutes.
3.5.2 Acétates racémiques
Acétate de 1-phényléthyle 1a : HPLC colonne Chiracel OB-H, éluant : hexane/i-PrOH : 99,2/0,8 ; débit : 0,6 mL/min ; 254 nm ; température 25 °C ; temps de rétention : tS = 13,1 min ; tR = 14,8 minutes.
Acétate de 1-acénaphthyle 2a : HPLC colonne Chiracel OD-H, éluant : hexane/i-PrOH : 99,3/0,7 ; débit : 1 mL/min ; 254 nm ; température 25 °C ; temps de rétention : tS = 11,5 min ; tR = 12,8 minutes.
Acétate de 1-acétonaphthyle 3a : HPLC colonne Chiracel OD-H, éluant : hexane/i-PrOH : 90/10, débit : 0,5 mL/min ; 254 nm ; température 25 °C ; temps de rétention : tS = 11,5 min ; tR = 9,5 minutes.
1,2,3,4-tétrahydro-1-acétoxynaphthalène 4a : HPLC colonne Chiracel OB-H, éluant : hexane/i-PrOH : 99/1, débit : 0,6 mL/min ; 254 nm ; température 25 °C ; temps de rétention : tS = 17,5 min ; tR = 15,6 minutes.
Acétate de 1-[2-(6-méthoxynaphthyl)] éthyle 5a : HPLC colonne Chiracel OD-H, éluant : hexane/i-PrOH : 90/10, débit : 0,5 mL/min ; 254 nm ; température 25 °C ; temps de rétention : tS = 10,5 min ; tR = 9,7 minutes.
Acétate de 2-acétonaphthyle 6a : HPLC colonne Chiracel OD-H, éluant : hexane/i-PrOH : 95/5 ; débit : 0,5 mL/min ; 254 nm ; température 25 °C ; temps de rétention : tS = 12,3 min ; tR = 10,7 minutes.
1-acétoxyindane 7a : HPLC colonne Chiracel OD-H, éluant : hexane/i-PrOH : 98/2, débit : 0,8 mL/min ; 254 nm ; température 25 °C ; temps de rétention : tS = 6,7 min ; tR = 6,2 minutes.
α-acétoxyéthylferrocène 8a : HPLC colonne Chiralpak AS, éluant : hexane/i-PrOH (99/1), débit : 0,5 mL/min, 254 nm ; température 25 °C ; temps de rétention : tR = 11,7 min, tS = 13,9 minutes.
4 Conclusion
Cette étude montre l’influence importante de la quantité de lipase sur la sélectivité du dédoublement enzymatique des alcools secondaires. Le seuil d’efficacité catalytique dépend de la structure du substrat, de la nature de l’agent acylant et de celle du solvant utilisé, ces paramètres interviennent sur l’énantiosélectivité de l’acylation enzymatique. Avec le 1-indanol 7, la lipase CAL-B présente une sélectivité nettement améliorée avec l’acétate d’isopropényle, de E = 60 à E > 500, en revanche, l’utilisation de l’anhydride succinique, dans les mêmes conditions, provoque une chute très significative de la sélectivité de E = 480 à E = 20 pour ce même substrat. Un résultat intéressant est obtenu avec l’anhydride succinique et le 1,2,3,4-tetrahydronaphthalen-1-ol 4, où la réduction de la quantité de la CAL-B de 150 mg à 20 mg conduit à l’augmentation du facteur de sélectivité de E = 50 à E = 140. L’acylation enzymatique de l’α-hydroxyferrocene 8 a été optimisée avec les lipases de ; Candida Antarctica-B, C = 50 % E > 500 et la Pseudomonas cepacia, C = 42 % E = 425, avec l’acétate de vinyle, à un taux catalytique plus faible. La diminution de la quantité de Candida Antarctica-B, dans le toluène, permet une augmentation importante de la sélectivité pour le ferrocenylethanol 8, de E = 20 à E > 500, cet effet n’apparaît pas dans l’éther di-isopropyle.
Remerciements
Les auteurs remercient le ministère algérien de l’Enseignement supérieur et de la recherche scientifique MESRS (FNR 2000 - PNR) ; le ministère français des Affaires étrangères (Projet Tassili 06 MDU 674) et l’université catholique de Louvain (FNRS) pour le support financier.


