1 Introduction
En 1801, Jean-Baptiste Pujoulx, chroniqueur parisien, affirme que la capitale possède 3000 fabriques [1]. Au moins 80 000 ouvriers y travaillent en 1800 [2], mais 120 000 en 1810 [3], dont 12 000 dans les filatures de coton, 3000 pour le tulle et la gaze, un millier pour le papier peint, 10 000 chiffonniers, 5000 porteurs d’eau, 4000 vidangeurs, plus de 3000 chapeliers et autant de doreurs, 1500 dans la manufacture de tabac. On trouve encore une bonne vingtaine de fabriques de produits chimiques, de colles, d’amidon, de gélatine, autant de salpêtriers qui alimentent l’Arsenal. Paris est alors le premier centre chimique du monde.
Au milieu du XVIIIe siècle, la capitale est la première mine européenne de salpêtre, la première carrière de gypse. Elle est aussi la principale ressource de matières organiques et le premier dépôt de métaux recyclés. Malgré le manque de ressources énergétiques – la Seine est encombrée et saturée de moulins bringuebalants, le combustible est rare et importé à grands frais de l’amont – elle porte vite le manteau industriel, d’abord biochimique, dès les années 1760, avec la fabrication en grand de poudrette, de gélatine, d’ammoniac, de boyaux. Puis vient la chimie manufacturière – production de salpêtre et raffinage des métaux précieux, fabrication des acides, de soude et de sels dérivés.
La matière première est donc importante. Vers 1785, la capitale consomme annuellement quelques tonnes de mercure et d’or, quelques dizaines de tonnes de cuivre, d’étain, d’argent et de plomb ; 25 ans plus tard, ces masses ont décuplé et s’y sont ajoutés le platine et le zinc.
2 La récupération des déchets et leurs traitements chimiques
Ces quelques chiffres indiquent la forte croissance de l’artisanat et de l’industrie parisiens à peu près contemporain de ce qu’on appelle la révolution industrielle britannique. Mais ce qui différencie le pôle parisien c’est l’usage des ressources les plus immédiates : les matières organiques délaissées pour fabriquer de l’ammoniac, des matières fécales pour en tirer la poudrette vendue aux maraîchers de banlieue afin d’augmenter les rendements agricoles, les gros os déposés en périphérie pour tirer la gélatine et les floculants phosphatés, les petits pour faire des chapelets, les ongles pour faire de la colle, le verre cassé pour faire des bouteilles. La capitale fait son maximum pour être matériellement autonome : on y récupère tout ce qui est possible, des cheveux aux clous des fers à cheval, des cretons de graisse aux cendres ; les abattoirs, les triperies et les ateliers d’équarrissage deviennent des zones artisanales de première importance. On y extrait les bases de la colle, de certains colorants, des chandelles, du papier, de la gélatine [4]. En même temps, les métaux conquièrent inexorablement la capitale et la distinguent ainsi plus souverainement des autres grandes cités : métaux précieux pour battre monnaie, dorer et argenter de leur clinquant meubles et décors de l’aristocratie qui séjourne de plus en plus longtemps dans Paris ; métaux non-ferreux pour forger les supports esthétiques des Lumières, mais aussi les contenants ordinaires du citadin, les ustensiles, les chaudrons, les gobelets, les cuillères, les pacotilles ; métaux ferreux aussi pour résister à l’usure et à l’eau, pour chauffer, pour trancher, pour transporter – fer à cheval, jante, clou, ressort – et pour décorer encore – portail, grille, balcon, serrure. Métaux, acides, bases, sels, liqueurs, métaux, la demande est très soutenue. Observons quelques produits chimiques parisiens.
3 Le salpêtre
Paris fait du nitrate de potassium un produit industriel : ses 20 salpêtriers installés à proximité des dépôts de boue hors barrières, régis par les Poudres initialement dirigées par Lavoisier, fournissent le tiers des besoins des armées et livrent encore quelques centaines de tonnes nécessaires à l’obtention de l’acide sulfurique. Le « sel de pierre » ou salpêtre est d’abord dissout dans l’eau de puits. Puis mélangé à de la cendre, il est cuit, évaporé, cristallisé et épuré pour faire la poudre ou faire réagir ses oxydes d’azote sur le soufre, l’oxygène de l’air et l’eau dans des « chambres de plomb », technique appliquée en grand à Rouen dès 1766 par l’Anglais Holker. Le salpêtre est tiré des murs calcaires qui « recèlent profondément, dans la porosité de la pierre, les miasmes dont ils sont infectés… J’ai vu des pierres ayant plus d’un pied et demi (0,5 m) atteintes de méphitisme dans toute leur épaisseur » [5] relève Cadet de Vaux en 1801. Ce méphitisme, dont le nitre est l’essence, se développe très lentement : « à l’ordinaire la nitrification prend un temps considérable pour être terminée » 1. Entre les caves et le premier étage, des nitrobacters transforment les matières azotées dispersées en surface, dissoutes, en nitrate d’ammoniaque. La moitié des quelque 30 000 maisons [6] qui s’agglomèrent derrière les barrières, est contaminée par la fermentation latente du sol. Depuis 1784, toute démolition de maison doit être signalisée pour que l’homme de confiance du salpêtrier vienne évaluer la puissance du gisement, ses caractéristiques naturelles – odeur du nitre, humidité, couleur, grain, degré de pourriture, amertume [7] – et sa cubature. Il jauge le rendement dont il pourrait tirer profit.
Dès 1775, Turgot interpelle l’Académie royale des sciences qui s’est souvent passionnée pour la question de l’origine du salpêtre [8] et lui demande de « trouver les moyens les plus prompts et les plus économiques de procurer en France une production et une récolte de salpêtre plus abondante que celle qu’on obtient présentement ». Cette année, il remplace la Ferme générale, très critiquée, par la Régie des poudres et salpêtre dont il confie la direction à deux académiciens, Lavoisier et Le Faucheux. Cet organisme public centralise et concentre la collecte et l’épuration du salpêtre. Elle rationalise et optimise les processus de production, introduit la potasse dans la fabrication, recherche de nouveaux gisements dans la banlieue parisienne et développe des nitrières artificielles. Elle accroît le nombre d’ateliers : ils sont alors 13 hors de Paris et 21 intra-muros en 1778. Elle prend les fabricants sous sa protection : « c’est l’activité, la docilité et l’instruction qui ont manqué aux salpêtriers… Persuadés qu’avec des soins, de la fermeté et des récompenses, on peut relever la récolte à Paris » 2, les régisseurs créent, en 1777, à l’Arsenal, l’École des Poudres où les jeunes fabricants suivent des cours de mathématiques, de physique et de chimie, notamment ceux de Gengembre, élève de Lavoisier qui enseigne, en 1783, à 19 ans, la mathématique mécanique et la chimie élémentaire. Ils suivent des stages à la poudrerie d’Essonnes, à la raffinerie de Paris et dans l’atelier de Lecointre à Saint-Denis qui double sa production entre 1777 et 1780 pour atteindre alors bon an mal an une centaine de tonnes.
Lavoisier joue un rôle essentiel. Il reconnaît la porosité comme facteur de croissance de la production salpêtrée. Il montre précisément que l’effet de la cendre n’est pas mécanique – dégraissage – mais chimique : elle transforme le nitrate d’ammoniac en nitrate de potasse. Il dénonce enfin la lourdeur des taxes sur les sels : si la cendre revient à dix sous la livre, pourquoi les salpêtriers ne préfèrent-ils pas la potasse « qui est un alcali presque pur qui ne vaut tout au plus que 8 ou 9 sous dans le commerce » [9] ? Ce n’est point par routine mais à cause de la gabelle, soutient Lavoisier. En effet, « le boisseau de cendre contient près de deux onces de sel marin qui passe dans la lessive et de là dans la cuite… Il est livré à l’Arsenal mêlé de salpêtre brut ou bien il en est séparé s’il y en a trop et repris par la Ferme générale sept sous la livre ou vendu en fraude au public au moins au prix de dix sous. Deux onces de sel marin représentent donc pour le salpêtrier au moins un sou, de sorte que le boisseau de cendre ne lui coûte réellement qu’un sou six deniers… Soit six sous la livre d’alcali contenu dans la cendre : il trouve donc plus d’avantages à se servir même de mauvaises cendres que de potasse. Le paiement de sept sous la livre aux salpêtriers livrant à l’Arsenal, paiement qui a pour objet d’encourager leur travail, s’oppose à l’emploi de la potasse et est un privilège exclusif de la vente du sel » [9]. Ce sel marin acheté par la Ferme ou par les Parisiens vient en somme de la lessive des terres et de l’eau puisée dans la nappe superficielle qui en contient autour de cent grammes par mètre cube.
La Régie améliore le rendement salin en écourtant le raffinage trop lent et trop coûteux. Au temps de la Ferme générale, avant l’intervention de l’Académie royale des sciences, pour produire le nitrate, la terre salpêtrée est broyée et délayée dans l’eau de puits, puis cette première « fonte » est à nouveau passée sur une autre terre avant d’être évaporée. Cette « eau de cuite » cristallise le salpêtre brut dit « de première cuite » qu’on dilue et évapore à nouveau – « seconde cuite » – pour obtenir un nitrate relativement raffiné ; une troisième cuite est souvent nécessaire pour que la pâte sente enfin le miel cuit. Les cristaux sont ensuite naturellement séchés pendant plusieurs mois – à cause du sel marin qu’il contient – avant d’être livrés à la poudrerie. On use désormais de l’aréomètre de Baumé, alors tout nouvel instrument de mesure, pour mieux jauger les concentrations et éviter les dilutions retardatrices. Elle force la demande – d’où un règlement des démolitions dans Paris – en faisant doubler, voire tripler, les volumes de terre à lessiver et en multipliant le nombre de tonneaux de fonte. Elle réduit le temps d’évaporation. Elle purifie mieux en extrayant les sels indésirables – marin, potassique, métalliques – revendus aux fabricants de sorbets pour maintenir la glace et, mélangés à la chaux, aux chimistes pour faire du sulfate d’ammoniac. Elle normalise le produit en refusant le salpêtre « agglutiné » et en l’éprouvant en laboratoire d’essais [10], à l’instar de ce qui se fait alors dans le Génie pour les matériaux et l’Artillerie pour les canons. La production parisienne dépasse les 500 tonnes annuelles et assure l’autonomie de poudre.
4 De grandes écoles de chimie
L’école parisienne de chimie n’est pas seulement académique, elle s’applique aussi profondément aux arts et à l’industrie. Contemporaine des premières écoles d’ingénieurs – Génie de Mézière (1748) et Bureau des dessinateurs (1747) puis Ponts et Chaussées (1775) – elle débute vers 1760 grâce à Macquer qui s’associe à Baumé pour former un établissement de pharmacie dans le quartier des Lombards, au cœur de la dorure et de l’argenture sur cuivre ou bronze – à base d’amalgame d’or ou d’argent passé à chaud – en face de l’église Saint-Leu, où ils établissent une salle de « chimie et de pharmacie expérimentale et raisonnée » pour faire des cours les lundi, mardi, jeudi, vendredi à quatre heures de l’après-midi [11]. Trois ans plus tard, l’établissement, trop exigu, déménage rue Coquillière, à portée de la chapellerie qui consomme alors près de six tonnes de nitrate de mercure pour feutrer les poils : pharmacie, droguerie et fabrique de produits chimiques constituent six laboratoires, « superbes et vastes ». « La manipulation se fait en grand. L’acétate de plomb ou céruse, le muriate d’étain, les sels mercuriels pour le feutrage des poils de chapeau, les combinaisons ammoniacales s’y préparent par quintaux ; une immense galère est destinée à rectifier l’éther » [12]. Ici, les « amateurs de la chimie qui veulent se former un cabinet des produits d’un cours de cette science » peuvent pratiquer « une suite complète des opérations de choix d’un cours de chimie » [13] dispensé par Baumé aidé de son garçon apothicaire futur lampiste, Quinquet, puis Fourcroy à partir de 1784.
À cette école d’application du phlogistique s’ajoute celle qu’établit Lavoisier à l’Arsenal en 1785, financée par les fonds de la Régie des poudres et salpêtre. On y détermine le rôle de la respiration et de la transpiration, la puissance du feu, la nomenclature chimique. Y œuvrent, autour du maître, Fourcroy, Seguin, Guyton de Morveau, Berthollet, Laplace ; y concourent les Annales de chimie qui diffusent, dès 1789, les découvertes et les nouveaux moyens de production [14].
Fourcroy est le pédagogue d’une autre école d’application : la manufacture-école que ce dernier établit avec Vauquelin, en 1798–99, rue du Colombier dans le faubourg Saint-Germain, creuset de la pharmacie artisanale et de la chimie industrielle parisienne – on y prépare « l’huile d’amandes douces, le Thériaque, l’eau de mélisse, la distillation et rectification de l’alcool, l’émitaque, les boules de Mars, le kermès, la pierre infernale, l’ammoniac, le phosphore » [15]. Sous la tutelle des deux savants auxquels se joignent Deyeux et Lemercier, comme démonstrateur, les futurs entrepreneurs pratiquent la fabrication en grand d’acides, de soude, de bleu de Prusse, d’alun, de couperose, des chlorates et de phosphates. Fourcroy y parle de chimie pharmaceutique, Deyeux conseille sur les appareils et la salubrité des locaux. La vente des produits manufacturés assure le maintien de l’enseignement, des appareils et des locaux. L’école dispose d’un four à réverbère doté d’une cheminée dominant les toits voisins de plus de douze mètres. On y fabrique d’abord de la soude, de l’eau de Javel et du phosphore. Puis, après les plaintes réitérées des riverains contre l’insalubrité et les risques très forts d’incendie, en 1810 et 1813 3, on n’y « fait plus que des opérations sans vapeur », chlorure d’étain et produits pharmaceutiques. Aux yeux du Conseil de salubrité de la Seine, elle « mérite protection » 4 du prince. Cet atelier-école s’arrête à la Restauration ; il est racheté par Lemercier qui en fait une distillerie très polluante de produits chimiques 5.
La chimie est alors enseignée et pratiquée dans les grandes écoles de médecine et de pharmacie, à Polytechnique avec Fourcroy, aux Mines avec Hassenfratz, aux Ponts et Chaussées où cherchent Gay-Lussac et Biot. À la Restauration, elle fleurit au Conservatoire des Arts et Métiers avec Clément-Desormes puis Payen, à l’École centrale des Arts et Manufactures avec Dumas.
5 La chimie de laboratoire
La pharmacie, considérée dans ses rapports immédiats avec nos besoins réels, est une profession dont l’utilité est marquée dans toutes ses parties : c’est dans son sein qu’est née la chimie, science qui influe si puissamment sur les succès de la médecine pratique, indépendamment des secours journaliers qu’elle procure aux manufactures, aux arts et aux métiers – c’est chez le pharmacien instruit que les fabricants et les ouvriers en tout genre viennent apprendre à connaître, d’une manière sure, la nature des différentes matières qu’ils emploient et sur lesquelles ils sont malheureusement que trop souvent trompés… Paris est la seule ville de l’Empire qui offre aux étudiants en pharmacie tous les moyens d’instruction : c’est dans son collège que les pharmaciens « éclairés des provinces sont venus et viennent encore tous les jours se perfectionner dans leur état [16] » déclarent les membres de la Société de pharmacie en 1790.
Pour les Encyclopédistes, le pharmacien « extrait des corps leurs principes vraiment utiles et rejettent leurs parties inutiles ou nuisibles ». Précisément, il incarne le technicien, cet homme nouveau qui sait rationaliser son savoir grâce aux sciences qui « ont su, à l’aide de l’observation et de l’expérience, porter la lumière dans l’atelier de l’artisan pour diriger plus sûrement ses travaux [1] ».
Cent seize à Paris 1803, 136 en 1809, 161 en 1816, 204 en 1823, les pharmaciens jouent un rôle essentiel dans l’essor de la petite et moyenne industrie et dans la diffusion des produits industriels auprès des artisans. Ils sont deux fois plus nombreux sur la rive droite [17] ; un tiers occupe les rues des Lombards, Saint-Martin et Saint-Denis, les quartiers du Temple et de Sainte-Avoy, la zone artisanale la plus populeuse et la plus chimiques avec ses doreurs, chapeliers, bains de mercure, etc. Leurs compétences couvrent le champ biologique et le champ chimique, des infimes particules du médicament aux produits de consommation courante – chandelle, huile, pommade, médicaments.
Le pharmacien est un métier de proximité, mais aussi d’échelle capitale ; un métier qui travaille à la fois dans l’organique et l’inorganique – il joue un rôle dans la récolte et la rentabilisation du salpêtre, notamment au temps fort de la Révolution. Son officine est un point chaud urbain où se montrent et se démontrent les innovations, les appareils, où s’apprennent les gestes d’application, les dosages, où se sentent les odeurs nouvelles, où se parlent des mots étranges ou savants et d’où l’on sort soulagé.
6 Les premières grandes fabriques d’acide
La fabrique d’acide s’installe au cœur de la capitale parce que le milieu artisanal demande des quantités de plus en plus grandes, notamment à Paris pour dorer les métaux qui font sa réputation dans les arts appliqués, pour feutrer les poils des chapeaux de feutre et en faire le premier producteur européen, pour blanchir le linge ; parce qu’il y faut une main d’œuvre abondante et moins soumise aux pressions religieuses qui voient dans cette fabrique les griffes du mal ; parce que la rareté des infrastructures et des moyens de transport ficelle cette manufacture à des clients immédiats. Les acides fournissent les clés pour générer la soude, carbonate de sodium – indispensable à la fabrication du verre – que Nicolas Leblanc réussit à fabriquer en grand à Saint-Denis en 1789, à partir du sel de mer. Archétype du produit chimique de masse avec l’hypochlorite de soude que Berthollet fabrique dans le faubourg de Javel dans les années 1780 ; pour donner, par les combinaisons métalliques, de nouveaux sels – notamment l’alun artificiel et la couperose, mais aussi les chlorate et chlorure de chaux. Ils décapent et, de fait, servent à l’application des amalgames et des soudures.
L’acide se fabrique avec un savoir-faire savant longtemps dévolu aux pharmaciens. Cet « esprit » prend de la notoriété dans les années 1775–80 avec les fondateurs de la chimie minérale, Priestley, Bergmann et d’abord Lavoisier, le chef de file de l’école chimiste française. En dehors des apothicaireries et des pharmacies qui manipulent de très petites quantités d’acide, une huitaine de manufactures, toutes nouvelles, élaborent en grand ce produit nouveau et ses dérivés sulfatés, en 1804–1805 :
- • Lacoste, pharmacien, installé depuis 1794, rue Thévenot où il distille de l’eau-forte pour produire de l’acide nitrique. En 1806, il demande à transférer son atelier, rue Neuve-Saint-Martin dans un local plus spacieux et plus commode d’accès 6 ;
- • Payen, avocat, implanté à Grenelle, dans un ancien rendez-vous de chasse du Prince de Conty, depuis 1794, produit de l’acide sulfurique pour faire du sulfate d’ammoniac ; la manufacture est au bord de la Seine, au milieu d’un vaste terrain dégagé, accessible par terre et par eau, relativement isolé ;
- • Carré travaille depuis 1799 place des Invalides, côté Gros Cailloux. Il est isolé, entouré de jardins et produit de l’eau de Javel. Le conseil de Salubrité estime que cette fabrication « ne peut qu’augmenter la salubrité de l’air » 7 ;
- • À Neuilly, aux Ternes, en 1798, dans un quartier quasiment désert, Chaptal ouvre sa seconde fabrique [18] ;
- • cette même année, Vauquelin et Fourcroy créent leur école pratique de chimie, rue du Colombier et y élaborent les produits nécessaires aux démonstrations. Ils en tirent quelques bénéfices pécuniaires 8 ;
- • Gouin, installé rue de Bossuet dans le cloître Notre-Dame, fabrique en petit de l’acide pour sa teinturerie 9 ;
- • Dame Favreau fabrique de l’acide depuis 1801, rue de Montmorency, dans des conditions précaires et dangereuses 10 ;
- • Gauthier, qui possède déjà depuis le tout début du siècle une fabrique d’acides, quai de La Gare, après l’hôpital de la Salpêtrière, s’établit encore en 1806, rue du Port à Saint-Denis dans l’ancienne manufacture de Leblanc. Associé à Chaptal et Charrera, il confie la direction à d’Arcet pour produire de la soude commerciale destinée aux manufactures de glaces et aux savonneries 11, puis déménage en 1809 au clos La Folie à Nanterre, « éloigné d’une demie lieue de toute habitation » ; ce qui n’empêche pas la plainte immédiate des paysans des alentours 12. Ces fabriques ressemblent à des laboratoires qui, pour produire plus, répètent les mêmes gestes, additionnent des appareils identiques – cuines, fourneaux, marmites, galères. Elles sont foncièrement très fragiles : les plus anciennes disparaissent dans la tourmente révolutionnaire. Des huit décrites en 1804, la moitié survit cinq ans plus tard :
- ∘ la première est celle de Chaptal, d’Arcet et Gauthier à La Folie, qualifié d’« endroit idéal » ;
- ∘ la seconde, celle des frères Pluvinet, pharmaciens en gros de la rue des Lombards, adossée à la montagne de Belleville, dans une ancienne carrière de gypse destinée à l’Amérique, « une des plus belles et des mieux conduites de la France », dispose d’un seul fourneau pour décomposer le sel marin ;
- • Marc et Costel, près de Montfaucon, qui ne prennent aucunes précautions « pour coërcer les vapeurs qui s’élèvent parfois jusqu’à Belleville et Pantin » ;
- • Payen qui « refuse de présenter ses appareils mais dont l’usine ne dégage aucune odeur » 13 – il l’a très probablement arrêtée pour la présentation ;
- • Courcillon, frères et Gérard, dans un lieu isolé de la plaine de Billancourt, qui lave alors les fumées en les « passant dans des caisses en plomb remplies d’eau aux deux tiers » 14 ; deux à trois tonnes de soude produites quotidiennement 15 ;
- • Destouche, récemment établi à Carrières-sous-Charenton, qui utilise l’appareil de Wolff pour réduire les fumées 16 ;
- • Gessard, pharmacien, installé rue de Paris à Saint-Denis depuis 1800, qui fabrique du carbonate d’ammoniaque [19].
7 L’industrialisation des fabriques chimiques
En 1815, le royaume restauré consomme 600 tonnes de salpêtre pour produire 12 000 tonnes d’acide sulfurique [20]. La demande reste très soutenue et les matières premières abondent. La capacité des chambres de plomb ne cesse d’augmenter par besoin de rentabilité : au milieu des années 1820, le département de la Seine consomme 1000 tonnes de soufre et 100 de nitrate de potasse pour élaborer ce précieux acide. « Ce sont en effet de grands vaisseaux de forme rectangulaire [une centaine de mètres cubes] dont le fond est porté sur des dalles en pierre qui le soutiennent à six pieds au-dessus du sol et dont les côtés et le toit, isolés de toutes parts et soutenus par une charpente extérieure, se trouve à six pieds du mur des bâtiments d’enceinte ainsi que de son toit. Les lames de plomb qui les composent sont soigneusement soudées entre elles, et dès qu’une fuite se manifeste, l’isolement de l’appareil permet d’y porter remède » [21], décrit Jean-Baptiste Dumas en 1828.
Anselme Payen abaisse le coût de production en utilisant, en 1818, des déchets de raffinerie – résidus de mélasse, fécule – mélangés à de l’acide nitrique. En même temps que Cartier à Pontoise, il améliore encore le procédé en 1827 : l’acide est obtenu dans trois chambres successives selon le modèle de la fabrication du salpêtre [22]. Gay-Lussac enfin accroît le rendement et la pureté, grâce à sa tour qui fixe les oxydes d’azote. À la fin de la Restauration, les huit établissements séquanais emploient 80 ouvriers pour produire 3000 tonnes d’acide sulfurique livré à 30 centimes le kilo [23], prix et qualité [24] moyens. Au total, un million de francs.
Mais l’industrialisation ne touche pas que les acides, elle vise aussi le sulfate d’ammoniac qui tire parti de ce que nous désignons par ordures ménagères, et le bleu de Prusse, colorant obtenu savamment à partir du sang de bœuf (Fig. 1).

(1) Installation pour extraire le bleu de Prusse. Ms extrait du Rapport no 41 du 21 février 1812 du Conseil de Salubrité de la Seine (Archives de la Préfecture de Police, Paris), à « Instruction relative aux manufactures de bleu de Prusse ». (2) Calcination, appareil de distillation : à « appareil pneumato-chimique qui passe les vapeurs dans l’eau et les conduits dans un foyer particulier pour achever de les détruire … et recueille du carbonate d’ammoniaque qui a valeur dans le commerce ». (3) Fixation. Appareil utilisé par Bronstrom rue Saint-Nicolas, faubourg Saint-Martin. Le gaz s’échappe du tonneau de droite, est recueilli dans le second tonneau, qui dispose d’une sécurité (un bout de tuyau), lavé, puis conduit dans un foyer qui le brûle (à gauche). On note l’extrême précarité de la fabrique de bleu de Prusse : tonneaux, tuyaux. Ce dessin est très probablement de la main de Parmentier, principal signataire de l’instruction.
8 Sulfate d’ammoniac
« Il n’y a pas de drogue plus commune que le sel ammoniac » [25]. L’« alcali volatil » est très recherché des apothicaires comme remède contre les passions – mais son odeur et sa saveur sont plutôt répugnantes – et surtout des étameurs pour décaper le fer et le cuivre avant leur trempage dans l’étain fondu 17. Les chimistes l’obtiennent en mélangeant une partie de sel commun à cinq d’urine et une demie de suie ; les ferblantiers par fermentation lente d’urine mélangée à de la chaux puis évaporation. De qualité très variable, la production demeure discrète, jusqu’aux années 1760.
Mais les citadins veulent de plus en plus de brillant : la demande ferblantière croît. Les étameurs pressés réclament le sulfate que les chimistes cherchent à produire en grand et ce d’autant plus qu’il sert aussi à la fabrication de l’acide nitrique. « L’urine n’est pas la seule matière animale qui en puisse fournir, les os, les ongles, les cornes, les poils, le sang même en fournissent aussi. Toutes ces matières donnent à la distillation un sel volatil urineux. Tel est par exemple le sel de vipère si usité en médecine » [26].
Baumé, associé à Macquer, obtient en 1766 ou 1767 le privilège de fonder à Gravelle près de Charenton une grande fabrique de sel. On y décompose du carbonate d’ammonium, provenant de la dégradation de matières organiques azotées – vieux chiffons, loques, déchets de cuir – par les chlorures de magnésium et de calcium, résidus provenant des eaux-mères des salpêtrières, en présence de chaux. Cette boue de récupération est décantée, filtrée, cristallisée et purifiée par sublimation. On en extrait de l’huile empyreumatique, « une huile d’autant plus colorée et d’autant plus épaisse que la décomposition est plus avancée [27] » qui, épurée donne l’huile de Dippel recommandée contre l’épilepsie. L’affaire marche cinq ou six ans, puis périclite [28]. Dizé prend le relais et distille à Saint-Denis, vers 1788, des matières animales avec de l’acide chlorhydrique et du gypse dont les faubourgs nord sont la principale carrière ; sa fabrication arrêtée en 1790 est reprise par Pluvinet.
La demande d’eau forte, l’offre d’acide sulfurique promeuvent un nouveau procédé plus industriel, para-chimique. Le sulfate peut s’obtenir en grand à l’aide de matières animales en décomposition trempées et malaxées avec de l’acide sulfurique étendu ; l’ensemble est distillé dans de grandes chaudières en fonte. L’odeur qui s’y dégage est infecte et porte loin. Mais la plus-value l’emporte car cette fabrique devient une annexe, un complément qui contribue à absorber les surplus d’acide sulfurique et surtout le produit défectueux, trop mauvais pour faire la soude.
Dans les années 1790, les os corrompus, les ordures ménagères, mêlées aux restes de soupe sont peu à peu extirpés des dépotoirs au coin des rues et à l’issue des impasses par les chiffonniers qui les vendent aux manufactures d’acide, dont les principales, symétriques, extra-muros, sont celle de Payen, dressée au bord de la Seine, près de Javel, à Vaugirard, depuis 1795, et celle de Pluvinet, ami de Lavoisier, commissaire aux poudres pour la Normandie et le Nord pendant la Révolution à Clichy, implantée rue du Malte depuis 1800.
La matière première ne manque pas : les chimistes payent trois francs le millier d’os au chiffonnier 18, dix à quinze francs le quintal de viande plus ou moins pourrie ou séchée [29], six francs la voie de débris de peau tannée. On peut « obtenir par quintal dix neuf kilos de sulfate d’ammoniac », soutient d’Arcet qui propose ainsi aux corroyeurs qui détruisent les débris pour se chauffer de les brûler en vase clos ou de les vendre « environ le double de l’os » 19. La récupération d’une partie des ordures ménagères arrange bien les édiles. « La collection de ces matières occupe un très grand nombre de personnes qui n’ont pas d’autres moyens d’exister », rappelle Deyeux en 1811, pour soutenir Payen contre les dénonciations des riverains d’Auteuil exaspérés par les vapeurs d’huile empyreumatique que dégagent la fabrique 20. « Avant les ossements des animaux encombraient de tous côtés les abords de Paris… La fabrique de Pluvinet a contribué fortement à produire ce changement si avantageux à l’agrément des environs de la capitale, à la salubrité de l’air et à l’intérêt général », soutient un autre conseiller de Salubrité en 1825 21.
La Restauration confirme le déploiement ammoniacal. Robin essaie de créer, sans autorisation, un troisième pôle, rue du Banquier, au milieu de jardiniers fleuristes. Pendant presqu’un an, quotidiennement, « il distille des matières animales de l’espèce de celles que les chiffonniers ramassent dans les rues » pour faire du sulfate, de l’alun et des produits chimiques, « bravant toutes les menaces des voisins » 22. Le préfet de Police a, finalement, raison de lui 23 ; il disparaît.
Dès l’installation du gaz pour l’éclairage, en 1815, on récupère le sel ammoniac provenant des eaux de lavage des usines. Une nouvelle mine, salutaire, car la production de noir animal devient concurrente.
9 Bleu de Prusse
Le bleu de Prusse ou de Berlin est un produit tinctorial qui est de plus en plus consommé dans les dernières années du XVIIIe siècle par la peinture à l’huile, l’azurage 24 et l’impression des papiers, voire des toiles. De quelques milliers de francs en 1805, sa production séquanaise atteint plusieurs centaines de milliers à la fin de la Restauration. Un vrai produit chimique, un bleu qui fait rougir de plaisirs le chimiste ou le pharmacien.
Découvert à Berlin en 1710 par Diesbach, fabricant de couleurs, et Dippel, pharmacien. Le procédé de fabrication, publié dans les Philosophical Transactions par Woodward en 1724, mélange chimie minérale et décomposition organique. L’Allemagne ne tarde pas à en devenir le premier producteur. Cinquante ans plus tard, Baumé le produit dans sa grande fabrique, en face de l’église Saint-Leu, à partir du sulfate et du nitrate d’ammoniaque et le vend cinq livres la livre pesante 25 Mais « la beauté et l’éclat extraordinaires du bleu de Prusse font tenter une foule de moyens pour le fixer d’une manière égale et permanente dans la peinture » [30] Macquer propose deux méthodes, sans succès, Proust s’y met aussi [31]. Menon, Le Pileur d’Apligny, Roland de La Platière, ces grands teinturiers, s’y essayent en vain. Berthollet réussit à l’appliquer à la teinture des toiles non lavables, à la manufacture de Jouy ; Bancroft l’applique à l’impression des calicots en 1802.
Le sang des abattoirs, et d’abord celui de bœuf, sert, mêlé au mortier de chaux grasse, à imperméabiliser les surfaces planes – les aires de battage, la base des murs 26. Mais la plupart du temps, il est abandonné aux animaux errants et à la vermine. Vers 1760–1770, on commence à l’employer pour raffiner le sucre de canne. Dorénavant, ce résidu de boucherie, mélangé à la corne, aux restes de peaux, de poils et de muscles, sert de « matière première urbaine » [32] pour l’obtention de ce ferrocyanure ferrique. De quoi révéler les potentialités parisiennes puisque la capitale est le premier producteur de sang. Elle livre quotidiennement, dans les années 1810, près de 5000 litres. Celui-ci est cuit, puis séché deux jours durant en l’étendant par couches minces sur une aire damée, opération qui attire beaucoup les mouches. Le prix de vente du produit sec tourne autour de deux francs cinquante l’hectolitre. Le bleu « contribue au nettoyage et à l’assainissement des abattoirs et des égouts et à l’abaissement des prix de la viande » 27.
La production du premier colorant de synthèse est une affaire chimique, voire pharmaceutique, et nécessite rigueur, patience et clairvoyance. Elle comprend deux opérations délicates et très polluantes : la calcination et la fixation :
- • pendant une douzaine d’heures, on calcine dans un creuset de terre ou de fonte parties égales de sang desséché « et même un peu grillé en hiver » 28, de tendons, de rognures de corne, et de trois fois ce poids de carbonate de potasse du commerce. Les plus riches chimistes utilisent un four à réverbère, les plus modestes le font en plein air. Il se dégage des oxydes de carbone et de l’huile empyreumatique, du carbonate d’ammoniac, extrêmement malodorant. Au bout de quatre heures, on retire du feu et on laisse refroidir le creuset ; il contient alors du cyanure de potasse ;
- • la fixation. Le mélange est délayé dans de l’eau. Le résidu solide, un charbon phosphoré, est d’abord jeté, puis dans les années 1810, récupéré car il jouit de la propriété décolorante « à un degré que le charbon d’os ne peut jamais atteindre », selon Dumas 29. On agite et on filtre au bout d’une demi-heure le soluté… « On y verse un excès de dissolution aqueuse formée de deux à quatre parties d’alun et d’une partie de sulfate de fer du commerce… Il se dégage une grande quantité d’hydrogène sulfureux et il se forme un précipité brun noirâtre, dans lequel on trouve, outre le bleu de Prusse pur, de l’alumine et une petite quantité de sulfate de fer qui lui donne la couleur noire. On décante le précipité et on le lave à plusieurs reprises ; bientôt il passe du noir au brun verdâtre, au brun bleuâtre, et au bout de vingt à vingt-cinq jours au bleu : alors on le rassemble sur une toile et on le fait sécher » [33]. D’autres versent le concentré « dans des baquets où le sel se cristallise autour de cerceaux de bois ou de ficelles » 30. On le comprime légèrement et on le divise en petits pains qu’on laisse encore sécher à l’ombre. Mais « une foule de petits détails de manutentions dont beaucoup échappe au visiteurs… constituent le secret de fabrication » 31.
Napoléon trouve ce bleu à son goût et voudrait en faire le fond de sa couleur, d’autant plus que le pays est tributaire de l’étranger pour l’indigo : on en importe des colonies pour près de dix millions de francs avant 1802, pour six ou sept en 1806, alors qu’on en consomme pour dix huit millions [34], l’essentiel tiré du pastel traité à l’acide chlorhydrique. Chaptal, ministre, veut promouvoir ce sel et le nationaliser, fût-il fort cher [35].
Dès 1802, la Société d’Encouragement lance un prix de six cents francs pour la meilleure fabrique. Sa section de chimie se procure alors les « bleus de Prusse les plus parfaits qui se fabriquent dans l’étranger pour étalonner » [36]. La préparation délicate, dosée, exige en effet des connaissances chimiques de haut niveau. L’école pratique de chimie de Vauquelin où enseignent aussi Thénard et Deyeux fait référence. Les chimistes qui survivent à la crise de la couperose et les jeunes entrepreneurs s’y forment et installent des fabriques. Sept œuvrent dans le département séquanais en 1807, certains depuis 1803 comme Gohin, chimiste du faubourg Saint-Martin, qui a maille à partir avec ses voisins pour la pollution engendrée par sa fabrique, mais qui obtient la médaille de la Société d’encouragement en 1805. Son bleu réussi lui permet de faire, grâce aux vernis qu’il fabrique aussi depuis cette année, rue de La Chapelle 32, de magnifiques courroies et harnais pour la cavalerie de parade, impériale et toute parisienne. Tamisier, lui, s’installe petite rue Saint-Nicolas, division de Bondy, utilise les mêmes appareils que le Suédois Brostrom 33, mais refuse de les enfermer 34 ; sa fabrique périclite et fait faillite en 1810 35. Léro et Bayard se sont installés vers 1805, rue Saint-Nicolas, le second émigre rue Popincourt. Chastel s’associe à un amidonnier qui occupe une maison, rue des Bourguignons, « peu fréquentée, entourée de jardins », où il applique les nouvelles normes, puis déménage rue Poliveau en 1808 et disparaît 36. Le pharmacien Destouches a son laboratoire à Carrière-sous-Charenton et une annexe à Montfaucon pour brûler les matières animales 37.
Voici une des plus performantes, celle de Brostrom, ami du chimiste suédois Bergmann, sise, depuis 1803, 37, rue Saint-Nicolas dans le faubourg Saint-Martin, dont le voisinage se plaint par pétitions depuis son installation [33]. Vauquelin, Thénard, chimistes, Deyeux et Cadet, pharmaciens, qui ont visité les lieux à la demande expresse du préfet de Police, préconisent de couvrir les chaudières par une hotte en céramique et de rehausser de quelques mètres la cheminée. Les plaintes cessent et le Conseil de Salubrité demande au préfet d’obliger tous les fabricants de bleu de Prusse à faire de même (Fig. 2).
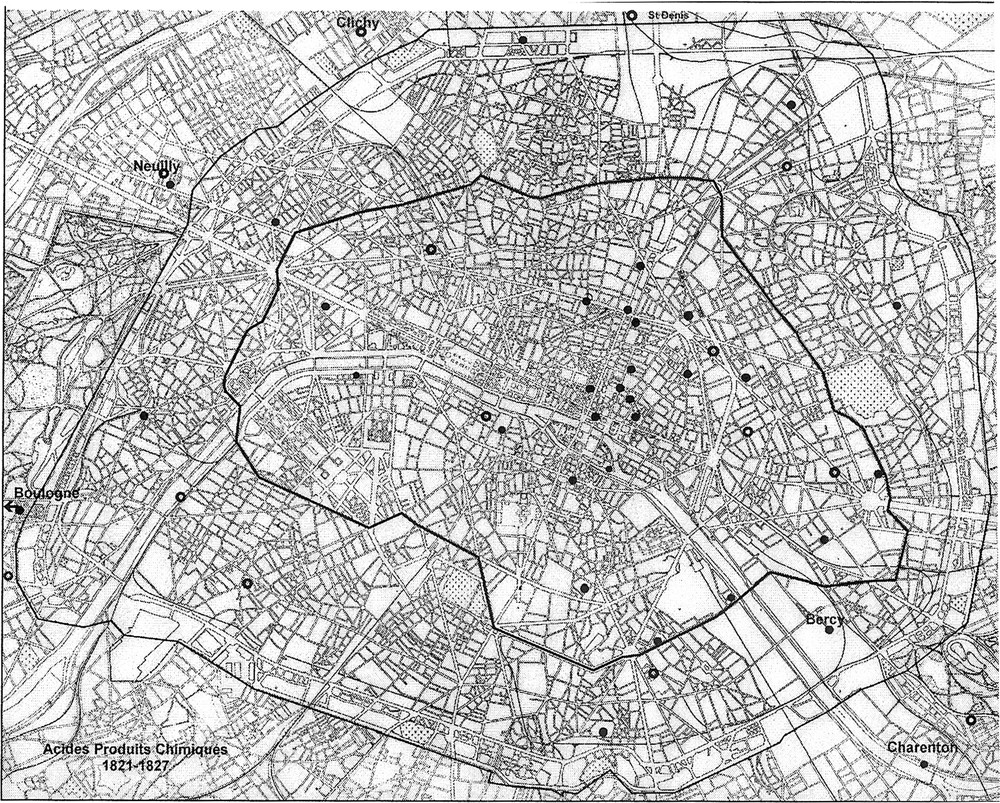
Répartition des principales fabriques d’acide et de produits chimiques en 1823–27.
En 1811, ce prussiate de potasse devient grâce au chimiste lyonnais le « bleu Raymond » ou « bleu Marie-Louise », clair, pour la soie, le fil et le coton [37] : on imprime sur le tissu un mélange pâteux d’acides oxalique et tartrique et de bleu de Prusse, qu’on fait sécher puis que l’on soumet à la vapeur. L’ammoniac fonce la couleur [38]. Pour le « bleu de France » des étendards et des drapeaux, pour les soirées bleues étoilées des fastes déclinants. Plusieurs modestes artisans, accointés aux bouchers, profitent de l’aubaine pour tirer parti du sang sec. Ils s’installent donc aux marges de la ville, notamment autour de l’équarrissage de Montfaucon et à La Gare, pour répondre à la demande croissante et fournir les chimistes qui, alors, ne font guère que « ce qu’on appelle les bleus de pâte, qui se vendent humides » [39].
À la demande du préfet de Police, le Conseil de salubrité réalise, en 1812, une enquête relative aux différents moyens utilisés pour réduire les nuisances 38. D’Arcet propose de calciner dans un appareil distillatoire et fixer le bleu dans une cuve fermée et branchée à un appareil fumivore [40] qui conduit l’autorité de Police à publier une instruction « relative aux fabricants de Bleu de Prusse » 39 rédigée par le ministre du Commerce, « dans l’intérêt des fabricants » 40. Elle est publiée le 17 septembre 1813 et contribue largement à réduire la pollution par le carbonate d’ammoniac et l’acide sulfureux. Léro transfère, sa fabrique de la rue Saint-Nicolas à celle d’Aligre, dans un site plus aéré et conforme à l’instruction préfectorale : son bleu est bien plus beau et ne pollue pas l’atmosphère 41.
Une demi-douzaine d’années encore et l’on voit enfin des cristaux élaborés rue Saint-Denis, semblables aux plus beaux que l’on tire d’Allemagne et d’Angleterre [41]. La production de prussiate de potasse rebondit pour servir la laine grâce à Raymond fils qui réussit en 1819 la teinte en trois bains : un de rouille pour mordancer, un de cyanate de potasse et un de peroxyde de fer [42]. « Ce procédé de teinture est moins simple que celui où l’on emploie l’indigo : mais si l’on songe aux soins constants et minutieux qu’exige l’entretien d’une cuve au pastel, aux fréquentes maladies auxquelles elle est sujette, et qui déroutent souvent les teinturiers les plus habiles ; si, d’un autre côté, on veut tenir compte du bas prix du bleu de Prusse ; si on a égard à la grande beauté des nuances claires que l’on peut en tirer et dont l’indigo ne saurait approcher », on verra « un jour le bleu de Prusse remplacer entièrement l’indigo dans nos factures de draps [41] ».
Le prix du sang de bœuf triple entre 1820 et 1826, allant jusqu’à huit francs l’hectolitre, sérum particulièrement recherché pour purifier, avec de l’eau de chaux, le sucre brut [43] des raffineries. Rien qu’à Paris, celles-ci consomment autour de onze mille tonnes annuellement, payée cinquante cinq francs l’unité [44].
De nouveaux procédés de production du bleu de Prusse apparaissent en 1822 : l’un, à Montreuil, emploie le sulfate de fer mélangé à l’alun dans une solution de prussiate de potasse 42. Il se forme alors un précipité verdâtre qu’on agite et qui bleuit ; le précipité, lavé, pressé et séché est enveloppé pour être vendu. L’autre, à Vaugirard, mélange l’alumine à un hydrocyanate ferruré de potasse soluble qui donne un bleu en pâte prisé des coloristes et des peintres, et, avec de l’amidon, un bleu pâle [44]. Chevreul parvient en 1825 à obtenir un dégradé complet du bleu de Prusse en employant différents bains dosés d’acétate ou de chlorate ou de sulfate qui trempent préalablement le tissu [45].
Pour les raffineries, le sang de bœuf devient moins utile, vers 1827. À l’initiative des frères Derosne, les raffineurs lui préfèrent l’alcool à 32° qu’ils mélangent à la pâte ; le sucre est séché au bain-marie tandis qu’on récupère l’alcool en distillant la mélasse. Ils économisent ainsi du combustible, de la main d’œuvre, du temps et réduisent encore les odeurs nauséabondes [46]. Le sang de bœuf voit cependant son prix grimper subitement à la fin de la Restauration. « Il est reconnu si utile à la végétation des cannes à sucre, que depuis peu on l’expédie de Paris avec une valeur de 20 fr les 100 kg aux colonies, où il arrive coûtant 40 fr. Ce prix élevé n’a pas empêché une spéculation de se fonder sur cette base » [44]. Trois cents tonnes sont séchées pour les colonies 43.
10 Conclusion
Par son marché, par l’aisance de ses rentiers, par sa puissance nobiliaire, Paris fait changer l’échelle de la chimie, du laboratoire. Produits acides, bases, sels, liqueurs, métaux, la chimie, science nouvelle, fait du minéral un règne urbain et surtout économique ; elle offre ses acides et ses bases, toujours délicats à manipuler. Les pharmacies deviennent les lieux de démonstration et de mémorisation des nouveaux produits. L’acide sulfurique obtenu dans des conditions calamiteuses pour l’environnement engendre une multitude de nouveaux procédés et de nouveaux produits. La manufacture sort de terre d’abord dans le cœur de la capitale, là où la demande est constante et soutenue, près des mines d’or et d’argent, près des élites consommatrices de potions. Puis sa toxicité et sa gourmandise spatiale la portent en périphérie, à l’écart des consommateurs. Cette chimie y devient industrielle parce que la demande – artisanale et étatique – est forte, mais aussi parce que la matière première – salpêtre, os, sang, phosphate, gypse – est à portée de main. Les manipulations sont faites en très grand avec beaucoup de dextérité, de talent, de dosage et d’instrumentation. Cette chimie imposante, rationnelle, permet à l’artisanat de se déployer, d’écourter le temps de sa production, d’uniformiser ses produits semi-finis. Cette chimie fait la révolution industrielle française.
1 Instruction pour rectifier les principes ainsi que les procédés de l’art du salpêtrier et de les mettre au niveau du progrès actuels de la chimie, Ms Service Historique de la Défense, 4g3/2 (1820).
2 État des fournitures des salpêtriers… 1774–1780. Service Historique de la Défense, 4g1/4.
3 Archives de la Préfecture de Police, Compte rendu des rapports du Conseil ce Salubrité de la Seine, Rapports no 4 du 3 février 1810, no 228 du 20 septembre 1813 et no 255 du 21 octobre 1813. Noté dorénavant « Rapport no ».
4 Rapport no 232 du 27 septembre 1813.
5 Rapport no 274 du 30 octobre 1818.
6 Rapport no 11 du 5 août 1806.
7 Rapport no 2 du 6 avril 1806.
8 Rapport no 4 du 3 février 1810.
9 Rapport no 113 du 21 mars 1809.
10 Rapport no 121 du 12 mai 1809.
11 Rapport no 31 du 26 août 1807.
12 Rapport no 23 du 12 mai 1810.
13 Rapport no 74 du 28 octobre 1810.
14 Rapport no 74 du 28 octobre 1810.
15 Rapport no 49 du 8 août 1810.
16 Rapport no 16 du 3 mars 1810.
17 Il faut en moyenne 140 g d’étain par mètre carré à recouvrir.
18 « Avant les os… ne valaient à Paris que 3 f. les mille ». Rapport no 25 du 20 janvier 1825.
19 Rapport no 52 du 12 mars 1818.
20 Rapport no 150 du 13 mai 1811.
21 Rapport no 25 du 20 janvier 1825.
22 « À peine entré dans l’endroit où se faisait la distillation, je me suis senti tellement suffoqué par l’odeur qui s’exhalait des appareils, que si je ne m’étais pas hâté de sortir pour respirer de l’air frais, j’aurais été asphyxié. », précise d’Arcet. Rapport no 206 du 28 octobre 1815.
23 En 1815, sa fabrique fait l’objet de 4 rapports du Conseil de salubrité, no 86, 182, 194, 206.
24 Du moins pour le papier français avant l’introduction des chiffons non macérés, soit 1827, Mérimée, « Instruction sur le collage du papier à la cuve », Bulletin de la Société d’Encouragement pour l’Industrie Nationale, 26, 1827, p. 118–121 et 255–258. En Hollande et en Grande-Bretagne, on utilise le bleu de cobalt qui produit une teinte plus brillante et plus durable car l’alcali du savon utilisé dans la voie sèche décompose le bleu de Prusse.
25 Baumé, Prix courants des préparations de chimie…, Op. cit., « bleu de Prusse.
26 Une part de sang séché mélangée à une part de chaux, une de cendre et trois de brique ou tuile pilée.
27 Rapport no 169 du 18 septembre 1824.
28 Rapport no 42 du 28 mars 1823.
29 Dumas, Chimie appliquée, Op. cit., I, p. 451.
30 Rapport no 42 du 28 mars 1823 pour la fabrique aux Quatre Chemins.
31 Rapport 43 du 15 mars 1823 relatif à la fabrique de Vincent, Rue Blomet.
32 Rapport no 188 du 10 septembre 1811.
33 Rapport no 82 du 5 octobre 1808.
34 Rapport no 116 du 25 avril 1809.
35 Il cède sa fabrique à Doyand qui ferme. Rapport no 47 du 6 septembre 1810.
36 Rapport no 55 du 19 mars 1808.
37 Rapports no 67 du 27 septembre et 84 du 24 octobre 18.
38 « Nous n’avons eu en vue que d’indiquer les moyens qui pouvaient assurer la salubrité de la fabrication. Les appareils que nous avons décrits peuvent être modifiés selon le local d’une fabrique, son étendue et l’industrie de celui qui est à la tête ». Rapport no 41 du 21 avril 1812.
39 Instruction du 18 mai 1812.
40 Notamment l’inutilité de laver l’hydrogène sulfuré qui brûle mieux autrement. Rapport no 81 du 7 juillet 1812.
41 Rapport no 96 du 30 août 1812.
42 Rapports no 124 et 147 de 1822.
43 Ibid., p. 38.


