1 Introduction
La drépanocytose ou anémie falciforme est une maladie pouvant être transmise des parents aux enfants (maladie génétique) qui touche particulièrement la population noire africaine. Elle est due au remplacement de l’acide glutamique par la valine en position six de la chaîne β de l’hémoglobine. Ce qui conduit à une hémoglobine anormale peu soluble, l’hémoglobine S, qui polymérise à l’intérieure des globules rouge quand la pression en oxygène baisse. Cette agrégation conduit à la falciformation des érythrocytes, responsable des nombreux problèmes des drépanocytaires [1,2].
Selon l’OMS, cette maladie touche plus de 50 millions de malades (homozygotes), et il y a 250 millions des porteurs hétérozygotes dans le monde. Plus de 330 000 enfants naissent avec cette maladie chaque année et 80% d’entre eux meurent avant leur cinquième anniversaire s’ils ne sont pas suivis médicalement [3].
La drépanocytose connaît une prévalence maximale en Afrique sub-saharienne et constitue aujourd’hui un problème de santé publique pour la plupart des pays noirs africains. En Afrique centrale et de l’Ouest, 20 à 40% des sujets sont porteurs du trait drépanocytaire. En république démocratique du Congo (RDC), plus de 2% de la population est touchée par cette maladie, soit près d’un million et demi d’individus [4–10].
D'une manière générale, le gène drépanocytaire affecte tous les pays de grande migration noire africaine : États-Unis d'Amérique, Antilles, Brésil... Mais on la retrouve aussi, à un moindre degré, dans tout le Bassin méditerranéen : Afrique du Nord, la péninsule Ibérique, la Sicile, l'Italie du Sud, la Grèce, la Turquie et le Proche-Orient [2].
Plusieurs options thérapeutiques ont été mises au point pour lutter contre la drépanocytose, mais n’apportent pas le succès souhaité ; toutes ces approches thérapeutiques sont, soit onéreuses, soit toxiques, et ne sont pas accessibles aux populations à faibles revenus [1,7].
Parmi les nombreuses tentatives pour soulager la souffrance des drépanocytaires se trouve l’utilisation des plantes médicinales. En effet, plusieurs études ont montré que, parmi les plantes citées en médecine traditionnelle comme pouvant soigner l’anémie falciforme, un bon nombre a montré in vitro une activité antifalcémiante [4,6,7,11–17] .
En république démocratique du Congo (RDC), notre équipe de recherche a déjà recensé plus de 75 plantes médicinales, dont un grand nombre a montré une activité antidrépanocytaire in vitro [5,8–10,16–38]. Les résultats obtenus indiquent que les anthocyanes et les acides organiques seraient des groupes chimiques biologiquement actifs et quelques molécules actives ont été isolées, notamment les acides betulinique, maslinique, ursolique, rosmarinique etc. [16–18,20–24,39–42]. Parmi les plantes recensées en RDC, un bon nombre se trouvent être des plantes alimentaires.
Dans cette étude, nous nous intéressons à ces plantes comestibles. Ces dernières présentent un intérêt particulier non seulement parce qu’elles ne nécessitent pas des essais toxicologiques et peuvent être directement conseillées aux malades, mais surtout parce que la drépanocytose est une maladie chronique. La meilleure approche ne serait donc pas d’aller vers les molécules et en synthétiser d’autres, mais d’intégrer le médicament du drépanocytaire dans son alimentation quotidienne. D’où l’intérêt des alicaments pour cette pathologie qui accompagne le malade toute la vie.
2 Materiels et methodes
2.1 Enquête ethnobotanique
Des enquêtes ethnobotaniques ont été réalisées autour de quelques grandes villes de la RDC dont Kinshasa, Lubumbashi, Kisangani et Bukavu. Les enquêtes ont consisté à recenser les plantes vendues dans les différents marchés des villes, à interroger les tradipraticiens et les différentes couches de la population.
2.2 Matériel végétal
Le matériel végétal est constitué des différentes parties des plantes citées comme étant utilisées en médecine traditionnelle contre la drépanocytose. Les plantes récoltées ont été identifiées aux herbaria des facultés des sciences des universités de Kinshasa, Lubumbashi ou Kisangani. Les numéros d’herbier sont Annona reticulata (H. Breyne 4739), Dacryodes édulis (J.Bombali 1937), Carica papaya (J. Bombali 1034), Ipomea Batata (P . compère 342), Cajanus cajan ( P.compère 211), Vigna unguiculata(P. compère 1970), Vigna radiata (Lebrun 3189), Ocimum gratissimum (R. Dechzmps 8016), Adansonia digitata (H.Breyne 241), Persea americana (R.Davred 1366), Moringa oleifera (R.Germain 1064), Psidium goyava (R.Davred 1021), Sorgum bicolor ( D. Davred 132), Afromomum alboviolaceum (L. Liben 1804)
2.3 Extraction
Le matériel végétal utilisé (10 g), séché et pulvérisé, a été mis à macérer à plusieurs reprises dans l’eau ou l’éthanol (200 ml × 1) pendant 48 heures. Les différentes fractions ont été filtrées et le solvant a été évaporé sous pression réduite en utilisant un évaporateur rotatif, comme précédemment décrit [5,8–10].
2.4 Materiel biologique
Les échantillons de sang hépariné utilisés pour évaluer l’activité antifalcémiante des plantes ont été obtenus, selon le cas, soit au centre de médecine mixte et d’anémie SS de Yolo ou au centre hospitalier Monkole à Kinshasa, au centre de dépistage et prise en charge des drépanocytaires (CDPCD) de l’hôpital général de référence Janson-Sendwe à Lubumbashi, ou encore au centre de santé Gracia Fondation à Kisangani. Aucun de ces patients n’a été récemment transfusé. Toutes les expériences sur l’activité antifalcémiante ont été réalisées avec un échantillon de sang fraîchement collecté. Dans le but de confirmer leur nature SS, les échantillons de sang susmentionnés ont été premièrement caractérisés par électrophorèse sur papier en utilisant le gel d’acétate de cellulose à pH 8,5 [5]. Une fois la nature SS de l’échantillon de sang confirmée, ce dernier a été gardé à ± 4 °C dans un réfrigérateur.
2.5 Activité biologique et analyse des données
Plusieurs tests biologiques sont utilisés pour montrer et confirmer l’activité biologique des plantes in vitro.
2.5.1 Test d’Emmel
Le sang total SS préalablement traité au méta bisulfite de sodium 2% est mis en contact avec les extraits des plantes à différentes concentrations en utilisant la solution physiologique (NaCl 0,9%) comme solvant et la vaseline ou la paraffine pour luter les préparations microscopiques [43]. Après incubation, les différentes préparations sont examinées au microscope optique de marque Motic 30207598, puis digitalisées. Un appareil photographique Olympus C211 a été utilisé en vue de numériser les micrographies, qui ont été ensuite traitées en utilisant le logiciel informatique Motic I images 2000, version 1.3, pour la détermination des paramètres tels que la surface, le périmètre et le rayon, afin de comparer les drépanocytes normalisés et ceux utilisés comme témoins. Le logiciel Microcal Origin 7.5 est utilisé pour le traitement statistique (test de Student) afin de vérifier si la normalisation des drépanocytes n’est pas liée à une simple dispersion aléatoire.
Le taux de normalisation (ou taux d’inhibition de la falciformation) des drépanocytes est calculé à partir de la relation :
| (1) |
où NDAV est le nombre des drépanocytes avant traitement et NDAP est le nombre des drépanocytes après traitement.
2.5.2 Test d’hémolyse
Les érythrocytes SS lavés sont mis en contact avec le métabisulfite de sodium 2% en présence ou en absence de l’extrait. À des intervalles des temps déterminés, une partie aliquote est prélevée, diluée avec la solution de NaCl à 0,9 % et centrifugée (15 s, 4000 tours). La densité optique du surnageant est lue à 540 nm. Une augmentation de la densité optique indique une augmentation de la teneur en hémoglobine en dehors des cellules, donc de l’hémolyse [19,21,23].
2.5.3 Test antioxydant
L’ effet antioxydant de chaque extrait est mesuré en suivant la réduction du radical 2,2-diphenyl-1-picrylhydrazyl (DPPH). Différentes dilutions de chaque extrait sont préparées dans le méthanol, et le pH est ajusté à 2 avec un tampon chlorhydrique. Une partie aliquote de 0,1 ml d’extrait dilué est ajoutée à 3,9 ml de la solution de DPPH dans le méthanol (80 μM). L’absorbance est mesurée à l’aide d’un spectrophotomètre UV-visible (Spectrum Vis Spectrophotometer SP-1105) entre 514–520 nm à différents intervalles de temps jusqu’à ce que la réaction atteigne le plateau dans le but de déterminer le temps de fin de réaction.
Le ED50 ou la concentration des extraits d’antioxydant capable de réduire de moitié la concentration de DPPH est déterminé en portant sur graphique le pourcentage de réduction du DPPH en fonction de la teneur de la substance antioxydante [9,10].
3 Resultats et discussion
Parmi près de 75 plantes médicinales utilisées contre la drépanocytose en médecine traditionnelle congolaise recensées par notre équipe de recherche autour de quelques grandes villes de DRC (Kinshasa, Lubumbashi, Kisangani et Bukavu) [16,17,35], se trouvent quelques plantes comestibles présentées dans le tableau 1.
Plantes comestibles utilisées contre la drépanocytose et leur activité.
| Famille | Nom scientifique | Nom vernaculaire | Partie utilisée | Activité antifalcémiante | |
| Extrait aqueux | Extrait alcoolique | ||||
| Annonaceae | 1. Annona reticulata | Cœur de bœuf (français) Mustaferi (Swahili) | feuilles, fruits | ++ | ++ |
| Burseraceae | 2. Dacryodes edulis (G.don) H.J.LAM | Nzete ya safu (lingala) | feuilles | + | + |
| Caricaceae | 3. Carica papaya L | Papayer(Français), paypay(Lingala), thipapayi (tshiluba) | fruits | +++ | ++ |
| Convolvulaceae | 4. Ipomea batata L | Patate douce (français) | feuilles, tubercules | +++ +++ | + ++ |
| Fabaceae | 5. Cajanus cajan (L) Mill SP | Wandu (Kikongo) | graines feuilles | +++ +++ | ++ ++ |
| 6. Vigna unguiculata (L) Wlap | Niébé(Francais), mbuengi (Lingala,Kikongo) Kunde (Swahili), Nkunda (Tshiluba) | feuilles, graines | +++ ++ | ++ + | |
| 7. Vigna radiata (L) R. Wilczek | Kambulu (Tshilumba) | graines | ++ | ++ | |
| Laureaceae | 8. Persea americana Mill | Avocatier (français), nzete ya savoka(Lingala) | feuilles | - | - |
| Lamiaceaea | 9. Ocimum basilicum | Basilique (français), mazulu (Kikongo), disulu (Luluwa) | feuilles | ++ | + |
| 10. Ocimum graticimum | Lumba lumba (Lingala), tshidibu luenyi (Tshiluba) | feuilles | +++ | ++ | |
| Malavacea | 11. Adansonia digitata | Baobab (français) | écorses | +++ | ++ |
| Moringaceae | 12. Moringa oliefera | Moringa (lingala) | feuilles | +++ | ++ |
| Myrtaceae | 13. Psidium goyava (L) | Goyavier (français), mapela (swahili) | feuilles fruits | ++ ++ | ++ + |
| Poaceae | 14. Cymbopogon densiflorus Stapf | tshikota (Tshiluba) | feuilles | + | + |
| 15. Sorghum bicolor L | Sorgho (français) | graines | ++ | + | |
| Zingiberaceae | 16. Afromomum albo violaceum | Tondolo (Lingala), matungulu podi(swahili) | feuilles | + | + |
Il ressort de ce tableau que 16 plantes comestibles appartenant à 12 familles sont utilisées en médecine traditionnelle congolaise pour lutter contre la drépanocytose. La figure 1 donne la proportion des plantes par famille tandis que la figure 2 donne la fréquence des parties utilisées.
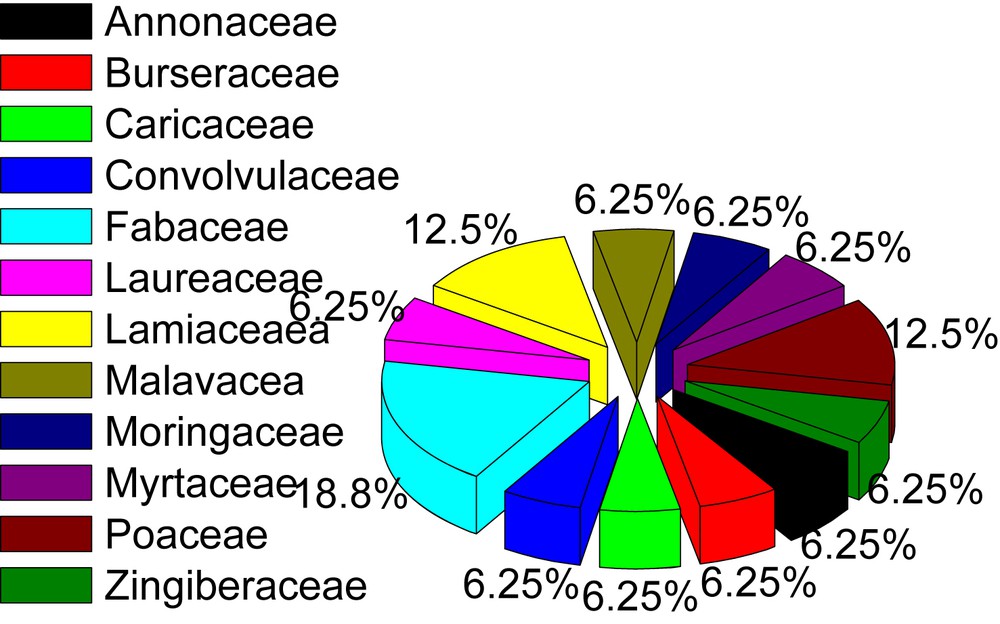
Proportions des plantes par famille.

Morphologie des érythrocytes drépanocytaires non traités (500 x).
Il ressort de cette figure que les Fabacées, les Lamiacées et les Poacées constituent à eux seuls de plus de 50 % des plantes comestibles recensées. Les feuilles représentent la partie la plus utilisée des plantes comestibles utilisées dans la lutte contre la drépanocytose, tandis les inflorescences ne sont utilisées que pour une seule plante.
Le tableau 1 indique également que, sur les 16 plantes citées, seule une seule plante n’a pas montré d'activité antifalcémiante in vitro, ni pour l’extrait aqueux, ni pour l’extrait alcoolique. Ce qui indique que l’information donnée par la médecine traditionnelle a été validée à 94%. Il faut également noter que l’eau et l’éthanol ont été choisis comme solvants, car ces plantes sont généralement recommandées sous forme de décoctions, macérées ou en infusions dans l’eau ou dans le vin de palme.
Les figures 2 et 3 donnent, à titre d’exemple, les micrographies du sang SS seul (témoin) et du sang SS en présence de l’extrait aqueux des feuilles de Ipomea batata.

Morphologie des érythrocytes drépanocytaires traités (500X).
La figure 2, obtenue à partir du sang SS en présence de la solution physiologique seule, considérée comme témoin négatif, montre que la majorité des érythrocytes est falciformée. Ce qui signifie que l’hémoglobine S (HbS) de cet échantillon de sang a polymérisé, entraînant ainsi la formation des agrégats appelés « tactoïdes ». Ceci confirme la nature SS de l’échantillon du sang utilisé. Cette morphologie des cellules du sang SS est en effet généralement observée pour le sang SS en condition d’hypoxie [5,18–39]. En présence des extraits aqueux des feuilles de patate douce, la majorité des érythrocytes reprennent leur forme normale biconcave, comme le montre la figure 3. Ce comportement est obtenu pour l’ensemble des plantes actives.
La normalisation des drépanocytes pour le sang SS traité aux extraits des plantes alimentaires indique l’influence de ces extraits sur la falciformation des cellules sanguines. Ce fait montre donc l’activité antifalcémiante de ces plantes et justifie leur utilisation dans la lutte contre la drépanocytose en médecine traditionnelle congolaise.
Pour quantifier la modification de la forme des cellules sanguines, les valeurs moyennes des rayons, périmètres et surfaces des drépanocytes ont été calculées avant et après traitement à partir des micrographies optiques. Les valeurs obtenues dans le cas type du traitement du sang SS par les extraits d’Ipomea batata sont consignées dans le tableau 2.
Valeurs moyennes des rayons, périmètres et surfaces des érythrocytes avant et après traitement aux extraits aqueux d’Ipomea batata.
| Paramètres | Témoin | HbS + extrait d’I. batata |
| Rayons (μm) | - | 3,2 ± 0,3 |
| Périmètres (μm) | 34,1 ± 1,1 | 21,2 ± 1,8 |
| Surfaces (μm2) | 23,9 ± 1,3 | 32,6 ± 1,1 |
Il ressort de ce tableau qu’il y a une différence significative entre les valeurs moyennes des rayons, périmètres et surfaces des drépanocytes avant et après traitement (p > 0,05). Ceci confirme ainsi la modification de la forme des érythrocytes en présence des extraits de la plante. Les paramètres calculés pour les drépanocytes traités sont proches des ceux de cellules des globules rouges normaux, soit 3,5 μm pour le rayon.
Ce comportement a été observé pour un bon nombre d’espèces de plantes citées en médecine traditionnelle congolaise comme ayant une activité antidrépanocytaire [5,16–39] et même pour certaines espèces non citées en médecine traditionnelle congolaise, mais appartenant aux mêmes genres que celles qui ont été citées [28].
Pour confirmer cette activité antidrépanocytaire, nous avons utilisé un autre test, le test d’hémolyse. La figure 4 donne l’évolution de la densité optique de la solution du sang SS seul et celle du sang SS en présence des extraits aqueux de Sorghum bicolor.

Evolution de la densité optique de la solution du sang SS seul et celle du sang SS en présence de l’extrait aqueux de Sorghum bicolor (λ = 540 nm).
Il ressort de la figure 4 que la densité optique du sang SS seul augmente avec le temps à 540 nm. En fait, c’est l’hème de l’hémoglobine qui constitue le groupement chromophore qui absorbe à cette longueur d’onde. Le fait que la densité optique augmente avec le temps indique que l’hémoglobine se retrouve de plus en plus en solution, ce qui veut dire qu’elle quitte l’intérieur de l’enveloppe érythrocytaire qui s’est hémolysée. Mais, en présence des extraits de plantes, on remarque que la densité optique n’augmente pas avec le temps, mais baisse plutôt. Ce comportement ne peut s’expliquer que par l’action de ces extraits sur les drépanocytes en empêchant leur hémolyse. Ce comportement a été observé pour un bon nombre de plantes, dont les feuilles de Justicia secunda [20,21,23].
En effet, la drépanocytose est connue comme une anémie hémolytique à cause de l’hémolyse précoce des érythrocytes du sang drépanocytaire qui, en évacuant ainsi l’hémoglobine dans un milieu non propice, la destine à une destruction précoce qui conduit à une baisse du taux de cette protéine vitale du sang, donc à l’anémie. Toute substance qui empêcherait ou réduirait cette hémolyse serait bénéfique pour les drépanocytaires. C’est ce qui, ajouté à la normalisation des drépanocytes, expliquerait l’utilisation de ces plantes contre la drépanocytose.
L'une des principales caractéristiques de la drépanocytose est la production d'une grande quantité de radicaux libres, conduisant à un stress oxydatif grave et à la consommation du monoxyde d’azote par des radicaux libres de l'oxygène. Le stress oxydatif affecte également le rapport Fe3+/Fe+2, assez élevé dans les cellules falciformes, et est impliqué dans l’hémolyse des drépanocytes. Les propriétés antioxydantes d’une plante indiqueraient donc également son action sur la drépanocytose [9,10]. L’activité antioxydante de plusieurs plantes médicinales alimentaires a été testée, et particulièrement celle des extraits d’anthocyanes et d’acides organiques. Le tableau 3 suivant donne, à titre d’exemple, les valeurs de ED50 des extraits de Drepanoalpha, un alicament potentiel à base de trois plantes alimentaires [9].
Activité antioxydante de Drepanoalpaha et des extraits d’anthocyanes et d’acides organiques.
| Fraction | ED50 (μg/mL) | Activité antioxidante |
| Acide ascorbique (temoin positif) | 0.562 ± 0.212 | 1.779 |
| Drépanoalpha | 0.604± 0.028 | 1.655 |
| Extraits d’anthocyanes | 1.590± 0.211 | 0.628 |
| Extraits d’acides organiques | 1.949 ± 0.212 | 0.513 |
Comme on peut le voir dans ce tableau, l’activité antiradicalaire de l’extrait de Drepanoalpha, en utilisant le DPPH comme radical modèle, est proche de celle de l’acide ascorbique utilisé comme témoin positif. Les extraits des anthocyanes et des acides organiques montrent également des valeurs de ED50 intéressantes.
En effet, les anthocyanes, comme les polyphénols en général, sont connus pour leur activité antioxydante. La présence de ces pigments (dont le catabolisme intestinale donne acides phénoliques) contribuerait aux propriétés antioxydantes des plantes alimentaires utilisées contre la drépanocytose en médecine traditionnelle congolaise. Ces propriétés permettraient de stabiliser la membrane des érythrocytes du sang SS et réduiraient le rapport Fe3+/Fe+2 [19,20,23].
Il convient d’indiquer qu’une étude in vivo sur Vigna unguiculata effectuée sur un groupe des drépanocytaires à Kisangani et à Kinshasa (RDC) a montré des résultats encourageants. En effet, les résultats obtenus ont montré une disparition de quelques signes apparents de la maladie, une diminution du nombre des crises et une remontée sensible du taux d’hémoglobine pour les malades ayant consommé régulièrement les feuilles et les graines de niébé.
3.1 Conclusion
Il ressort de cette étude que 16 plantes alimentaires sont citées parmi les plantes utilisées contre la drépanocytose en RDC. Parmi ces plantes, 15 ont montré une activité antifalcémiante et anti-hémolytique in vitro, confirmant ainsi les informations obtenues en médecine traditionnelle. Ces plantes pourraient donc être utilisées comme alicaments pour soulager ceux qui souffrent de cette maladie chronique.
Conflit d’intérêt
Les auteurs déclarent qu’il n’y a aucun conflit d’intérêt.
Remerciements
Les auteurs remercient « The World Academy of Sciences», TWAS (Research grant No. 15-156 RG/CHE/AF/AC_G—FR3240287018), l’Académie de recherche et d’enseignement supérieur (Ares) du Royaume de Belgique (projet PAH, ARES/UNIKIN) et l’ambassade de Suisse à Kinshasa (projet RESUD) pour leur soutien financier.



Vous devez vous connecter pour continuer.
S'authentifier