1. Introduction
La pollution plastique constitue l’un des principaux défis environnementaux du XXIe siècle. Chaque année, plusieurs centaines de millions de tonnes de plastiques issus de ressources fossiles sont produites, dont une large part échappe aux circuits de recyclage et se disperse dans les écosystèmes terrestres et marins [1]. Cette situation est aggravée par la raréfaction croissante des ressources pétrolières et l’empreinte carbone importante liée à la production des polymères synthétiques [2, 3]. Dans ce contexte, le développement de matériaux biodégradables et biosourcés apparaît comme une alternative prometteuse pour limiter les impacts environnementaux des plastiques conventionnels [4, 5].
Les plastiques biodégradables proviennent de sources diverses, comprenant d’une part des polymères synthétiques, qui, bien que présentant de bonnes propriétés, restent coûteux à produire et sont majoritairement dérivés de ressources pétrolières non renouvelables, et d’autre part des polymères d’origine naturelle [6]. Parmi les matériaux renouvelables, l’amidon se distingue comme l’un des biopolymères les plus prometteurs pour la fabrication de bioplastiques, en raison de son abondance, de son faible coût, de sa capacité de renouvellement et de sa compatibilité avec une production industrielle à grande échelle [7, 8]. De nombreux biocomposites à base d’amidon ont ainsi été développés [9, 10, 11]. L’amidon est constitué de monomères de D-glucose liés par des liaisons α (1–4) [12], avec deux principales structures : l’amylose linéaire (20–30 %) et l’amylopectine ramifiée (70–80 %) [13, 14].
Ce biopolymère a été envisagé pour diverses applications, telles que les détergents hydrosolubles, les sachets d’insecticides, les films et pochettes jetables, ainsi que les systèmes et dispositifs de délivrance pharmaceutique [15]. Par ailleurs, l’amidon peut être produit à partir de déchets agroalimentaires [16]. Dans une logique d’économie circulaire, le choix de sous-produits agro-industriels spécifiques tels que les pelures de pomme de terre, les écorces d’orange et la paille se justifie par leur abondance, leur faible coût et leur potentiel de valorisation. Cette approche favorise la réutilisation des déchets et l’optimisation des ressources. L’intégration de ces matières contribue non seulement au développement durable des bioplastiques, mais répond également aux enjeux essentiels de gestion et de valorisation des résidus agricoles.
Cependant, les bioplastiques à base d’amidon présentent généralement une faible résistance à l’eau ainsi que des propriétés mécaniques et thermiques limitées, ce qui restreint leur usage pratique [17, 18]. Pour pallier ces limites, plusieurs solutions ont été proposées, notamment l’ajout de plastifiants, qui assouplissent la matrice polymérique, améliorent la flexibilité et réduisent la fragilité des films amidonnés, bien que cela puisse parfois accroître leur hydrophilie. Par exemple, l’incorporation de glycérol améliore les propriétés thermiques et mécaniques, ainsi que la biodégradabilité et la compostabilité des bioplastiques [19]. D’autres plastifiants comme le sorbitol, le fructose et l’urée ont été étudiés à différentes concentrations pour évaluer leur influence sur les propriétés mécaniques, thermiques, hydriques et morphologiques des films bioplastiques à base d’amidon de blé. Ces études montrent que l’ajout de plastifiants améliore l’élasticité, la flexibilité, la résistance à l’eau et la surface des films, tout en précisant la dose optimale selon l’application ciblée [20, 21, 22]. De plus, de nouveaux plastifiants tels que le HEF (N (2-hydroxyethyl) N,N′-ethylbis(formamide)) ont été récemment testés ; une simulation par dynamique moléculaire a révélé que le HEF forme des liaisons hydrogène particulièrement fortes avec les groupes hydroxyles et éther de l’amidon, surpassant ainsi le glycérol en termes de résistance mécanique [23].
Pour renforcer davantage les propriétés mécaniques et fonctionnelles des bioplastiques à base d’amidon, l’incorporation de matériaux de renfort, tels que des nanofibres ou des biopolymères complémentaires, constitue une stratégie efficace largement explorée. La nanocellulose, extraite de fibres lignocellulosiques, améliore de manière significative les propriétés mécaniques, thermiques et barrières des biocomposites amidonnés [24, 25, 26]. Une étude récente a également démontré que l’association de gomme xanthane et de nanocellulose dans un film d’amidon thermoplastique rehausse considérablement ses performances mécaniques [27]. Plusieurs recherches récentes montrent que le renforcement de films à base d’amidon, de pectine ou de leurs mélanges par l’ajout de nanocellulose (sous forme de nanofibres ou de nanocristaux) extraite des biomasses agricoles telles que les pelures d’agrumes, le rattan et le bois améliore nettement les modules d’élasticité et la résistance à la traction, tout en réduisant la perméabilité à la vapeur d’eau et à l’oxygène [28, 29, 30]. La pectine, extraite facilement des pelures d’agrumes et des coproduits agro-industriels (pomaces, pulpes) [31, 32], apporte aux bioplastiques à base d’amidon eux-mêmes issus de déchets agroalimentaires une dimension d’économie circulaire et de valorisation zéro déchet. L’adoption des principes d’économie circulaire et de valorisation zéro déchet présente des avantages environnementaux majeurs, notamment la diminution des déchets envoyés en décharge et la réduction des émissions de gaz à effet de serre. Sur le plan économique, cette approche crée de la valeur ajoutée à partir de matières premières à faible coût, soutient les filières agricoles locales et stimule le développement d’industries écologiques. Ces bénéfices renforcent l’intérêt des bioplastiques issus de ces sous-produits comme alternatives viables aux plastiques conventionnels, attirant ainsi l’attention d’un public large, allant des décideurs aux consommateurs responsables.
La majorité des travaux se concentrent sur la production de films biodégradables pour l’emballage alimentaire, lesquels présentent d’excellentes propriétés barrières (gaz, humidité), une grande transparence ou brillance, et s’avèrent prometteurs pour remplacer les plastiques conventionnels tout en garantissant leur innocuité [28, 33].
2. Matériel et techniques expérimentales
2.1. Matériel
Pour l’élaboration des films bioplastiques à base d’amidon, utilisé comme matrice principale, l’amidon a été extrait des pelures de pommes de terre issues des déchets de restauration de l’Université des Sciences et de la Technologie Houari Boumediene (USTHB). Afin de renforcer ces films et d’améliorer certaines propriétés, notamment mécaniques, des nanoparticules de cellulose et de la pectine ont été incorporées. Deux matières premières ont ainsi été extraites : la cellulose provenant de la paille d’une ferme agricole à Alger, et la pectine issue des pelures d’orange, provenant également des déchets de restauration de l’USTHB. Différents réactifs fournis par Sigma-Aldrich Algérie ont été utilisés dans les différents procédés : le glycérol, employé comme plastifiant, l’hydroxyde de sodium (NaOH, de qualité réactif, pureté 98,6 %) pour le traitement alcalin des extraits, l’acide acétique (pureté 98 %) pour le lavage post-traitement alcalin afin d’éliminer les résidus de NaOH, l’éthanol (pureté 96 %) pour le rinçage de l’amidon brut extrait des pelures de pomme de terre, l’acide sulfurique (H2SO4) utilisé comme traitement acide pour faciliter la dégradation des hémicelluloses, principaux composants de la biomasse, une solution d’acide citrique a été employée pour ajuster le pH des différentes solutions.
2.2. Extraction des matières premières
Trois films bioplastiques ont été développés à partir d’amidon extrait des pelures de pomme de terre utilisé comme matrice principale, et préparés par la méthode de coulage et évaporation. Ces films ont été renforcés par deux biomatériaux naturels issus de déchets agro-industriels : la pectine extraite des pelures d’orange et la nanocellulose isolée de la paille, ajoutées à hauteur de 10 % en masse. Le choix de ce taux de renfort, correspond à une concentration suffisamment élevée et couramment rapportée dans la littérature comme optimale [34, 35, 36] pour maximiser la dispersion homogène des biomatériaux dans la matrice d’amidon, ce qui améliore les interactions interphasaires et renforce les propriétés mécaniques et barrières des films, tout en limitant les phénomènes d’agrégation et de fragilisation généralement observés à des concentrations supérieures.
2.2.1. Extraction d’amidon à partir de pelures de pommes de terre
Les pelures de pommes de terre, riches en amidon, représentent une ressource efficace pour la production de bioplastiques. L’amidon extrait subit, sous l’effet de la chaleur et en présence de plastifiants, un processus de gélatinisation suivi d’une réorganisation moléculaire, aboutissant à la formation d’un film continu et homogène. Le protocole appliqué, basé sur une méthode décrite dans la littérature [37], est présenté ci-dessous. Les pelures de pommes de terre ont d’abord été lavées à l’eau distillée, puis broyées avec une quantité suffisante d’eau afin d’obtenir une pâte homogène. Ce mélange a ensuite été filtré à l’aide d’un tissu en mousseline permettant de séparer un filtrat riche en amidon. Le filtrat a été laissé au repos pendant 24 h pour favoriser la décantation. Le surnageant a été retiré et le précipité d’amidon brut récupéré. Celui-ci a été lavé plusieurs fois à l’eau distillée, puis rincé à l’éthanol pour améliorer sa pureté. Enfin, l’amidon purifié a été séché à l’air libre pendant 24 h, broyé finement, puis conservé dans un récipient hermétique. Le rendement d’extraction, calculé par rapport à la matière première fraîche, a été évalué sur trois lots indépendants (n = 3). Pour l’amidon extrait des pelures de pomme de terre, il atteint 56,85 ± 1,00 %.
2.2.2. Extraction de la cellulose à partir de la paille et production de nanocellulose
Le procédé d’extraction de la cellulose à partir de la paille, basé sur une méthode décrite dans la littérature [38, 39, 40], commence par un broyage destiné à réduire le degré de polymérisation de la cellulose et de la lignine. Ensuite, 25 g de poudre de paille sont mélangés à une solution aqueuse d’acide sulfurique (H2SO4) à 2 % dans 200 ml d’eau, puis chauffés au reflux à 100 °C pendant 2 h. Ce traitement acide favorise la dégradation des hémicelluloses, principaux composants de la biomasse. Après refroidissement, deux phases se forment : une phase liquide contenant les hémicelluloses et une phase solide. La phase liquide est filtrée, tandis que le résidu solide est rincé à l’eau distillée en préparation des étapes suivantes. La lignine est isolée du résidu solide par un traitement alcalin en utilisant une solution d’hydroxyde de sodium (NaOH) à 15 %, sous reflux à 100 °C pendant 2 h. Après refroidissement, le mélange se sépare en une phase liquide contenant la lignine et en une phase solide principalement composée de cellulose. Cette cellulose est récupérée par filtration, puis rincée à l’eau distillée. Pour éliminer les impuretés et obtenir une teinte plus claire, la cellulose jaunâtre est ensuite blanchie en étant traitée avec une solution aqueuse d’hypochlorite de sodium à 2 %. Enfin, la cellulose blanchie est séparée de la solution par filtration. Le rendement d’extraction, exprimé par rapport à la matière première fraîche, a été déterminé sur trois lots indépendants (n = 3). Pour la cellulose extraite de paille de blé, il s’élève à 18,42 ± 1,41 %. Les nanocelluloses ont été produites par un procédé chimique reposant sur l’hydrolyse sulfurique, suivie d’étapes de neutralisation, centrifugation, lavage et séchage. Ce protocole, couramment appliqué pour la fabrication de nanocristaux, permet d’obtenir des particules de taille nanométrique avec une bonne dispersion grâce à la dépolymérisation contrôlée de la cellulose. Dans 100 ml d’acide sulfurique à 50 % (v/v), 10 g de fibres de cellulose blanchies ont été soumises à une hydrolyse acide à 30 °C pendant 3 h avec agitation constante. À l’issue de l’hydrolyse, la solution a été neutralisée par ajout d’une solution de soude (NaOH) à 20 % jusqu’à atteindre un pH neutre d’environ 7 [41]. La suspension obtenue a ensuite été centrifugée à 8500 tr/min pendant 10 min afin de récupérer les nanocelluloses sous forme de précipité. Ce précipité a été soigneusement lavé à l’eau distillée, puis séché à température ambiante pour obtenir une poudre de nanocellulose destinée à la formulation des bioplastiques.
2.2.3. Extraction de pectine à partir d’écorces d’orange
Les pelures d’orange ont été choisies comme source naturelle de pectine, un polysaccharide largement utilisé dans les matériaux biodégradables. Provenant de résidus de fruits très consommés, ces écorces constituent une ressource renouvelable et abondante. L’extraction de la pectine a été réalisée selon un protocole adapté d’une publication scientifique [42]. Les pelures d’orange ont d’abord été lavées à l’eau courante, puis découpées en petits morceaux avant d’être séchées dans une étuve à 80 °C pendant 24 h. Une fois sèches, elles ont été broyées à l’aide d’un mixeur. L’extraction s’est ensuite déroulée en dispersant les pelures broyées dans de l’eau distillée selon un rapport masse/volume de 1 : 25 (g/mL), puis en chauffant le mélange à 90 °C pendant 60 min sous agitation magnétique à 500 rpm. Le pH du milieu a été ajusté à 3,8 à l’aide d’une solution d’acide citrique. Après extraction, le mélange a été filtré et la pectine précipitée par ajout d’éthanol dans un rapport 1 : 4. La pectine précipitée a finalement été filtrée puis séchée dans une étuve à 80 °C pendant 24 h. Le rendement d’extraction a été mesuré sur trois lots indépendants (n = 3) et exprimé par rapport à la matière première fraîche. Celui de la pectine extraite des pelures d’orange est de 23,43 ± 2,59 %.
2.3. Élaboration des films bioplastiques
À partir d’une matrice d’amidon naturel, renforcée par des biopolymères d’origine végétale, des formulations spécifiques ont été mises au point afin d’optimiser les propriétés mécaniques, thermiques et de dégradabilité des films obtenus.
2.3.1. Préparation de la matrice d’amidon
La préparation de la matrice de base a été réalisée selon un protocole expérimental comportant plusieurs étapes. Dans un bécher, 2,5 g d’amidon ont été dispersés dans un mélange constitué de 3 ml d’acide chlorhydrique (HCl) à 0,1 mol⋅L−1 et de 1,5 ml de glycérine, utilisée comme agent plastifiant [37]. Ce mélange a été ensuite agité soigneusement jusqu’à l’obtention d’une solution homogène. Par la suite, 25 ml d’eau distillée ont été ajoutés afin de compléter le volume réactionnel. Le système a été soumis à un chauffage progressif sous agitation mécanique, la température étant rigoureusement contrôlée à l’aide d’un thermomètre conforme à la norme ASTM (plage de mesure : 5–110 °C). Le chauffage a été maintenu sans dépasser 90 °C. Lorsque cette température a été atteinte, 1,5 ml d’une solution d’hydroxyde de sodium (NaOH) à 0,1 mol⋅L−1 a été incorporée tout en poursuivant l’agitation jusqu’à ce qu’un épaississement marqué du mélange soit observé, indiquant le début de la gélification. Enfin, le produit obtenu a été coulé dans une boîte de Pétri et soigneusement étalé afin d’obtenir un film uniforme.
2.3.2. Préparation des films renforcés
Pour la préparation des films bioplastiques renforcés, selon un rapport massique amidon/additif de 90/10, le même protocole que pour la matrice d’amidon pur a été appliqué, à l’exception de l’ajout d’un additif naturel : nanocellulose ou pectine, après homogénéisation complète de la solution alcaline. Le mélange obtenu a alors été agité jusqu’à épaississement et gélification. Les pâtes ont ensuite été coulées dans des boîtes de Pétri et étalées uniformément. Le séchage des films, réalisé exclusivement à l’air libre, a duré 48 h à température ambiante (environ 25 °C), à l’abri de la poussière et dans un environnement peu ventilé, favorisant une évaporation lente et régulière. Cette méthode permet d’éviter la formation de fissures et réduit les tensions internes. Pour limiter la variabilité, tous les films ont été préparés dans des conditions identiques de température et d’humidité.
3. Caractérisation et mesures
3.1. Mesure de l’épaisseur du film bioplastique
L’épaisseur des films bioplastiques a été évaluée par trois mesures localisées à l’aide d’un appareil FILMETRICS F3-XT, et la moyenne a été calculée pour garantir la représentativité et l’homogénéité des films.
3.2. Identification par spectroscopie Raman
Les spectres Raman des échantillons ont été enregistrés à l’aide d’un spectromètre Raman RENISHAW équipé d’un laser d’excitation à 785 nm. Les analyses ont été effectuées sur une plage spectrale comprise entre 400 et 3500 cm−1. Les films ont été déposés directement sur une lame de verre, et les mesures réalisées à température ambiante. Cette méthode permet d’identifier les vibrations moléculaires caractéristiques des liaisons chimiques au sein de la matrice amidonnée, ainsi que les interactions potentielles entre l’amidon et les additifs de renforcement.
3.3. Tests de biodégradabilité
Les tests de biodégradabilité des films bioplastiques évaluent leur décomposition par des micro-organismes en conditions spécifiques. Dans cette étude, la méthode in situ a été utilisée, consistant à immerger les échantillons dans des milieux naturels (sol, eau de mer) et à mesurer la perte de masse sur 25 j, afin de comparer le comportement des formulations face à la dégradation naturelle. Pour chaque milieu (sol et eau de mer), cinq expériences indépendantes ont été réalisées pour chaque échantillon à chaque intervalle. La cohérence des valeurs a été vérifiée et les valeurs moyennes ont été consignées.
3.3.1. Biodégradabilité dans le sol
Des échantillons de films, préalablement découpés, ont été pesés avec précision afin de déterminer leur masse initiale sèche (notée mi). Chaque échantillon a ensuite été enterré à une profondeur d’environ 5 cm dans un bac contenant de la terre de jardin légèrement humidifiée. Les bacs ont été conservés à température ambiante (25 °C), à l’abri de la lumière directe, et l’humidité du sol a été maintenue constante par l’ajout bihebdomadaire d’eau. Les échantillons ont été extraits à intervalles réguliers (3, 6, 12, 20 et 25 j), rincés soigneusement à l’eau distillée afin d’éliminer toute trace de terre, puis séchés jusqu’à obtention d’une masse constante, notée mf. La perte de masse, exprimant le pourcentage de biodégradation, a été calculée selon l’équation (1) [37]:
| \begin {equation} \label {eq1} \text {Taux de d\'{e}gradation}=\frac {m_{i}-m_{f}}{m_{i}} \end {equation} | (1) |
3.3.2. Biodégradabilité dans l’eau de mer
Des échantillons de films, préalablement découpés, ont été pesés afin de déterminer leur masse initiale sèche (mi), puis immergés dans des béchers contenant 100 ml d’eau de mer présentant les caractéristiques suivantes : pH 7,72, conductivité 50,0 mS/cm et turbidité 0,29 NTU. Les béchers ont été maintenus à température ambiante pendant toute la durée de l’étude. Les échantillons ont été prélevés à des intervalles définis (jours 3, 6, 12, 20 et 25), soigneusement rincés à l’eau distillée afin d’éliminer les résidus salins, puis séchés à température ambiante jusqu’à obtention d’une masse constante. Une fois secs, ils ont été pesés de nouveau pour déterminer leur masse résiduelle (mf) et ainsi évaluer la biodégradabilité en milieu marin. Le taux de dégradation a été calculé selon la même formule que celle employée pour le test en milieu terrestre.
3.4. Mesure de l’absorption d’eau
Le test d’absorption d’eau réalisé selon la norme ASTM D570 a pour objectif de déterminer la quantité d’eau absorbée par un échantillon de bioplastique. Les échantillons découpés en carrés ont d’abord été séchés pendant 24 h (jusqu’à masse constante). Ensuite, ils ont été pesés (on note la masse sèche, m0) avant d’être immédiatement immergés dans 100 ml d’eau distillée à température ambiante (25 ± 2 °C) pendant 21 j. Cette période d’immersion, supérieure à celle recommandée par la norme (habituellement 24 h à 7 j), a été choisie pour simuler une exposition prolongée en conditions d’usage réel et évaluer la stabilité dimensionnelle et hydrique à long terme des bioplastiques. Les échantillons sont retirés de l’eau, épongés délicatement avec du papier absorbant pour éliminer l’excès d’eau en surface, puis pesés à nouveau (masse humide, mh). Le pourcentage d’absorption d’eau est calculé à partir de la différence entre la masse initiale sèche et la masse après immersion, selon l’équation (2):
| \begin {equation}\label {eq2} \text {Absorption en eau (\%)} = (m_{t} - m_{0})/m_{0} \times 100 \end {equation} | (2) |
3.5. Propriétés mécaniques
Les propriétés mécaniques des films bioplastiques, qu’ils soient renforcés (amidon/pectine et amidon/nanocellulose) ou non renforcés (amidon), constituent un paramètre déterminant pour évaluer leur aptitude à diverses applications, notamment dans les domaines de l’emballage, de l’agriculture et du biomédical. Ces propriétés sont étroitement liées à la composition chimique, à la structure morphologique ainsi qu’à la présence d’additifs incorporés lors de la formulation des bioplastiques. Dans la présente étude, trois paramètres mécaniques ont été considérés : la résistance à la traction, l’allongement à la rupture et le module d’élasticité (module de Young). Les essais mécaniques ont été réalisés à l’aide d’une machine de traction MTS, conformément à la norme ASTM D882, spécifiquement adaptée aux films plastiques minces. Cette norme définit les conditions expérimentales, notamment une vitesse d’allongement de 10 mm/min, une température d’essai maintenue à 25 °C, ainsi que les dimensions normalisées des éprouvettes. Des échantillons rectangulaires de 10 mm × 50 mm ont été découpés dans les films, en veillant à obtenir des bords parallèles, une largeur constante et l’absence de défauts sur toute la longueur, afin d’assurer la reproductibilité et la comparabilité des mesures. Pour chaque type de film, cinq éprouvettes ont été testées de manière indépendante afin de garantir la validité statistique des résultats. Les valeurs obtenues sont présentées sous forme de moyennes ± écart type, calculées à partir des mesures individuelles, permettant ainsi une analyse rigoureuse de la dispersion et une interprétation fiable des performances mécaniques des films bioplastiques étudiés.
3.6. Stabilité thermique des bioplastiques
La stabilité thermique des bioplastiques constitue une propriété essentielle déterminant leur aptitude aux procédés thermiques et à diverses applications. Elle dépend étroitement de la composition chimique, de la structure morphologique ainsi que des additifs incorporés lors de leur formulation. L’analyse thermogravimétrique (ATG) a été réalisée à l’aide d’un analyseur thermique de marque METTLER. Une masse comprise entre 11 et 14 mg de film bioplastique a été déposée dans un creuset en platine puis soumise à un programme de chauffage allant de 25 à 600 °C, avec une vitesse de chauffage de 10 K/min. L’atmosphère d’analyse était un flux d’azote (N2) maintenu à 50,0 ml/min afin de prévenir l’oxydation des échantillons. Ce dispositif permet d’enregistrer les variations de masse de l’échantillon en fonction de la température, fournissant ainsi des informations sur les différentes étapes de dégradation thermique.
4. Résultats et discussion
4.1. Aspect visuel des films bioplastiques
L’évaluation visuelle est une méthode qualitative initiale qui permet de vérifier l’uniformité, la transparence, la couleur et la présence de défauts dans les films, afin d’apprécier la compatibilité entre l’amidon et les renforts ainsi que la qualité globale des films. La Figure 1, regroupe les photos des trois formulations élaborées.
Aspect macroscopique des bioplastiques formulés : (a) film bioplastique à base d’amidon/nanocellulose ; (b) film bioplastique à base d’amidon/pectine ; (c) film bioplastique d’amidon.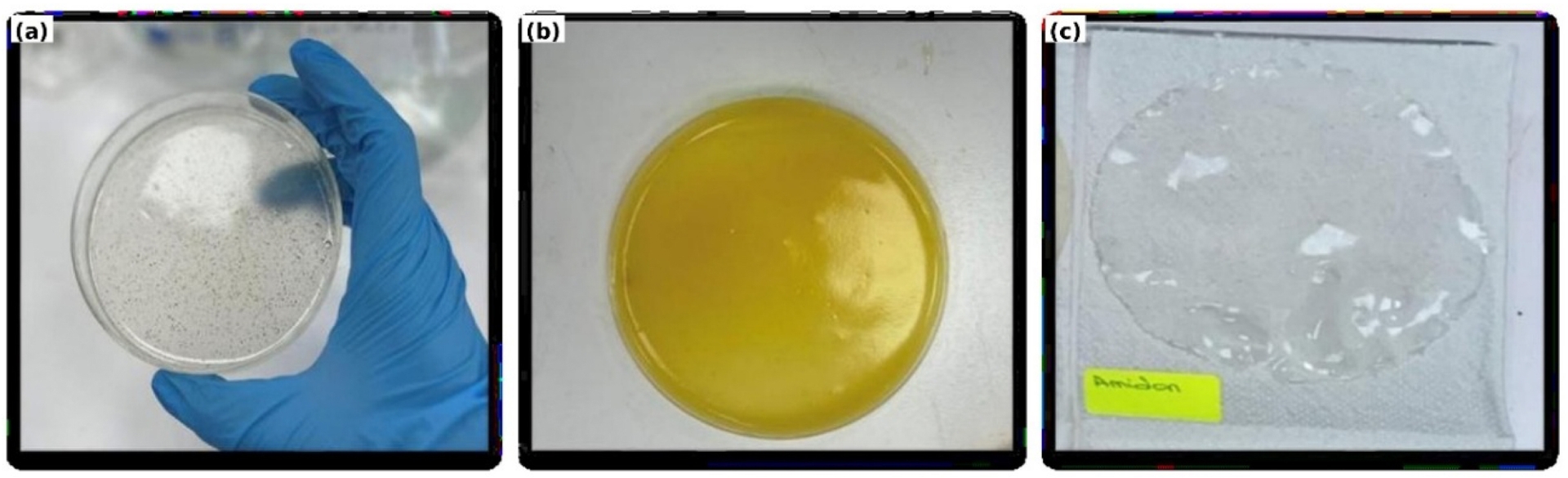
L’observation visuelle des films obtenus révèle des différences marquées en termes d’homogénéité, de transparence et de texture, en fonction du type de renfort incorporé dans la matrice d’amidon. Le film constitué uniquement d’amidon affiche une structure très transparente, continue et relativement homogène, indiquant une bonne plastification, mais sans phase renforçante structurante. En revanche, l’ajout de pectine donne lieu à un film visuellement uniforme, brillant et présentant une teinte jaune doré, exempt de tout défaut visible. Cette apparence suggère une excellente compatibilité entre l’amidon et la pectine, probablement due à des interactions physico-chimiques favorables entre les chaînes polysaccharidiques. Enfin, le film contenant de la nanocellulose se caractérise par un aspect translucide parsemé de fines particules visibles, témoignant d’une dispersion globalement satisfaisante, bien que perfectible.
4.2. Épaisseur des films bioplastiques
L’épaisseur des films obtenus a été mesurée en trois points différents pour chaque échantillon, l’épaisseur moyenne de chaque bioplastique est représentée sur la Figure 2. Il est observé qu’avec la formulation amidon/nanocellulose (Am/Ncl), une augmentation de 200 % de l’épaisseur a été enregistrée, tandis que pour la formulation amidon/pectine (Am/Pe), une diminution de 13 % a été notée. La nanocellulose, en tant que nanofibre naturelle, forme un réseau tridimensionnel lorsqu’elle est incorporée dans une matrice d’amidon. Ce réseau améliore la cohésion interne du film, renforce ses propriétés mécaniques et modifie sa microstructure, souvent en augmentant l’épaisseur et la rigidité du film. Ces résultats sont cohérents avec ceux de Kumar et al. [43], qui ont démontré que la présence de nanocellulose dans les films à base d’amidon accroît la porosité et la capacité de rétention d’eau, ce qui peut expliquer l’augmentation significative de l’épaisseur. À l’inverse, la pectine, dont l’effet dépend de sa concentration et de son type, peut réduire la quantité d’eau retenue dans le film. Une moindre rétention d’eau conduit à un gonflement réduit durant le séchage, expliquant ainsi une épaisseur finale plus faible.
Comparaison de l’épaisseur des bioplastiques formulés (Am : amidon, Am/Ncl : amidon/nanocellulose, Am/Pe : amidon/pectine).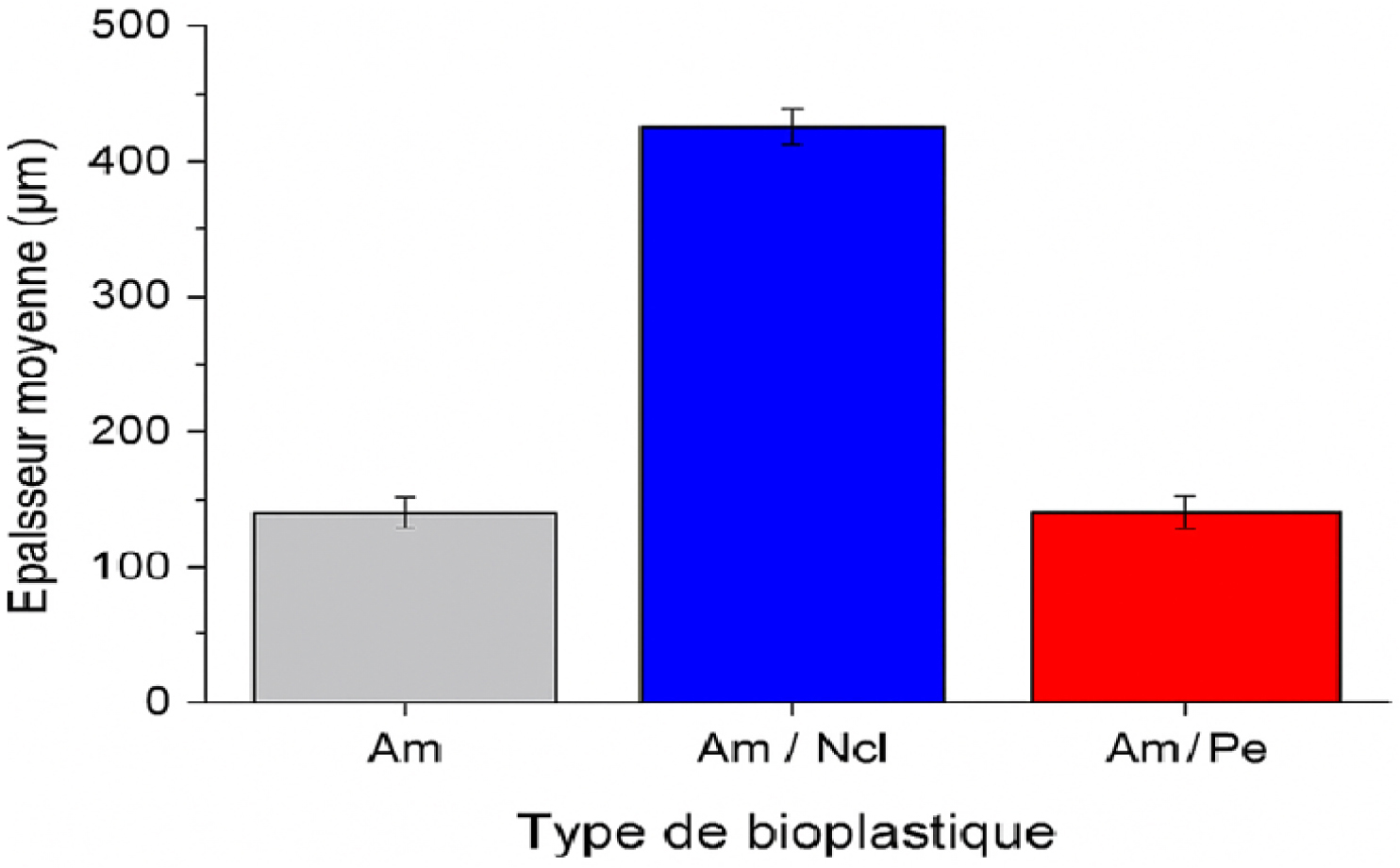
4.3. Identification des biopolymères par spectroscopie Raman
Les spectres Raman enregistrés pour les films bioplastiques à base d’amidon permettent d’identifier les modifications des interactions moléculaires induites par l’incorporation de biopolymères tels que la pectine (Am/Pe) et les nanocristaux de cellulose (Am/NCl). Les résultats correspondants sont présentés à la Figure 3. Ainsi, la comparaison des spectres Raman des films Am, Am/NCl et Am/Pe met en évidence des altérations structurales significatives au sein du réseau polymérique, résultant directement de l’intégration de ces renforts polysaccharidiques.
Spectres Raman de films bioplastiques à base d’amidon, amidon/pectine et amidon/nanocellulose.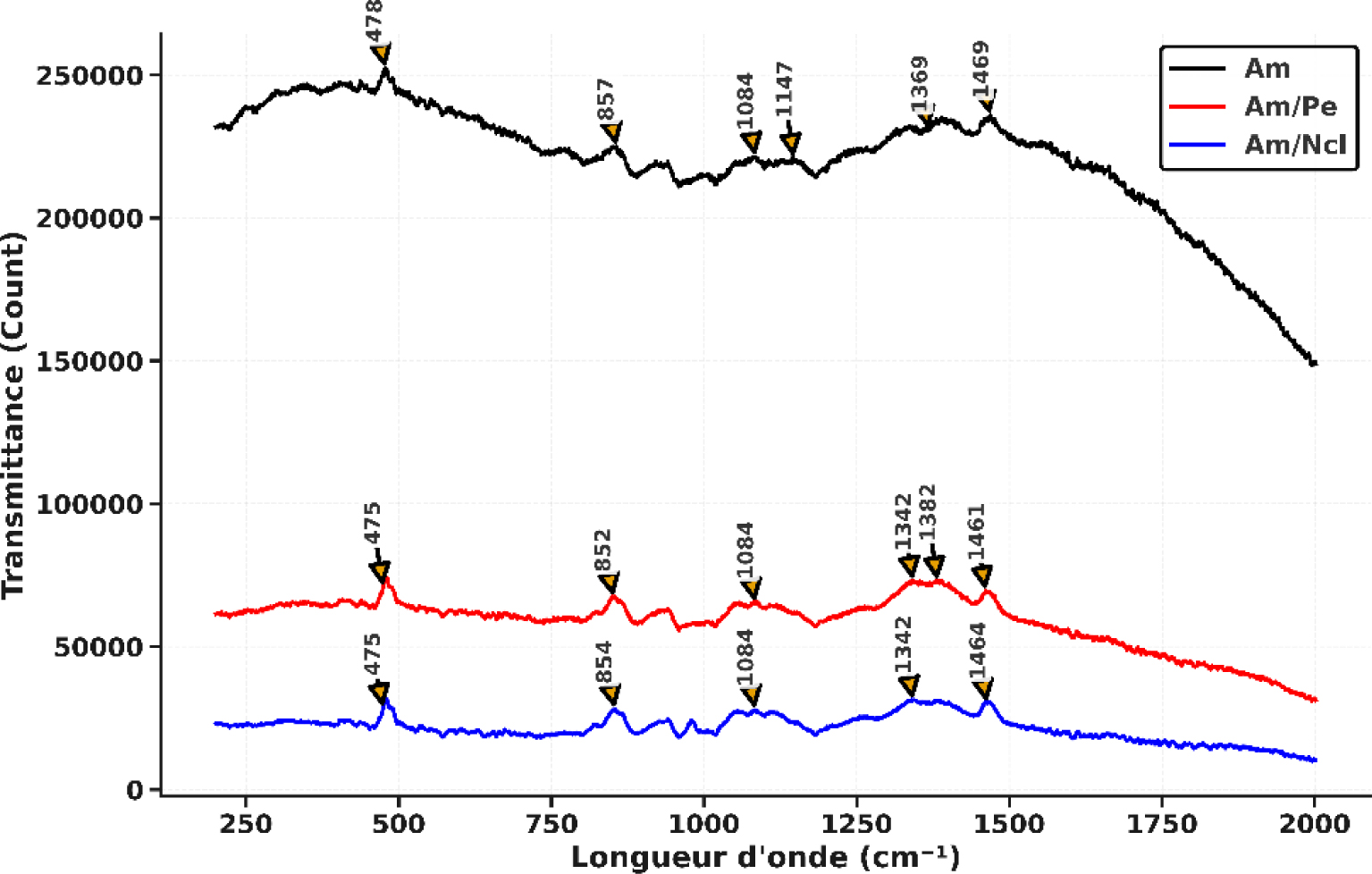
Le spectre Raman de l’amidon natif met en évidence des bandes caractéristiques de la structure du polymère glucidique. La bande à 478 cm−1 est attribuée aux modes de vibration du squelette de l’anneau α-D-glucopyranose, principalement liés aux vibrations C–C–O, marqueurs reconnus de l’amidon [44]. Une seconde bande apparaît à 857 cm−1, correspondant au mode glycosidique du cycle α-glucopyranose, en accord avec les signaux rapportés autour de 865 cm−1 pour l’amylose et les unités anhydroglucose [45]. Les bandes à 1084 et 1147 cm−1 sont respectivement associées aux modes d’élongation des liaisons C–O–C et C–O, signatures de la structure polysaccharidique semi-cristalline, cohérentes avec les assignations Raman établies pour les amidons [46]. Enfin, les bandes situées à 1369 et 1469 cm−1 sont liées aux déformations CH2 et CH du glucopyranose, fréquemment rapportées dans les études Raman et IR portant sur les biopolymères [47]. L’ajout de nanocellulose au sein de la matrice amidon (Am/NCl) conduit à l’apparition de bandes à 854 et 1342 cm−1, caractéristiques de la structure cristalline de la cellulose I, et généralement attribuées aux modes de vibration CH/CH2 et à des modes conformationnels sensibles au degré d’ordre structural, comme le rapportent plusieurs études Raman sur la cellulose nanocristalline [48]. Par ailleurs, le renforcement du pic à 1084 cm−1 indique la formation de liaisons hydrogène entre les groupements hydroxyles de la nanocellulose et ceux de l’amidon, améliorant ainsi les interactions interfaciales. Le renforcement observé dans la région 1084–1095 cm−1, associé aux étirements C–O–C/C–O du cycle glucopyranose, constitue un marqueur spectroscopique bien établi de la cellulose I, en lien direct avec sa cristallinité et l’orientation des nanocristaux dans la matrice [49]. Ces modifications spectrales, notamment l’augmentation d’intensité et les légers déplacements de bande, confirment l’existence d’interactions interfaciales renforcées au sein du système Am/NCl.
Par ailleurs, le spectre du film Am/Pe, contenant de la pectine, révèle des bandes supplémentaires à 852, 1342, 1382 et 1461 cm−1. La bande à 852 cm−1 est attribuée au mode squelette glycosidique des α-anomères, considéré comme un marqueur Raman diagnostique de la pectine, généralement rapporté dans la région 850–856 cm−1 [50]. Les bandes situées à 1342 et 1382 cm−1 correspondent aux déformations CH/CH3 et à des modes conformationnels liés à la micro-organisation des chaînes polysaccharidiques ; ces assignations sont cohérentes avec les signatures Raman de la pectine, observées dans la zone 1340–1380 cm−1 [51]. Enfin, la bande à 1461 cm−1, attribuée aux déformations CH2 (scissoring) et CH3, est typiquement rapportée entre 1450 et 1465 cm−1 dans les polysaccharides et constitue un marqueur des segments aliphatiques de la pectine [52]. Ces nouvelles bandes mettent en évidence l’existence d’interactions hydrogène et électrostatiques entre les groupes acides de la pectine (–COOH/–COO−) et les groupements –OH de l’amidon. Cette interprétation est pleinement cohérente avec les travaux Raman consacrés aux pectines, qui rapportent des variations d’intensité et de déplacement liées à l’environnement et à la cristallinité locale [53].
L’ensemble de ces résultats confirme que l’incorporation de renforts polysaccharidiques induit une restructuration notable du réseau macromoléculaire de l’amidon. La nanocellulose favorise la structuration et la cristallinité via des interactions hydrogène. De leur côté, les chaînes de pectine, porteuses de fonctions carboxyliques/carboxylates, établissent des interactions hydrogène et électrostatiques avec l’amidon, contribuant à une meilleure cohésion interfaciale et à une organisation plus dense du biopolymère.
4.4. Biodégradabilité des bioplastiques
4.4.1. Biodégradabilité des bioplastiques dans l’eau de mer
La Figure 4, représente l’évolution du taux de biodégradabilité des bioplastiques formulés dans l’eau de mer.
Biodégradabilité des bioplastiques dans l’eau de mer.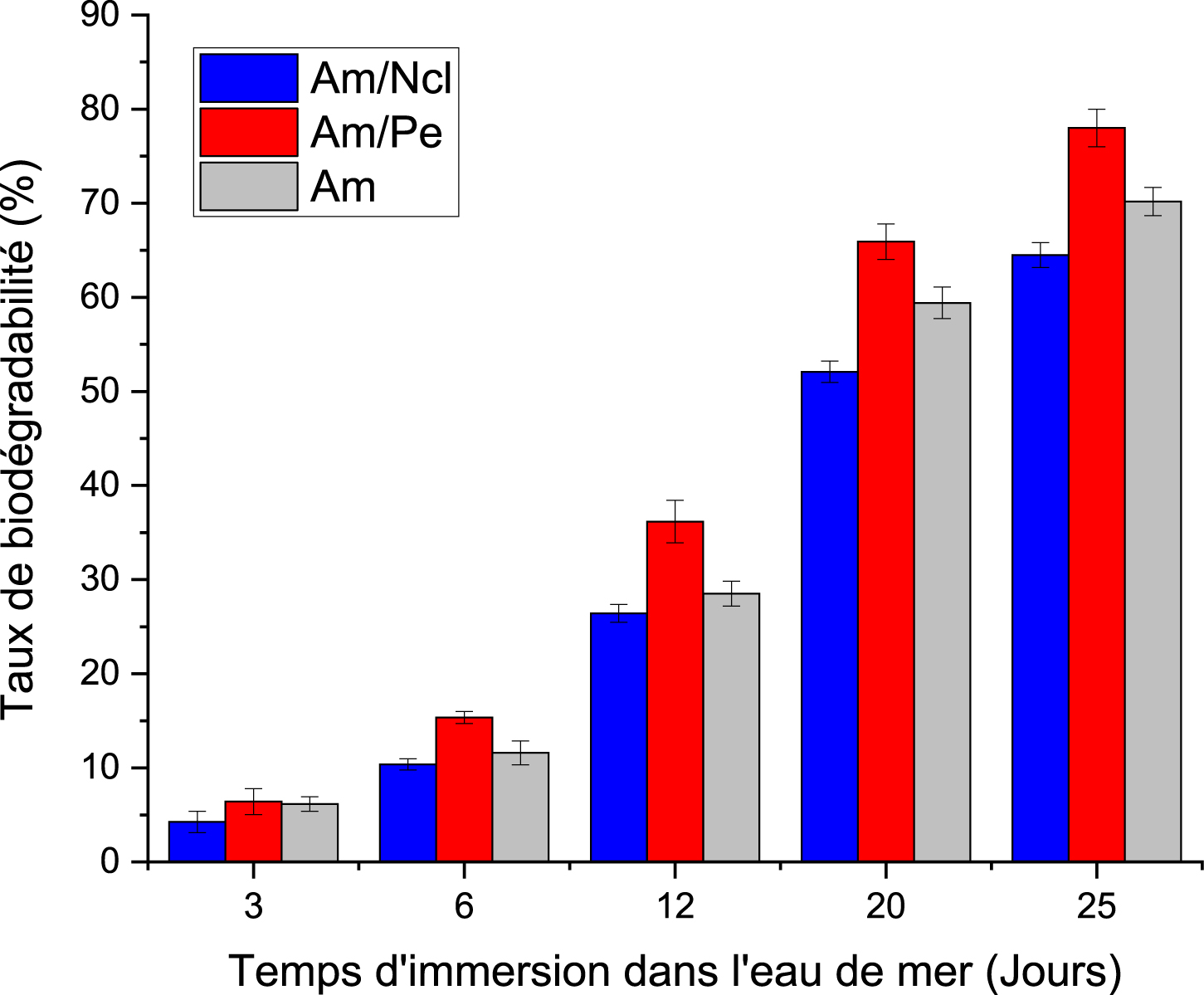
Les trois formulations montrent une dégradation progressive mais incomplète à 25 j, avec la hiérarchie Am/Pe (78 %) > Am (∼70 %) > Am/Ncl (∼64 %). La cinétique initiale est modérée, probablement liée à la période d’acclimatation microbienne et à la formation d’un biofilm avant l’accélération observée après 10 à 12 j, un comportement couramment rapporté pour les polymères biodégradables en milieu marin [54, 55]. Le taux plus élevé de dégradation observé pour le bioplastique amidon/pectine (Am/Pe) s’explique par la structure amorphe et hydrophile de la pectine, qui facilite l’imbibition d’eau et rend la matrice plus accessible aux enzymes hydrolytiques. Ce résultat est en accord avec les observations de Gómez-Aldapa et al., qui rapportent des pertes de masse supérieures à 90 % en 25 à 30 j pour des films à base d’amidon et de pectine exposés à des milieux aqueux [56]. À l’inverse, la nanocellulose, plus rigide et cristalline, confère une barrière structurale limitant la diffusion de l’eau et la dépolymérisation enzymatique, ce qui ralentit la dégradation [57]. Les valeurs globalement plus faibles qu’en sol s’expliquent par les conditions du milieu marin, notamment la salinité élevée, la température plus basse, et la densité microbienne réduite, qui limitent la biodégradation aérobie. Ces paramètres environnementaux sont déterminants dans la cinétique de dégradation et expliquent que les films amidonnés présentent généralement des taux compris entre 60 et 90 % après 20 à 30 j selon la composition et le milieu [58].
4.4.2. Biodégradabilité des bioplastiques dans le sol
La Figure 5, représente l’évolution du taux de biodégradabilité des bioplastiques formulés dans du sol.
Évolution du taux de biodégradabilité des bioplastiques dans le sol.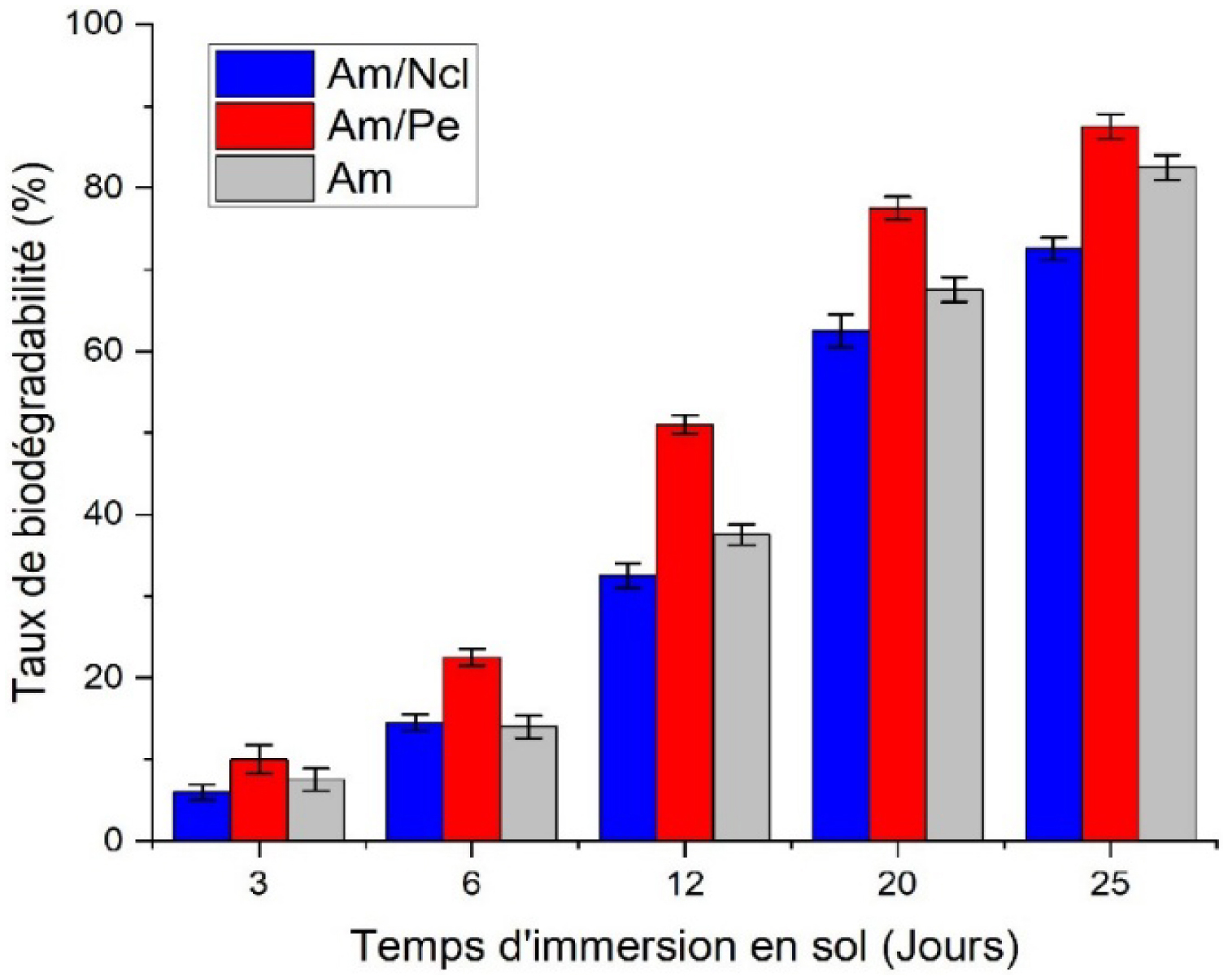
La cinétique de biodégradation des bioplastiques dépend de deux facteurs principaux : le milieu d’exposition et la formulation du matériau. D’une part, les conditions environnementales telles que l’humidité, la température, la teneur en oxygène et la diversité microbienne influencent fortement la vitesse de dégradation en facilitant les processus d’hydrolyse et d’attaque enzymatique [59, 60]. D’autre part, la composition chimique et la structure interne du bioplastique — incluant la nature des polymères, le type de plastifiant, la présence de charges ou de renforts, et le degré de cristallinité — déterminent son accessibilité aux microorganismes et à l’eau [59]. Ainsi, un matériau hydrophile et amorphe se dégrade plus rapidement qu’un réseau dense et cristallin, comme l’ont montré plusieurs études sur les films à base d’amidon, de pectine ou de nanocellulose [57]. Cette interaction entre facteurs environnementaux et propriétés intrinsèques du matériau explique la variabilité observée dans les vitesses de biodégradation des bioplastiques en conditions naturelles.
4.5. Propriétés mécaniques des bioplastiques
Les propriétés mécaniques des films bioplastiques, évaluées à partir des courbes de contrainte-déformation, fournissent des informations clés sur leur résistance, élasticité et comportement sous charge. Ces paramètres, comprenant la résistance à la traction, l’allongement à la rupture et le module d’élasticité, sont essentiels pour caractériser les performances des matériaux en vue de leurs applications finales, notamment dans les secteurs de l’emballage et de l’agriculture. Les résultats correspondants sont présentés sur les Figures 6, 7 et 8.
Allongement à la rupture de divers bioplastiques formulés.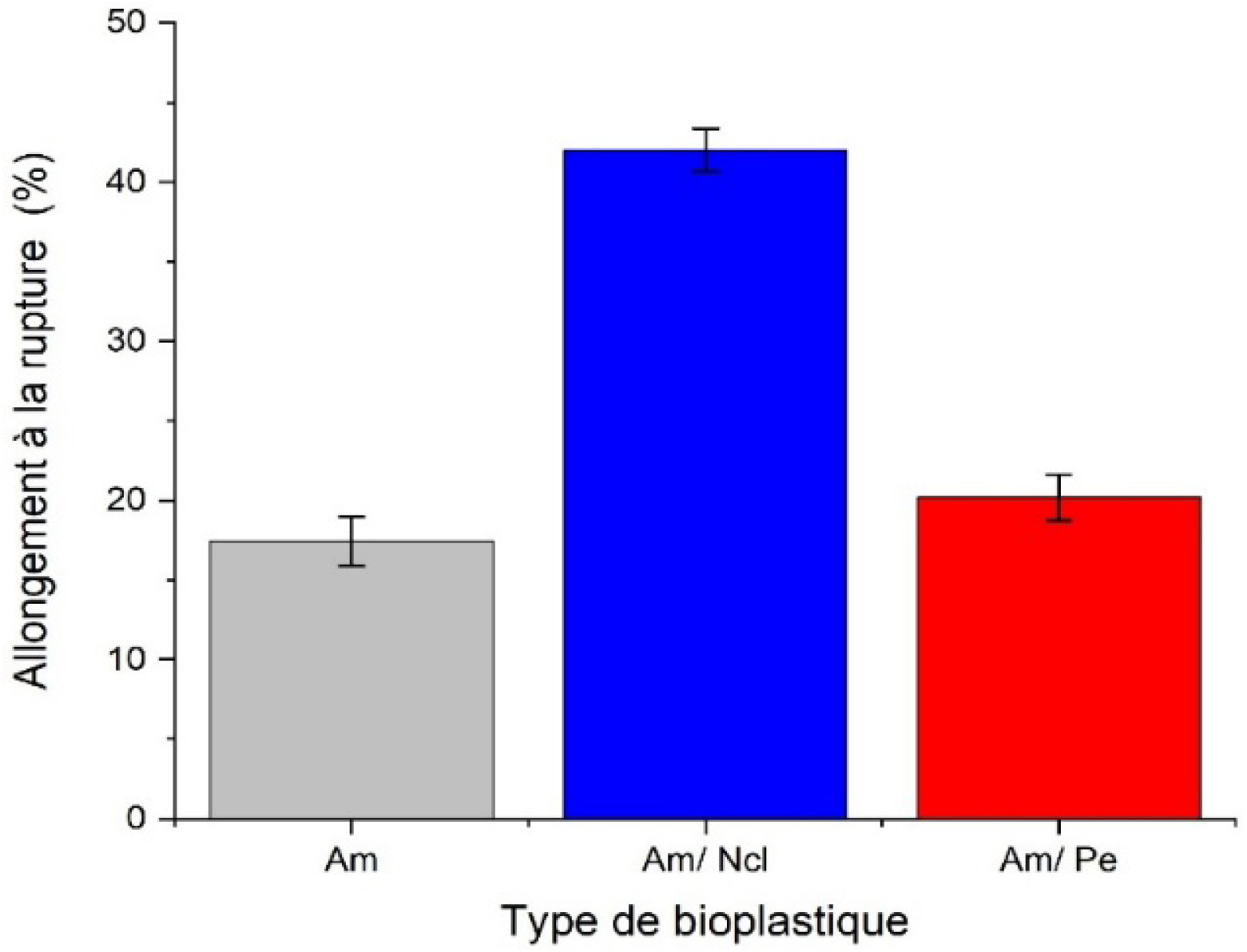
Contrainte à la rupture de divers bioplastiques formulés.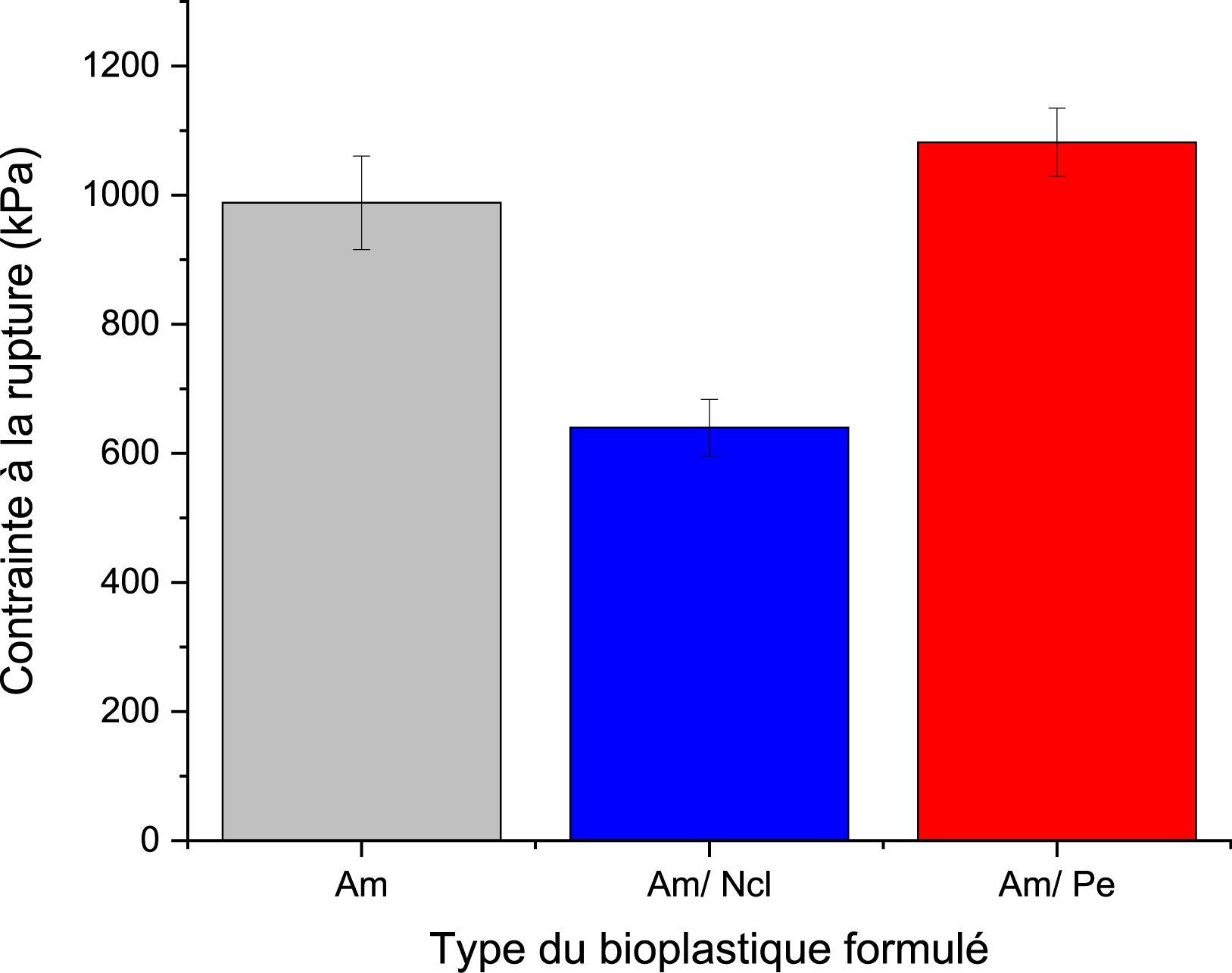
Module d’Young de divers bioplastiques formulés.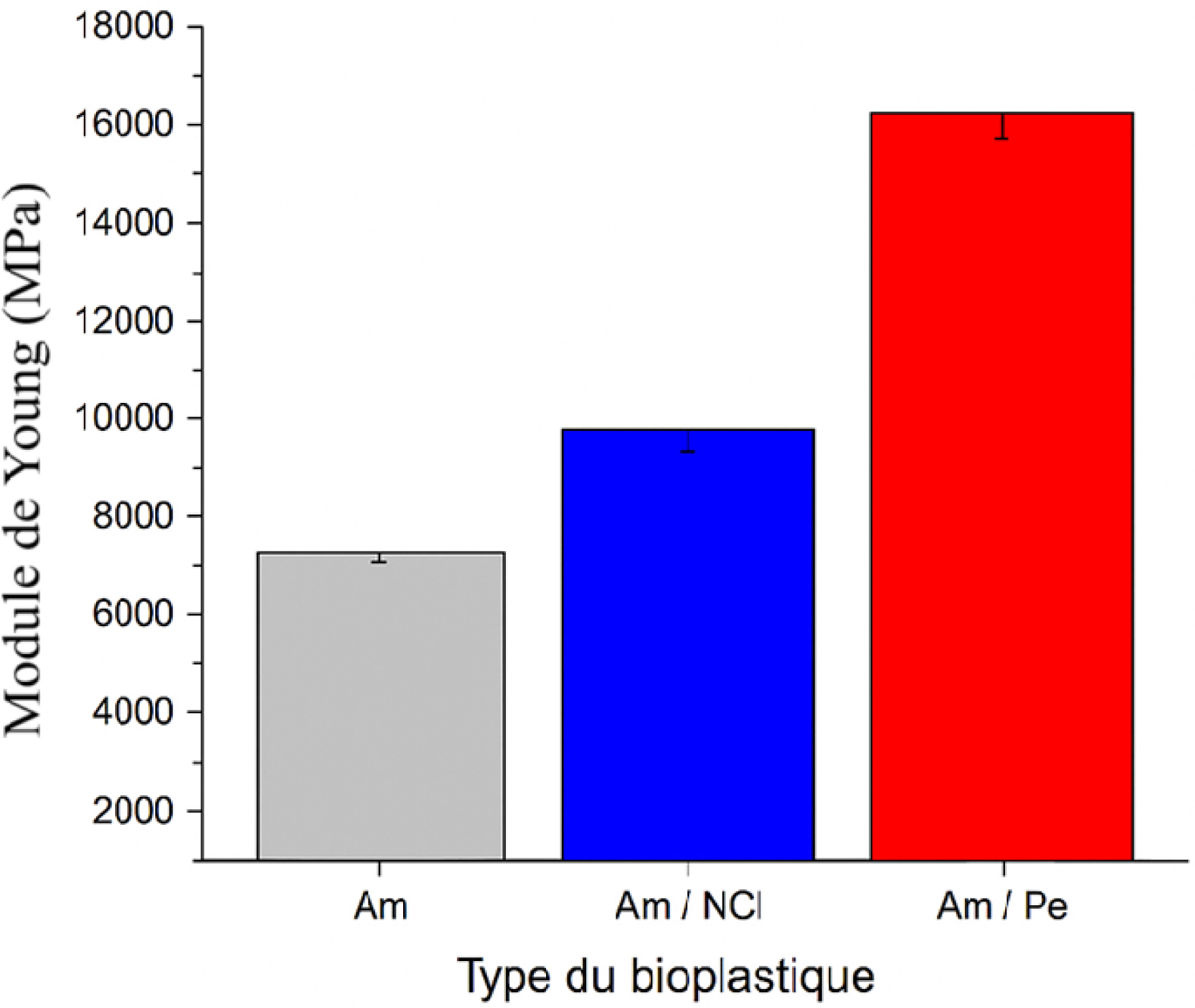
L’histogramme présenté en Figure 6 met en évidence l’impact de la nanocellulose et de la pectine sur l’allongement à la rupture du bioplastique à base d’amidon. Comparativement aux valeurs rapportées dans la littérature, l’amidon plastifié au glycérol présente un allongement à la rupture d’environ 17,5 ± 1,55 %, ce qui se situe dans la plage typique des films plastifiés, généralement comprise entre 10 et 40 % [60]. L’ajout de pectine augmente modérément cet allongement, passant d’environ 17,5 ± 1,55 % à près de 20 ± 1,44 %, soit une augmentation relative de 14,2 %. Selon la littérature [61], l’incorporation de la pectine dans l’amidon ne compromet généralement pas cette propriété mécanique. Au contraire, son effet est le plus souvent neutre ou légèrement positif, selon la pureté de la pectine et la composition de la formulation. Globalement, grâce à sa structure polysaccharidique flexible et à ses propriétés gélifiantes, la pectine favorise une meilleure mobilité des chaînes polymériques, ce qui améliore à la fois l’extensibilité et l’élasticité du bioplastique par rapport à l’amidon pur. D’autre part, le bioplastique à base d’amidon renforcé par 10 % de nanocristaux de cellulose présente un allongement à la rupture d’environ 42,0 ± 1,36 %. Bien que la littérature rapporte le plus souvent une diminution de l’allongement avec l’ajout de nanocellulose [25], ces résultats montrent ici une augmentation significative de la ductilité. Cette divergence peut s’expliquer par une plastification très importante (80 % glycérine), favorisant la mobilité de la matrice, combinée à une dispersion homogène et à une adhésion interfaciale efficaces entre l’amidon et la nanocellulose. Ces facteurs permettent une meilleure transmission des contraintes et des mécanismes de dissipation d’énergie.
Un autre paramètre de l’étude mécanique examiné est la contrainte à la rupture, un indicateur essentiel de la résistance et de la capacité du matériau à supporter une charge avant cassure. Les résultats correspondants sont présentés dans la Figure 7. Les résultats montrent que l’ajout de pectine augmente la contrainte à la rupture du bioplastique d’environ 10 %, tandis que l’intégration de nanocellulose conduit dans notre cas à une diminution d’environ 30 %. Cette différence s’explique par des interactions interfaciales distinctes selon le type de renfort incorporé. En effet, la pectine, riche en groupes –OH et –COO−, peut former des liaisons hydrogène et, en présence éventuelle de Ca2+, des pontages ioniques susceptibles de densifier le réseau amidon/glycérine. Ce comportement est cohérent avec des travaux rapportant une amélioration de la résistance mécanique dans les films amidon/pectine ainsi que l’influence bénéfique du réticulage calcique [62, 63]. À l’inverse, l’effet négatif observé avec la nanocellulose peut s’expliquer par une dispersion incomplète et/ou une compatibilité limitée dans une matrice fortement plastifiée : des agrégats de nanocristaux de cellulose agissent comme sites de concentration de contraintes, phénomène bien documenté dans la littérature, dont l’atténuation nécessite une fonctionnalisation de surface et/ou des procédés de dispersion adaptés (cisaillement, ultrasons, compatibilisants) [64]. Enfin, la valeur intermédiaire obtenue pour l’amidon pur s’inscrit dans les larges plages rapportées pour des films d’amidon plastifiés, sensibles à la teneur et à la nature du plastifiant ainsi qu’aux conditions de mise en œuvre [65, 66, 67].
La troisième propriété mécanique étudiée est le module de Young, qui quantifie la rigidité du bioplastique. Un module élevé indique un matériau plus rigide, capable de mieux résister à la déformation élastique sous contrainte, tandis qu’un module faible reflète une plus grande souplesse et flexibilité. Les valeurs correspondantes sont présentées dans la Figure 8.
Le module de Young de l’amidon pur est de l’ordre de 1270 ± 27,42 kPa, en accord avec les résultats rapportés par Żołek-Tryznowska et al., qui ont indiqué des valeurs comprises entre 800 et 14 200 kPa selon l’origine du biopolymère [68]. De plus, le module de Young met en évidence une forte dépendance au type de renfort. Le bioplastique amidon/nanocellulose montre une rigidité comparable à celle de l’amidon pur, tandis que la formulation amidon/pectine atteint un module d’environ 16 020 ± 9,02 kPa, indiquant une rigidification marquée de la matrice. Ce gain est cohérent avec le rôle de la pectine, dont les fonctions –OH et –COO− favorisent des liaisons hydrogène et, en présence de Ca2+, des pontages ioniques qui densifient le réseau amidon/glycérine et limitent la mobilité des chaînes, ce qui accroît le module élastique [69]. À l’inverse, l’absence d’amélioration avec la nanocellulose suggère des problèmes de dispersion et/ou d’adhésion interfaciale. L’agrégation de nanocristaux de cellulose peut créer des sites de concentration de contraintes et neutraliser l’effet de renforcement attendu, un phénomène bien documenté et généralement atténué par des modifications de surface et des procédés de dispersion appropriés [70].
Globalement, en comparant nos bioplastiques aux plastiques biodégradables modernes utilisés dans l’industrie de l’emballage, tels que l’acide polylactique (PLA d’après l’anglais), on constate que la formulation Am/Ncl en particulier présente une résistance à la traction plus faible mais un allongement à la rupture légèrement supérieur. En effet, le PLA affiche typiquement une résistance à la traction d’environ 35 MPa et un allongement à la rupture voisin de 30 % [68].
4.6. Test d’absorption d’eau
Le test de gonflement permet d’évaluer la capacité des films bioplastiques à absorber l’eau au cours du temps. Ce paramètre constitue un indicateur essentiel du comportement des matériaux en milieu humide ainsi que de leur stabilité dimensionnelle. L’évolution du taux de gonflement reflète à la fois la nature hydrophile de la matrice polymère et l’influence des renforcements incorporés sur la structure du film. La cinétique d’absorption des différents bioplastiques est présentée dans la Figure 9.
Cinétique d’absorption d’eau de diverses formulations bioplastiques.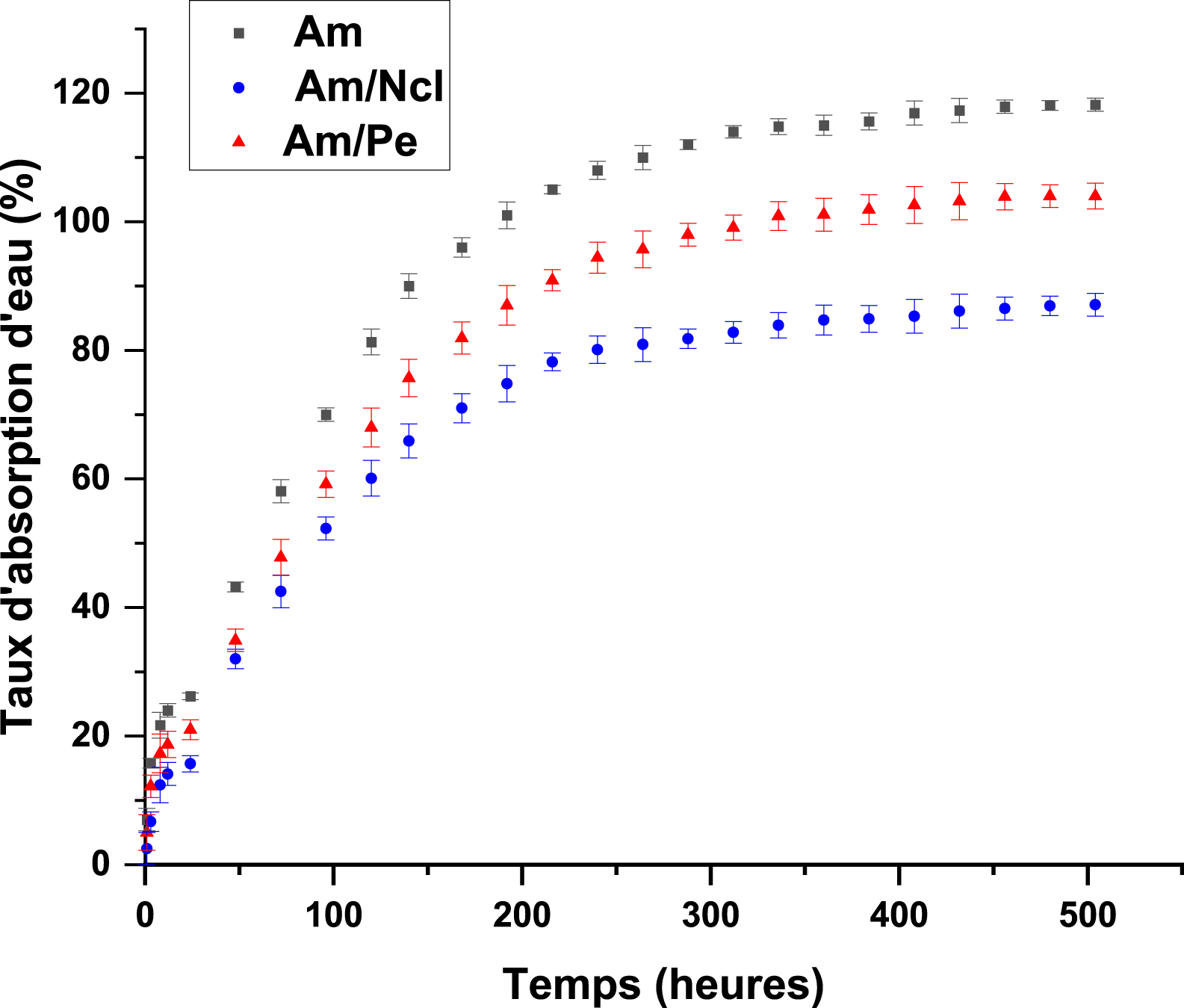
La figure précédente illustre l’évolution du pourcentage de gonflement des films bioplastiques au cours du temps. Pour l’ensemble des formulations étudiées, une augmentation rapide du gonflement est observée aux premières heures, suivie d’une stabilisation progressive après environ 300 à 400 heures. Ce comportement traduit une absorption initiale rapide de l’eau par les films, avant d’atteindre un état de saturation. Toutefois, l’analyse de l’évolution sur 21 j révèle des différences notables entre les formulations :
- Film à base d’amidon pur (Am) : Ce film présente le taux de gonflement le plus élevé, atteignant 118,2 %, ce qui reflète la forte hydrophilie de l’amidon. Cette propriété est attribuée à la présence de groupements hydroxyles abondants dans sa structure, capables de former des liaisons hydrogène avec les molécules d’eau.
- Film amidon/pectine (Am/Pe) : L’incorporation de pectine entraîne une légère diminution du gonflement (104 %). Cette réduction peut être expliquée par la structure ramifiée de la pectine et sa bonne compatibilité avec l’amidon, favorisant la formation d’un réseau homogène qui, bien que perméable, limite légèrement l’absorption d’eau. Le taux de gonflement de 104 % est légèrement inférieur à celui de l’amidon sans renfort, ce qui est cohérent avec les travaux sur des films amidon/pectine montrant que la pectine s’adsorbe sur les granules d’amidon et densifie le réseau par liaisons hydrogène, limitant ainsi le gonflement et la diffusion de l’eau. Des études récentes sur la compatibilisation et la structure des films confirment que l’introduction de pectine peut améliorer les propriétés barrières à l’eau et moduler la solubilité, avec un effet net dépendant de la teneur en pectine et du plastifiant [71, 72].
- Film renforcé par la nanocellulose (Am/Ncl) : Cette formulation présente un taux de gonflement plus faible (87,1 %). Cette diminution s’explique par la structure cristalline rigide des nanocelluloses, qui restreint la mobilité des chaînes d’amidon et freine l’absorption d’eau. De plus, les fortes interactions entre les nanorenforts et la matrice réduisent les espaces libres propices à la diffusion de l’eau, ce qui est en accord avec les travaux de Sneh Punia Bangar et al. [24].
Ainsi, l’ajout de renforts tels que la pectine ou la nanocellulose permet de moduler la sensibilité à l’eau des bioplastiques, une propriété déterminante pour adapter leurs performances aux exigences spécifiques de diverses applications, notamment dans les domaines de l’emballage alimentaire ou des films agricoles.
4.7. Propriétés thermiques
L’analyse thermogravimétrique (ATG) et l’analyse thermogravimétrique dérivée (DTG) du bioplastique à base d’amidon extrait d’épluchures de pommes de terre et plastifié à la glycérine (Figure 10) révèlent une dégradation en quatre étapes principales avec des maximums de perte de masse respectivement aux températures de 70, 204, 283 et 490 °C :
Courbes ATG et DTG du bioplastique à base d’amidon (non renforcé).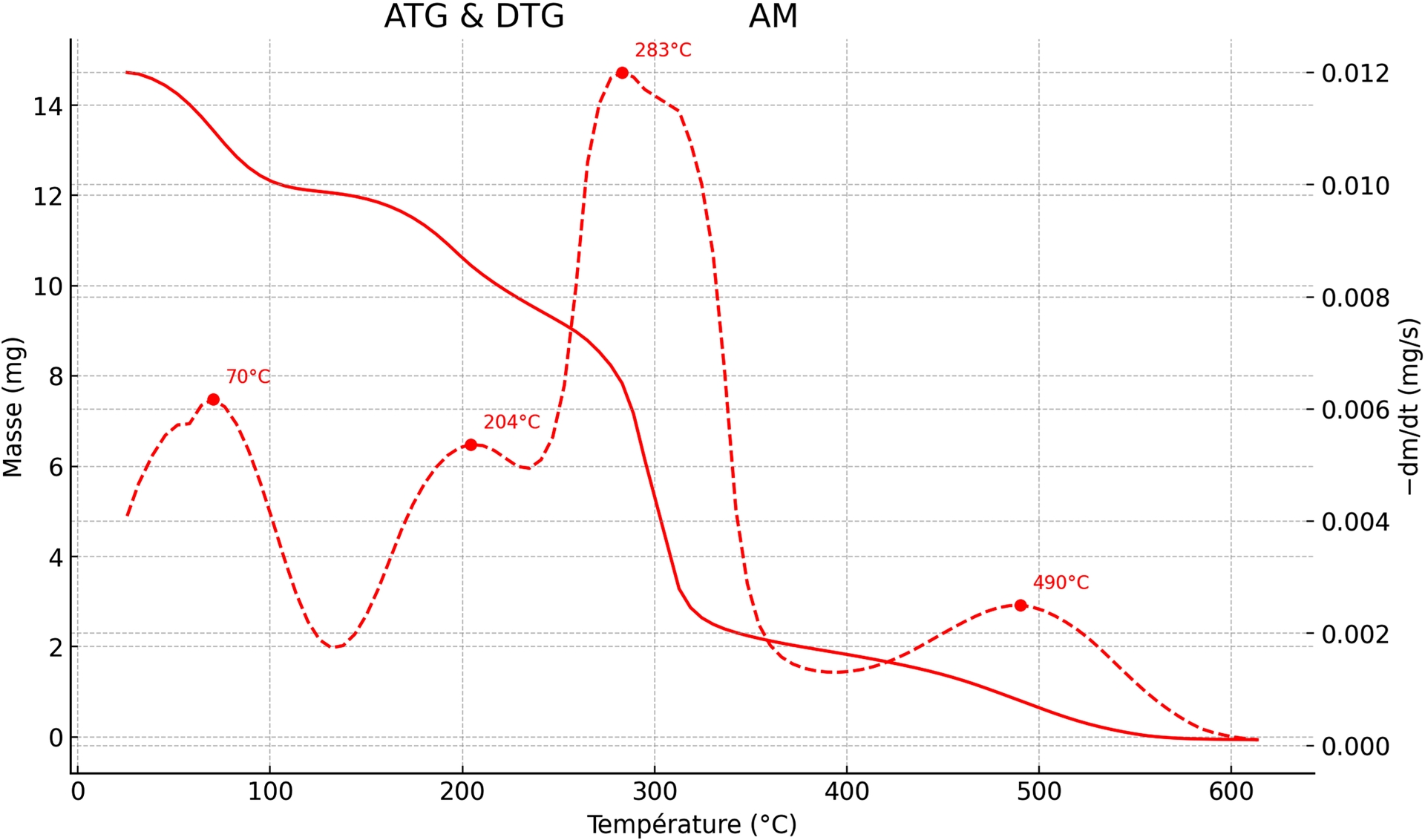
- Étape de 25 à 100 °C : attribuée à la désorption de l’eau libre et faiblement liée, ce qui est cohérent avec la nature hydrophile de la matrice amidon/glycérine [73, 74].
- Étape de 120 à 220 °C : résulte d’une déshydratation chimique précoce du réseau anhydro-glucose ainsi que de la volatilisation ou fragmentation d’une fraction de glycérine, entraînant une perte de masse plus importante qu’à la première étape. en accord avec les observations de C. Fischer [75].
- Étape de 220 à 380 °C : traduit la dépolymérisation de l’amidon, avec rupture des liaisons glycosidiques et formation de produits anhydres et de char. La température maximale (Tmax), légèrement inférieure à celle d’un amidon natif sec, reflète l’effet conjugué du plastifiant et d’une hydrolyse douce provoquée par le traitement acide/base. Un Tmax dans cette gamme est classique selon la littérature [73, 74, 76, 77].
- Étape de 380 à 600 °C : correspond à l’oxydation et à la combustion du char résiduel [74, 75, 76, 77, 78].
Sous atmosphère inerte d’azote, les courbes ATG et DTG d’un film d’amidon renforcé par 10 % de nanocellulose présentent trois étapes caractéristiques (Figure 11) :
Courbes ATG et DTG du bioplastique à base d’amidon (renforcé avec la nanocellulose).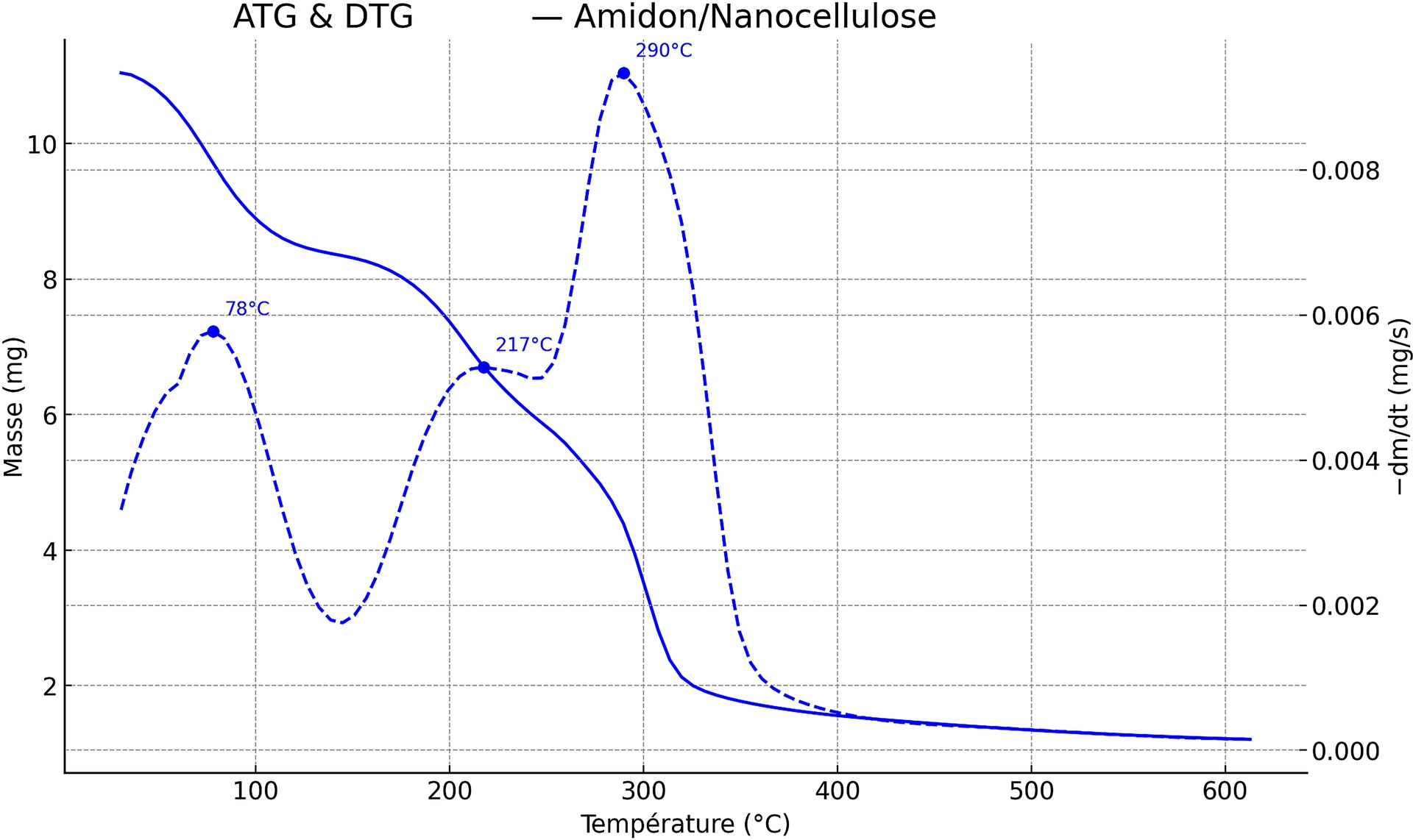
- Un premier événement entre 25 et 100 °C avec un maximum de perte de masse à 78 °C, attribué à la l’évaporation de l’eau libre ou faiblement liée, en accord avec les plages de température inférieures à 120 °C généralement rapportées pour les matrices amidonnées et leurs biocomposites.
- Un palier de perte de masse 150–250 °C avec un maximum à 217 °C qui correspond au début de la déshydratation intramoléculaire et de la dépolymérisation de la matrice. Cette étape est compatible avec les signatures TGA typiques de l’amidon [74].
- La dernière perte de masse entre 250 et 600 °C avec un maximum à 290 °C, traduit la pyrolyse majeure de l’amidon et de la (nano)cellulose. Cette valeur se situe dans l’intervalle 270–320 °C classiquement observée pour les TPS (thermoplastic starch ou amidon thermoplastique) et peut se décaler légèrement vers des températures plus élevées lorsque la nanocellulose est bien dispersée et interagit par liaisons hydrogène (effets barrière et de cristallinité) [73].
À 600 °C, le résidu (9–10 %) s’explique par la formation de char et la présence éventuelle de sels minéraux issus de l’hydrolyse sulfurique et de la neutralisation. Ce phénomène est fréquemment observé lorsque les nanocelluloses portent des groupes sulfate demi-esters, connus pour abaisser la stabilité thermique intrinsèque des nanocelluloses, tandis qu’une bonne interfacialité amidon–nanocellulose peut compenser cet effet au sein du composite. Ces observations concordent avec les travaux récents portant sur les films biocomposites d’amidon renforcés par la nanocellulose [24].
L’introduction de 10 % de nanocellulose issue d’hydrolyse sulfurique décale le pic DTG principal d’environ 7 °C (283 → 290 °C) et repousse l’étape précoce d’environ 13 °C, en accord avec les études rapportant un effet de rigidification de la matrice lié aux liaisons hydrogène entre l’amidon et la nanocellulose. Le résidu accru à 600 °C s’explique par la formation de char et la présence possible de sels de sulfates résiduels. Ces résultats sont cohérents avec les travaux récents sur les bioplastiques à base d’amidon renforcés par la nanocellulose, qui soulignent l’influence déterminante des groupes sulfate demi-esters sur la stabilité thermique et l’adhésion interfaciale au sein des composites [24].
Les thermogrammes ATG et DTG sous atmosphère d’azote du film d’amidon renforcé par 10 % de pectine (Figure 12) révèlent un processus de dégradation thermique en trois étapes, chacune associée à la perte de différents composants (eau, plastifiants, et les biopolymères eux-mêmes) :
Courbes ATG et DTG du bioplastique à base d’amidon renforcé avec de la pectine.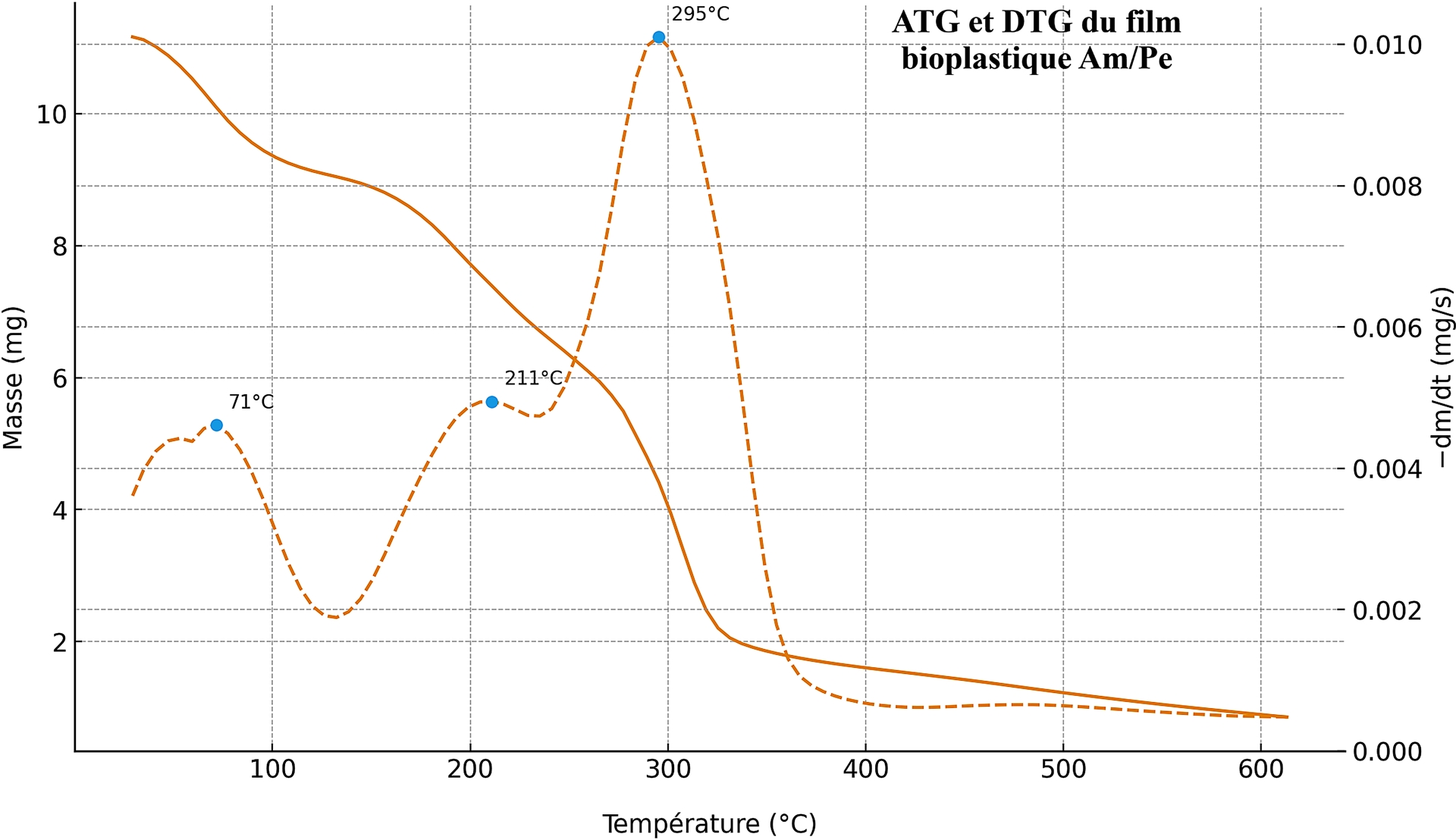
- La première étape entre 25 et 100 °C avec un maximum de perte de masse à 71 °C, attribué à l’évaporation de l’eau libre (faiblement liée), en accord avec les TGA de pectines et de systèmes amidonnés [79, 80].
- Un palier de 150 à 220 °C, correspondant aux débuts de déshydratation intramoléculaire, de déméthoxylation/décarboxylation de la pectine et aux premières scissions glycosidiques de l’amidon, plage classiquement observée pour la pectine (∼210–270 °C) et confirmée pour les pectines d’agrumes [79, 80].
- Une dernière étape entre 220 et 600 °C avec un maximum de perte de masse à 295 °C, traduisant la pyrolyse majeure de la matrice amidonnée (avec co-décomposition de la pectine), valeur située dans l’intervalle 270–320 °C rapporté pour les films d’amidon thermoplastique, souvent peu modifiée ou légèrement relevée lorsque la pectine interagit efficacement par liaisons hydrogène avec l’amidon. À 600 °C, le résidu (∼8–10 %) s’explique par la formation de char et par la fraction minérale intrinsèque des pectines d’agrumes (K+/Ca2+), éventuellement accrue par les sels générés lors de la formulation alcaline ; un comportement déjà signalé pour des films pectine/amidon [81, 82].
5. Conclusion
Cette étude a permis de développer et de caractériser des films bioplastiques à base d’amidon extrait de pelures de pommes de terre, renforcés par deux biopolymères d’origine naturelle, la pectine issue des pelures d’orange et la nanocellulose extraite de la paille, valorisant ainsi des sous-produits agro-industriels dans une démarche d’économie circulaire.
Les analyses réalisées ont montré que l’incorporation de ces renforts modifie de manière significative les propriétés physico-chimiques et fonctionnelles des bioplastiques. Sur le plan thermique, les films renforcés présentent une meilleure stabilité, traduite par un décalage des températures de dégradation vers des valeurs plus élevées, particulièrement pour la formulation amidon/pectine. Au niveau mécanique, la pectine améliore la rigidité et la résistance du matériau, tandis que la nanocellulose, bien que prometteuse, nécessite une dispersion plus homogène afin d’exprimer pleinement son potentiel de renforcement. Les tests d’absorption d’eau et de biodégradabilité ont confirmé le caractère hydrophile des matrices et leur capacité de dégradation rapide en milieux naturels, soulignant leur compatibilité environnementale.
Comparativement aux plastiques conventionnels non biosourcés, ces bioplastiques présentent des avantages environnementaux majeurs (biodégradabilité, origine renouvelable), tout en atteignant des performances mécaniques et thermiques satisfaisantes pour des applications d’emballage à usage limité ou agricole. Toutefois, leur sensibilité à l’eau et leur stabilité dimensionnelle restent à optimiser pour une compétitivité industrielle accrue.
En perspective, des travaux futurs viseront à améliorer la dispersion des renforts (par traitement de surface ou procédés de mélange avancés), à adapter la formulation à d’autres matrices polysaccharidiques (telles que la cellulose, la chitosane ou la gomme arabique) et à évaluer le comportement des films dans des conditions industrielles réelles, notamment en procédés de thermoformage ou d’emballage alimentaire. Ces approches permettront d’élargir le champ d’applications des bioplastiques biosourcés et de consolider leur position comme alternative durable aux polymères pétrosourcés.
Déclaration d’intérêts
Les auteurs ne travaillent pas, ne conseillent pas, ne possèdent pas de parts, ne reçoivent pas de fonds d’une organisation qui pourrait tirer profit de cet article, et n’ont déclaré aucune autre affiliation que leurs organismes de recherche.






 CC-BY 4.0
CC-BY 4.0