Abridged English version
The functional integrity of living organisms depends on their ability to maintain their internal variables synchronized to environmental factors. In mammals, this property is under the control of interconnected neural structures, where the pineal gland constitutes the last relay. This gland responds to the alternating 24 h light/dark cycles by the release of melatonin hormone at night. Numerous studies show a loss of circadian rhythmicity in aging organisms. Correspondingly, pineal melatonin secretion is gradually declined.
The Greater White-toothed shrew Crocidura russula appears as an ideal study model to test the effects of aging on biological clocks; its lifespan is short and is substantially increased in captivity; its daily and seasonal rhythms, while very marked the first year of life, are dramatically altered during the senescence process which starts during the second year. In the present work, we want to know if the loss of rhythmicity and the reduced melatonin levels registered by the second year of life in this species could be associated to modified ultrastructural features of the pineal parenchyma, site of melatonin synthesis. Nine shrews from livestock (photoperiod: 12L/12D; temperature 22 ± 2 °C) were used. Pineals from three young (1–4 months) and three senescent (25–28 months) individuals were collected and studied by transmission electron microscopy analysis. Three whole brains were fixed in Bouin fluid and embedded in paraffin to study the topographic progress of the gland on frontal serial sections.
Anatomically, the pineal tissue is present in a single cone shaped mass; extending between the habenular commissure and posterior commissure and covering the roof of the IIIrd ventricle.
In young individuals, pineal parenchyma shows two populations of pinealocytes (PI and PII) distinguished by the density of their nucleus and cytoplasm. Interstitial spaces are occupied by fibroblast-like cells and collagen fibers and numerous neuropile elements filled with microtubules and nerve endings containing microvesicles and dense core vesicles. Clear pinealocytes (PI), the most numerous cells, are characterized by a developed Golgi and large clear associated vacuoles apparently conveyed to their extensions and bulbous endings. In the PII cells, perinuclear space is dilated and the granular reticulum cisternae well developed with moderate Golgi activity. These features suggest that PI and PII cells are an expression of two functional states of a single type of PIs.
In aging individuals, cytological characteristics of PI cells are altered. In the nucleoplasm, we note accumulation of compact inclusions and a modified nucleolus size and shape. Cytoplasm becomes heterogeneous by the apparition of densified regions. A gritty material sometimes associated to crystalloid fibrils accumulates inside and outside mitochondria. In the dilated lumen of reticulum, cisterns can be observed one or several dense granules. The activity of dictyosomes is markedly reduced and clear vacuoles are almost absent. Increased number of dense bodies seems to participate with altered mitochondria and lipid globules to the formation of big and heteromorphic concretions. As a whole, the changes observed suggest a slower pinealocyte metabolism during the aging process. These observations confirm the decline of melatonin levels registered in aging shrews.
1 Introduction
L’intégrité fonctionnelle des organismes vivants dépend du maintien de la synchronisation des différentes variables oscillatoires internes au rythme environnemental. Il est bien établi que les noyaux suprachiasmatiques (NSC) de l’hypothalamus et la glande pinéale des mammifères jouent un rôle essentiel dans la régulation des fonctions rythmiques journalières (rythmes de veille sommeil, d’activité locomotrice) et saisonnières (reproduction, croissance) [1–5]. Les NSC sont le siège de l’horloge biologique circadienne dont l’activité est synchronisée sur le cycle lumière/obscurité de 24 heures ; l’information photopériodique est captée par un petit groupe de cellules ganglionnaires de la rétine dont les axones constituent le tractus rétino-hypothalamique innervant les NSC. L’activité rythmique des NSC est transmise à la glande pinéale via une voie nerveuse complexe dont le dernier relais est situé dans les ganglions cervicaux supérieurs, lesquels envoient une innervation catécholaminergique vers la glande. La libération nocturne de noradrénaline stimule la production de mélatonine. Le profil nocturne de la sécrétion de mélatonine est une constante chez tous les vertébrés, même si les systèmes de contrôle de sa production ont été profondément modifiés au cours de l’évolution : ils sont passés progressivement d’une sensibilité directe à la lumière dans la pinéale des ectothermes au mode indirect décrit plus haut dans celle des mammifères [6,7]. Ainsi, la mélatonine est le donneur de temps interne des vertébrés, ou aiguille hormonale des horloges biologiques. Chez les mammifères, les deux cibles majeures de la mélatonine sont les NSC eux-mêmes et des cellules de la pars tuberalis de l’adénohypophyse [8,9].
De nombreuses études chez l’animal montrent une perte de la rythmicité circadienne au cours du vieillissement [10,11] qui se traduit par une altération des rythmes de veille/sommeil, des déficiences de la locomotion et de l’attention, voire des capacités cognitives [12–14]. Cette altération peut avoir des causes multiples, telle la perte de la photosensibilité rétinienne ou une dégénérescence des neurones du NSC (au demeurant peu nombreux) [15,16] ; l’absence de signal catécholaminergique rythmique en résultant entraînerait une perte du rythme d’activité de la pinéale. Par ailleurs, il a été montré que la sécrétion pinéale de mélatonine diminue progressivement au cours de l’âge chez les mammifères (hamsters [17,18], rat [19,20]) dont l’Homme [21]. Mais cette perte pourrait aussi venir d’une dégénérescence des cellules pinéales elles-mêmes sans qu’il y ait nécessairement altération de la rétine ou du NSC. À l’appui de cette hypothèse, l’âge entraîne une diminution de la sécrétion de mélatonine également chez le poisson zèbre [22], chez lequel la production de mélatonine est indépendante du NSC [23]. Relativement peu de données concernent la glande pinéale des animaux vieillissants. En dehors de la perte du rythme de production de la mélatonine ont été notées une diminution du nombre des récepteurs β à la noradrénaline, et quelques altérations de structure concernant la forme du noyau, une diminution du nombre de certains organites cytoplasmiques (en particulier le réticulum endoplasmique), une augmentation du tissu conjonctif, des lysosomes et de la calcification [24,25].
La musaraigne musette, Crocidura russula, est particulièrement intéressante pour les études sur le vieillissement. En effet, elle présente une durée de vie très courte (14 à 18 mois) dans la nature qui se trouve prolongée en captivité. Les individus peuvent en effet survivre jusqu’à l’âge de 26 à 30 mois. L’ensemble des traits de vie sont maintenus en captivité, seule la phase de sénescence se trouve allongée. La perte avec l’âge (dès la deuxième année) des activités rythmiques journalières et saisonnières est bien documentée chez cette espèce : on note une chute des taux de mélatonine plasmatique et glandulaire nocturnes, une arythmie de l’activité locomotrice, du métabolisme et de la prise de nourriture sur la journée [26,27]. De plus, l’administration de mélatonine dès l’âge de 1 an ralentie la dégradation du rythme d’activité locomotrice liée à l’âge [27]. Dans cette perspective, il nous a semblé intéressant de comparer la structure de la glande pinéale de musaraignes jeunes et âgées.
2 Matériel et méthodes
Des crocidures du genre C. russula capturées dans la région de Banyuls-sur-Mer (Pyrénées-Orientales, France) ont été maintenues en élevage dans l’animalerie du Centre d’Écologie Évolutive et Terrestre de l’Observatoire Océanologique. Dans la chambre, la température est de 22 ± 2 °C, la photopériode de 12L : 12D (La phase claire débutant à 7 h 00). Ce cycle standard écarte l’effet connu des photopériodes courte et longue sur les caractéristiques cytologiques de la glande pinéale. L’accès à la nourriture et à l’eau de boisson est libre.
Au total, 9 individus de la génération F1 d’âge connu ont été utilisés. Pour l’étude ultrastructurale de la glande pinéale, des musaraignes jeunes de 1 à 4 mois (n = 3) et sénescentes de 25 à 28 mois (n = 3) ont été sacrifiées par décapitation pendant la phase lumineuse (entre 14 h et 16 h), les glandes pinéales ont été prélevées et rapidement plongées dans une solution contenant 4 % de paraformaldéhyde (préparé extemporanément) et 2,5 % de glutaraldéhyde dans un tampon phosphate à 0,1 M à un pH de 7,3. Après une nuit à 4 °C, elles ont étés rincées dans le tampon et post-fixées dans une solution de tetroxyde d’osmium (OsO4) à 1 % (1 h à Température ambiante). Après déshydratation à l’alcool, les glandes ont été incluses dans l’Araldite. Les coupes ultrafines, obtenues sur un ultramicrotome LKBIII (Leica), ont été observées au microscope électronique (HITACHI 7500) après contraste à l’acétate d’uranyle et au citrate de plomb [28]. Sur trois autres individus, le cerveau a été prélevé en entier, fixé dans le liquide de Bouin [29], puis inclus dans la paraffine (Paraffin Wax Riedel-de Haën). Les blocs ont été débités en coupes sériées frontales de 5 μm d’épaisseur et colorées à l’azan de Heidenhein pour l’étude de l’évolution topographique de la glande pinéale.
3 Résultats
3.1 Anatomie de la glande pinéale de Crocidura russula
L’analyse de coupes sériées frontales d’encéphales de crocidures montre que le parenchyme pinéal se présente en une entité unique coniforme s’étendant dans le plan antéropostérieur entre la commissure habénulaire (Fig. 1A) et la commissure postérieure (Fig. 1 C). La glande est à son expansion maximale à la verticale de la région moyenne de l’épithalamus ; de section sphérique, elle recouvre le toit du troisième ventricule et reste reliée aux noyaux habénulaires latéraux par la commissure habénulaire (Fig. 1B).
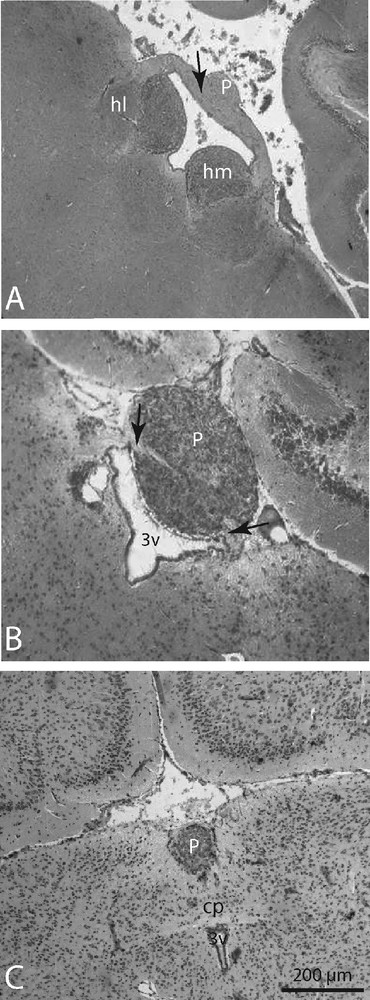
Micrographies de microscopie photonique sur coupes sériées frontales d’épithalamus montrant la progression du tissu pinéal chez Crocidura russula. Dans sa partie proximale (A), la glande pinéale (P) de forme ovoïde est au contact de la commissure interhabénulaire (flèche), qui la relie latéralement aux noyaux habénulaires médians (hm). Dans sa partie moyenne (B), la glande (P) est à son expansion maximale ; de forme sphérique elle coiffe le IIIe ventricule (3 V) auquel elle est raccordée par les fibres commissurales (flèche). Postérieurement (C) la glande (P) régresse, prend la forme d’un cône inversé et devient séparée du IIIe ventricule (3 V) par la commissure postérieure (cp). Noyaux habénulaires latéraux (nl). Masquer
Micrographies de microscopie photonique sur coupes sériées frontales d’épithalamus montrant la progression du tissu pinéal chez Crocidura russula. Dans sa partie proximale (A), la glande pinéale (P) de forme ovoïde est au contact de la commissure interhabénulaire (flèche), ... Lire la suite
Frontal serial sections micrographs of the epithalamus showing the progress of the pineal gland in Crocidura russula. In the proximal part (A), the pineal gland (P) of ovoid shape is in contact with the interhabenular commissure (arrow) which connect laterally to the lateral habenular nuclei (hl). In the middle of the epithalamus (B), the gland is at its maximum expansion. Spherical in shape, it caps the IIIrd ventricle (3 V) to which it is connected by commissural fibers (arrow). In the back part (C), the gland (P) declines and takes a shape of inverted cone. It becomes separated from the IIIrd ventricle (3 V) by the posterior commissure (CP). Masquer
Frontal serial sections micrographs of the epithalamus showing the progress of the pineal gland in Crocidura russula. In the proximal part (A), the pineal gland (P) of ovoid shape is in contact with the interhabenular commissure (arrow) which ... Lire la suite
3.2 Modifications ultrastructurales du parenchyme pinéal au cours de l’âge
L’analyse comparée des coupes provenant des crocidures jeunes et âgées montre des différences entre les deux groupes.
3.2.1 Chez les jeunes crocidures (1 à 4 mois)
Le parenchyme pinéal renferme deux populations de pinéalocytes qui se distinguent par leur densité aux électrons. Ceux à noyau et cytoplasme clairs, les plus nombreux, correspondent aux pinéalocytes clairs ou pinéalocytes de type I (PI). Ils sont caractérisés par un corps cellulaire polygonal ou ovalaire qui émet un fin prolongement long et sinueux, leur noyau présente de profondes indentations et renferme une chromatine finement dispersée. Le nucléole est proéminent et bien ségrégé (Fig. 2A). Le cytoplasme des PI renferme de nombreuses mitochondries, des profils ergastoplasmiques et plusieurs dictyosomes (Fig. 3A). Ces derniers paraissent très actifs, leurs saccules souvent dilatés sont associés à de petites vésicules claires (Fig. 3B) qui semblent fusionner pour donner naissance à de larges vacuoles dont le contenu prend un aspect floculent (Fig. 3 C). Ces vacuoles seraient véhiculées du corps cellulaire (Fig. 4A) et tout le long des prolongements pour s’accumuler au niveau des terminaisons pinéalocytaires bulbeuses. Elles pourraient constituer un produit de sécrétion de ces cellules (Fig. 4B et C).

Micrographies de microscopie électronique du parenchyme pinéal jeune. La vue d’ensemble (A) montre des pinéalocytes d’aspect clairs (PI) nombreux à noyaux indentés et nucléoles proéminents (nl), des pinéalocytes sombres (PII) moins nombreux et plus petits, des cellules interstitielles (Ci) en bordure des espaces vasculaires (*). Entre les corps cellulaires s’observent des sections de terminaisons pinéalocytaires (tête de flèche) et des terminaisons nerveuses (flèches). Celles-ci (encart) renferment des vésicules à cœur dense (petite flèche) et de nombreuses microvésicules (grandes flèches). Au fort grossissement (B), le corps cellulaire du pinéalocyte sombre (PII) montre un nucléoplasme dense, un espace périplasmique dilaté (petites flèches), un réticulum endoplasmique développé (grandes flèches), des dictyosomes courts (D) et des mitochondries nombreuses (m). Noter les sections de leurs prolongements et terminaisons (tête de flèche) plus opaques que celles des PI. Masquer
Micrographies de microscopie électronique du parenchyme pinéal jeune. La vue d’ensemble (A) montre des pinéalocytes d’aspect clairs (PI) nombreux à noyaux indentés et nucléoles proéminents (nl), des pinéalocytes sombres (PII) moins nombreux et plus petits, des cellules ... Lire la suite
Young pineal parenchyma electron micrographs. Overview (A) parenchyma shows numerous clear pinealocytes (PI) with highly folded nucleus and prominent nucleolus (nl), dark pinealocytes (PII) are fewer and smaller, interstitial cells (Ci) borders the vascular spaces (*); between cell bodies are seen sections of pinealocyte (arrow head) and nerve (arrow) endings. Nerve ones (insert) contain numerous microvesicles (big arrow) and dense core vesicles (small arrow). High magnification (B) of dark pinealocyte (PII) pericarya showing denser nucleoplasm and dilated periplasmic space (small arrow), well developed endoplasmic reticulum (big arrow), short dictyosomes (D) and numerous mitochondria (m). Note the sections of their processes and endings (arrow head) are more opaque than those of PI. Masquer
Young pineal parenchyma electron micrographs. Overview (A) parenchyma shows numerous clear pinealocytes (PI) with highly folded nucleus and prominent nucleolus (nl), dark pinealocytes (PII) are fewer and smaller, interstitial cells (Ci) borders the vascular spaces (*); between cell ... Lire la suite

Organites caractéristiques des PI. (A), mitochondries (m) et dictyosomes (D), noyau (N) riche en euchromatine est fortement indenté. Profils ergastoplasmiques courts et peu abondants (flèche). Au fort grossissement (B et C), les dictyosomes golgiens (D) montrent des saccules dilatés associées à plusieurs vésicules claires (flèche) qui semblent fusionner (petites flèches) pour former de larges vacuoles (V) à contenu floconneux.
Organelles typically present in PI Cell body are indicated (A), mitochondria (m), dictyosomes (D), infolded nucleus (N) rich in euchromatin, few short cisterns of endoplasmic reticulum (arrow). High magnification (B and C micrographs) show, widened Golgi saccules (D) surrounded by numerous clear vesicles (arrows), note their possible fusion (small arrow) forming large vacuoles containing flocculent material (V).

Les vacuoles claires (V) semblent transportées grâce aux faisceaux de microtubules (*) du corps cellulaire (A) le long des prolongements (B) pour s’accumuler dans les terminaisons bulbeuses (C). Noter l’absence de ces vacuoles des prolongements de PII environnants (tête de flèche). Réticulum granulaire (rer) ; mitochondries (m).
Micrographs indicating the possible transport of clear vacuoles (v), on bundles of microtubules (*) from the cell bodies (A) along the processes (B) to accumulate in the bulbous endings (C). Note the absence of these vacuoles in the surrounding PII processes (arrow head). Endoplasmic reticulum (rer), mitochondria (m).
Les pinéalocytes de la deuxième population sont d’aspect dense, ils correspondent aux pinéalocytes sombres ou pinéalocytes de type II (PII). Moins nombreux que les PI, ils sont de plus petite taille et leur noyau plus riche en héterochromatine compte un à deux nucléoles. Leur cytoplasme renferme un réseau ergastoplasmique plus développé que celui des PI, des mitochondries aussi nombreuses et des dictyosomes courts et épars (Figs. 1A et B). En plus des éléments du neuropile, s’observent des terminaisons nerveuses (Fig. 2A) caractérisées par la présence de vésicules à cœur dense et de nombreuses microvésicules (Fig. 2A encart). Les cils et les rubans synaptiques, structures habituellement décrites dans la glande n’ont pas été observés dans les pinéalocytes de cette espèce.
3.2.2 Chez les crocidures âgées (25 à 28 mois)
Le tissu pinéal montre de profondes modifications aussi bien au niveau nucléaire que cytoplasmique (Fig. 5) par rapport aux jeunes spécimens. Les noyaux sont à contours réguliers. Dans leurs nucléoplasmes pâle s’observent plusieurs inclusions d’aspect compact suggérant des altérations chromatiniennes (Fig. 5B). Les nucléoles sont très hétérogènes d’un noyau à un autre et offrent des images de ségrégation en forme de rosettes ou de lames festonnées plus ou moins étendues (Fig. 5 C), Le cytoplasme des PI montre une densité variable et des concrétions fréquentes (Fig. 5A). Les vacuoles claires associées aux dictyosomes, nombreuses chez les jeunes individus, ne sont plus observées à cet âge. Les citernes du réticulum sont plus dilatées et renferment souvent un ou plusieurs granules de taille variable, opaques aux électrons souvent liés à des globules lipidiques ; cette association pourrait être à l’origine des corps denses nombreux et hétéromorphes (Fig. 6A et B). Les mitochondries aussi nombreuses que chez les jeunes individus sont cependant modifiées. Certaines sont turgescentes, mais la majorité présente une matrice densifiée par un dépôt poudreux et/ou filamenteux. Autour d’elles s’accumulent des fibres cristalloïdes (Fig. 6B et C). De plus, l’apparition d’agrégats de fibres dans le cytoplasme suggère une altération des éléments du cytosquelette. La transformation marquée chez ce groupe est révélée par l’abondance des corps denses et l’apparition de formations concrétiques. Celles-ci, hétéromorphes et de très grande taille sont disséminées dans tout le parenchyme. Des images de proximité entre compartiments granulaires et globules lipidiques et entre mitochondries modifiées et corps denses permettent de suggérer que l’accumulation et ou l’altération de ces différentes structures seraient à l’origine de la formation de ces concrétions (Fig. 6D et E).
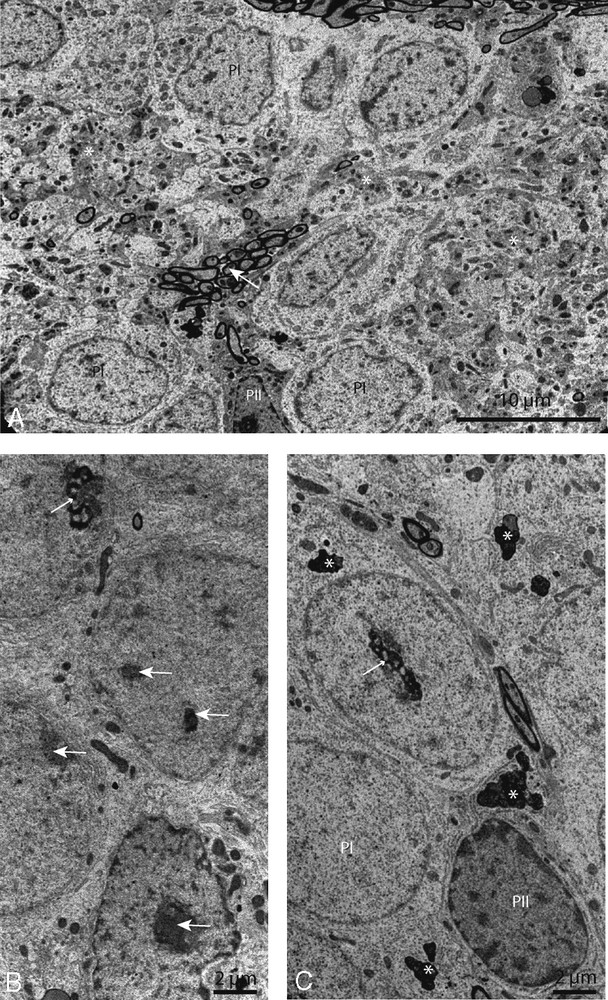
Micrographies de microscopie électronique montrant les modifications du parenchyme âgé. Au faible grossissement, (A) les pinéalocytes clairs (PI) toujours nombreux montrent un cytoplasme parsemés de plages densifiées (*). Les pinéalocytes sombres (PII) ne montrent pas de modifications notables. Noter ici, un amas de fibres myélinisées issues des fibres commissurales traversant le parenchyme (flèche). Le fort grossissement (B et C) montre des noyaux à contours réguliers et nucléoplasme pâle renfermant plusieurs inclusions compactes (flèche), des nucléoles hétéromorphes et t hétérogènes avec des images de ségrégation en rosettes ou lame festonnées (petite flèche). Noter aussi la fréquence de corps denses dans le cytoplasme (*). Masquer
Micrographies de microscopie électronique montrant les modifications du parenchyme âgé. Au faible grossissement, (A) les pinéalocytes clairs (PI) toujours nombreux montrent un cytoplasme parsemés de plages densifiées (*). Les pinéalocytes sombres (PII) ne montrent pas de modifications notables. ... Lire la suite
Electron micrographs showing the changes in aged parenchyma. At low magnification (A), clear pinealocytes (PI) show beaches of densified cytoplasm (*) and unchanged dark pinealocytes (PII). Note here, a cluster of myelinated commissural fibers crossing the parenchyma (arrow). At high magnification, B and C micrographs show, nuclei with regular contours and pale nucleoplasm containing several dense compact inclusions (arrows), unusual heterogeneous nucleoli segregated in rosettes or scalloped blade (small arrow). Note the frequency of polymorphous dense bodies (*) in the cytoplasm. Masquer
Electron micrographs showing the changes in aged parenchyma. At low magnification (A), clear pinealocytes (PI) show beaches of densified cytoplasm (*) and unchanged dark pinealocytes (PII). Note here, a cluster of myelinated commissural fibers crossing the parenchyma ... Lire la suite
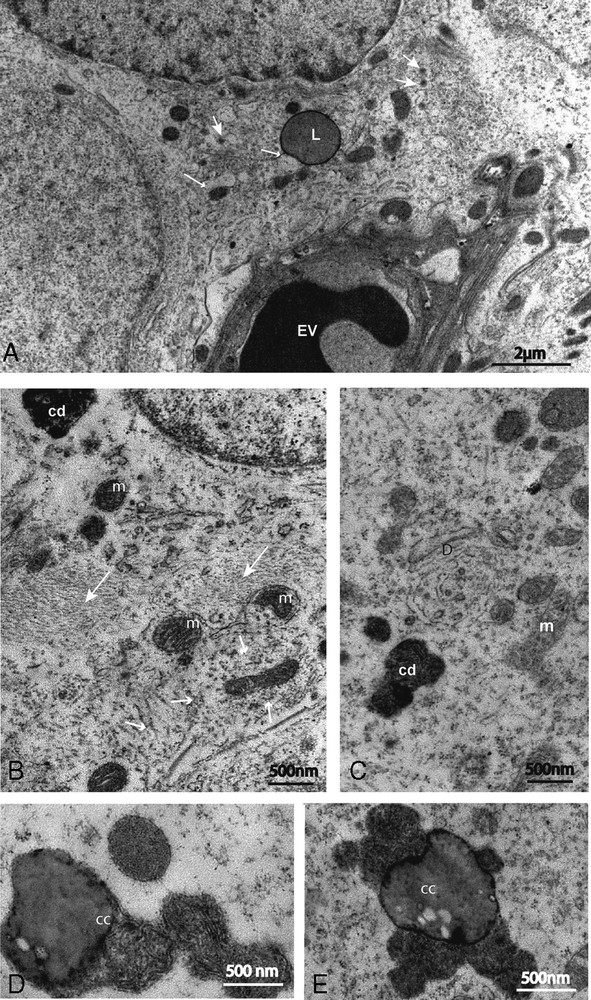
Modifications des organites cytoplasmiques. (A) les cavités du réticulum endoplasmique sont dilatées et renferment un à plusieurs granules opaques (flèches) avec des images d’association à des globules lipidiques (L). (B) mitochondries à matrices densifiées (m) entourées d’une trame de fibres cristalloïdes (petites flèches), présence d’agrégats de fibres du cytosquelette (grandes flèches). (C) Dictyosomes (D) peu actifs, noter l’absence de vacuoles claires à leur voisinage. Espace vasculaire (EV) ; corps dense (cd). Images de structures concrétiques volumineuses associant globule lipidique et mitochondries modifiées (D) et/ou corps denses et globule lipidique (E). Masquer
Modifications des organites cytoplasmiques. (A) les cavités du réticulum endoplasmique sont dilatées et renferment un à plusieurs granules opaques (flèches) avec des images d’association à des globules lipidiques (L). (B) mitochondries à matrices densifiées (m) entourées d’une trame ... Lire la suite
Modified organelles in clear pinealocytes (A), dilated endoplasmic reticulum cisternae containing one or several granules (arrows) sometimes associated to lipid droplets (L). On (B), numerous mitochondria with densified matrix (m) surrounded by a web of crystalloid fibers (small arrows), cytoplasmic aggregates of cytoskeleton fibers (big arrows). In (C), note the absence of clear vacuoles near the Golgi saccules (D). Dense bodies (cd); vascular space (EV). Micrographs D and E show large heteromorphic and heterogeneous concrete structures consisting of an association between modified mitochondria and lipid droplets in (D) and between dense bodies and lipid droplets in (E). Masquer
Modified organelles in clear pinealocytes (A), dilated endoplasmic reticulum cisternae containing one or several granules (arrows) sometimes associated to lipid droplets (L). On (B), numerous mitochondria with densified matrix (m) surrounded by a web of crystalloid fibers ... Lire la suite
4 Discussion
Cette étude nous a permis d’observer pour la première fois l’anatomie topographique de la glande pinéale de C. russula et de relever les altérations cytologiques liées à l’âge.
4.1 Caractéristiques générales du tissu pinéal chez Crocidura russula
4.1.1 Position anatomique comparée de la glande pinéale
Au regard des distinctions de forme et de position de la glande pinéale chez les différents ordres de mammifères étudiés, la glande se présente chez C. russula, en une seule entité coniforme au contact du IIIe ventricule. Selon la classification de Vollrath (1981) [30], cette topographie correspond au type proximal ou le type « A ». Cette position a également été rapportée chez d’autres espèces d’Insectivores : Talpa europea, Blarina brevicauda et de Chiroptères : Myotis sodalis et Myotis lucifugus mais aussi chez des espèces d’Ongulés (le cheval, le mouton) et des Primates (le chimpanzé et l’Homme) (pour revue, voir [30]). La glande pinéale de C. russula, par son anatomie plus proche de celle de l’Homme que ne l’est la pinéale des rongeurs [31,32], pourrait constituer un modèle plus adéquat pour les études sur cette glande.
4.1.2 Composition cellulaire de la glande
La nomenclature des pinéalocytes est très variable d’une espèce à une autre, voire d’une étude à une autre. Chez C. russula, nous avons pu identifier des pinéalocytes d’aspect clair (PI) et d’autres sombres ou (PII). La pinéale du lapin [33], celle de certaines espèces de taupes [34] et [35], de la noctule [36], du renard [37] et de la gerbille [38] renferment également deux types de pinéalocytes. D’après certains auteurs [39,40], ces cellules diffèrent non seulement par leur osmophilie mais aussi par leurs activités sécrétoires. Chez C. russula, les caractéristiques cytologiques suggèrent que les deux variantes, claire et sombre, pourraient représenter un type unique de pinéalocytes exprimant deux états fonctionnels. Les pinéalocytes sombres (type II) pourraient être en phase d’initiation de la protéosynthèse comme le suggère, l’espace périnucléaire dilaté, l’extension du réseau ergastoplasmique et l’absence de vacuole claire en leur sein, alors que le type clair (PI) pourraient être en phase d’emballage et d’adressage des produits, tel que le suggère l’abondance des vacuoles claires au voisinage de saccules golgiens distendus.
Au moins deux processus sécrétoires ont été décrits dans les pinéalocytes, le processus « neurosecretory-like », caractérisé par la formation, à partir des saccules golgiens, de vésicules à cœur dense, et le processus « neuroependymal-like » caractérisé par l’accumulation d’un matériel protéique dans les citernes du réticulum endoplasmique rugueux [39]. Chez C. russula, l’activité sécrétoire des pinéalocytes est matérialisée par la formation, à partir du golgi, de vacuoles claires. Des vacuoles de même aspect mais apparemment d’origine ergastoplasmique ont été décrites chez d’autres mammifères Insectivores notamment le hérisson, la chauve-souris, le rat taupe et le rat kangourou [34,36,39,41,42]. Chez la gerbille, Rongeur déserticole, ces vacuoles sont exclusivement produites par les pinéalocytes de type II et leur nombre et taille suivent un rythme saisonnier [38]. Il semblerait que les deux processus sécrétoires décrits ne soient pas uniques dans la glande et ne peuvent être généralisés à toutes les espèces puisque chez C. russula les vacuoles claires, de type épendymaire, sont d’origine golgienne. Il est bien connu que l’activité de la glande pinéale est intimement liée aux phases du cycle nycthéméral ainsi qu’à la fonction de reproduction de l’espèce ; c’est pourquoi nous pensons que les différences interspécifiques relevées pourraient aussi résulter des moments de la journée et de l’année auxquels ont été réalisés les prélèvements pour les différentes études publiées. De plus, chez C. russula, les vacuoles claires sont abondantes dans les prolongements pinéalocytaires, suggérant une libération possible dans les espaces interstitiels, tel que rapporté chez le rat [43], le rat du coton Sigmodon hispidus [44] et la Gerbille Gerbillus pyramidum [38]. Chez cette dernière, les vacuoles claires ont un contenu glycoprotéique [38]. Une étude du tissu pinéal de C. russula au cours du cycle nycthéméral permettra de mieux apprécier la signification physiologique de ces produits pour la glande.
4.2 Altérations ultrastructurales du tissu pinéal au cours de l’âge
Nos observations montrent chez les musaraignes âgées, de profondes modifications au niveau des pinéalocytes. Ce résultat est en accord avec les travaux antérieurs réalisés chez d’autres espèces [45–47] et suggère une altération du tissu pinéal au cours de l’âge. Ainsi, les inclusions compactes intranucléaires et la morphologie inhabituelle des nucléoles pourraient indiquer une atteinte de l’ADN pinéalocytaire. Ceci rejoint les observations de Johnson [48] signalant la présence d’inclusions nucléaires dans les pinéalocytes de rats âgés et ceux de Humbert et Pévet [49] qui identifient des précipités de calcium dans les noyaux de pinéalocytes sombres (PII) chez les rats âgés.
La structuration de la chromatine dans le noyau est régulée par les histones et les protéines du nucléo-squelette. Les modifications nucléaires relevées pourraient résulter d’une altération de ces protéines. En effet, in vitro, une diminution et/ou altération des histones sont associées aux détériorations chromatiniennes caractérisant les cellules eucaryotes âgées [50]. D’autres études rapportent une multiplication des foyers d’ADN endommagé et une modification de la localisation des lamines A dans des cellules humaines âgées [51].
Dans le cytoplasme, l’absence de vacuoles claires au voisinage des dictyosomes golgiens pourrait représenter un affaiblissement de l’activité sécrétoire des pinéalocytes sénescents. Une rétraction de l’aire golgienne et une réduction du nombre de vésicules qui lui sont associées ont également été observées dans les pinéalocytes de Peromyscus leucopus âgés de 28 mois [52]. Parallèlement, les citernes du réticulum et les mitochondries sont fortement modifiées confirmant les observations d’Humbert et Pévet chez le rat [35].
Le changement le plus marqué dans les pinéalocytes âgés est l’accroissement du nombre et de la taille des corps denses et la fréquence des corps concrétiques. Ces observations rejoignent celles rapportées chez le rat [45,46,53], la gerbille de Mongolie [54], le cheval [55] et l’Homme [56]. Les corps denses ou granules de lipofuschine sont des structures associées à l’involution sénile des tissus ; leur fréquence chez ce groupe traduirait un accroissement de l’activité lytique suggérant ainsi une accélération du taux de destruction des composants cellulaires. D’après Bondareff [45], ces structures présentent une activité phosphatase acide. Ces données combinées à nos observations pourraient expliquer la réduction de l’activité sécrétoire des pinéalocytes âgés chez C. russula.
Les concrétions pinéales également appelées corpora arenacea acervuli, ou sables épiphysaires ont été décrites dans la glande pinéale de nombreuses espèces. Toutefois leur signification physiologique n’est pas encore connue. Nos observations montrent qu’elles sont caractéristiques des pinéalocytes sénescents. Ces observations rejoignent celles rapportées chez le rat [57] et chez la gerbille de Mongolie [58].
L’expansion en nombre et en taille de ces structures dans un environnement pinéalocytaire modifié, chez C. russula, évoque fortement un état dégénératif de la glande au cours de la sénescence. Cet état serait secondaire à des modifications du métabolisme pinéalocytaire comme l’atteste la densification du cytoplasme et la réduction des organites impliqués dans les activités de synthèse et de sécrétion. Chez la gerbille de Mongolie, les concrétions pinéales sont observées dans diverses situations expérimentales [58–60] et leur abondance est au contraire expliquée par une intensification de l’activité métabolique de la glande [61,62].
Parmi les espèces étudiées, les concrétions montrent de grandes différences individuelles et interspécifiques [30,46,57,58,63,64]. Aussi, différentes hypothèses ont été proposées pour expliquer leur origine. Elles proviendraient des pinéalocytes vacuolaires, chez la gerbille de Mongolie [58] et des pinéalocytes sombres chez le rat [63]. Ces sites bien que différents en apparence correspondent chacun à un environnement riche en Ca++. Ainsi, la minéralisation de l’environnement pinéalocytaire serait favorable à l’apparition des concrétions. Chez C. russula, l’apparition des granules denses dans des citernes de réticulum endoplasmique dilatées comme chez la gerbille [40,44] et la densification de la matrice mitochondriale et de son environnement comme chez le rat [63], laisse penser que ces compartiments seraient des sites de minéralisation dans les pinéalocytes et, par conséquent, de la formation des concrétions. En effet, il est bien connu que ces organites sont des sites de stockage du Ca++. De plus, plusieurs travaux ont démontré leur susceptibilité à la minéralisation [65–67]. Humbert et Pévet [63] montrent chez le rat âgé, la présence de calcium et de phosphore dans les vésicules et vacuoles provenant du réticulum endoplasmique. Ces données combinées à nos observations nous amènent à penser qu’une minéralisation du contenu ergastoplasmique pourrait perturber les processus d’emballage et de sécrétion dans le pinéalocyte expliquant ainsi la réduction du nombre de vacuoles claires à cet âge ce qui appuie davantage l’hypothèse d’une dégénérescence du tissu au cours de l’âge. Les caractéristiques de la composante neuronale comparables chez les individus jeunes et âgés laissent penser que les modifications observées sont intrinsèques aux cellules pinéales et ne semblent pas relever d’une altération de leur contrôle nerveux.
5 Conclusion
La glande pinéale de C. russula, est de type proximal (type A) ; cette topographie est similaire à celle des autres Insectivores et des Primates y compris l’Homme. Les deux populations de pinéalocytes qui y sont identifiées sont le reflet de deux états d’activité d’un même et unique type cellulaire. Leur activité sécrétoire est matérialisée par la formation de larges vacuoles claires.
Au cours de l’âge, la glande pinéale de C. russula subit des altérations ultrastructurales touchant essentiellement ses cellules majoritaires, les Pinéalocytes de type I, et ce, par la densification du cytoplasme et de la matrice mitochondriale, la multiplication des corps denses et des corps concrétiques et la raréfaction des produits de sécrétion. Ces modifications rappellent celles rapportées chez les Rongeurs et l’Homme. Elles sont évocatrices d’un processus de ralentissement du métabolisme cellulaire. Compte tenu des caractéristiques de la composante neuronale, similaires chez les crocidures jeunes et âgées, nous pensons que les différences relevées sont intrinsèques aux pinéalocytes et n’impliquent, en apparence, pas leur contrôle nerveux, au moins sur le plan ultrastructural.
Dans leur ensemble, nos observations viennent conforter les résultats de Magnanou et al. en 2009 [27] et apportent la preuve que la réduction progressive du taux de mélatonine enregistrée avec l’âge, chez C. russula, est secondaire à un affaiblissement de l’activité des pinéalocytes au cours du processus de sénescence.
Déclaration d’intérêts
Les auteurs déclarent ne pas avoir de conflits d’intérêts en relation avec cet article.
Remerciements
Ce travail a été réalisé sur la Plateforme de Cytométrie et d’Imagerie de l’Observatoire Océanologique de Banyuls-sur-Mer.


