1 Introduction
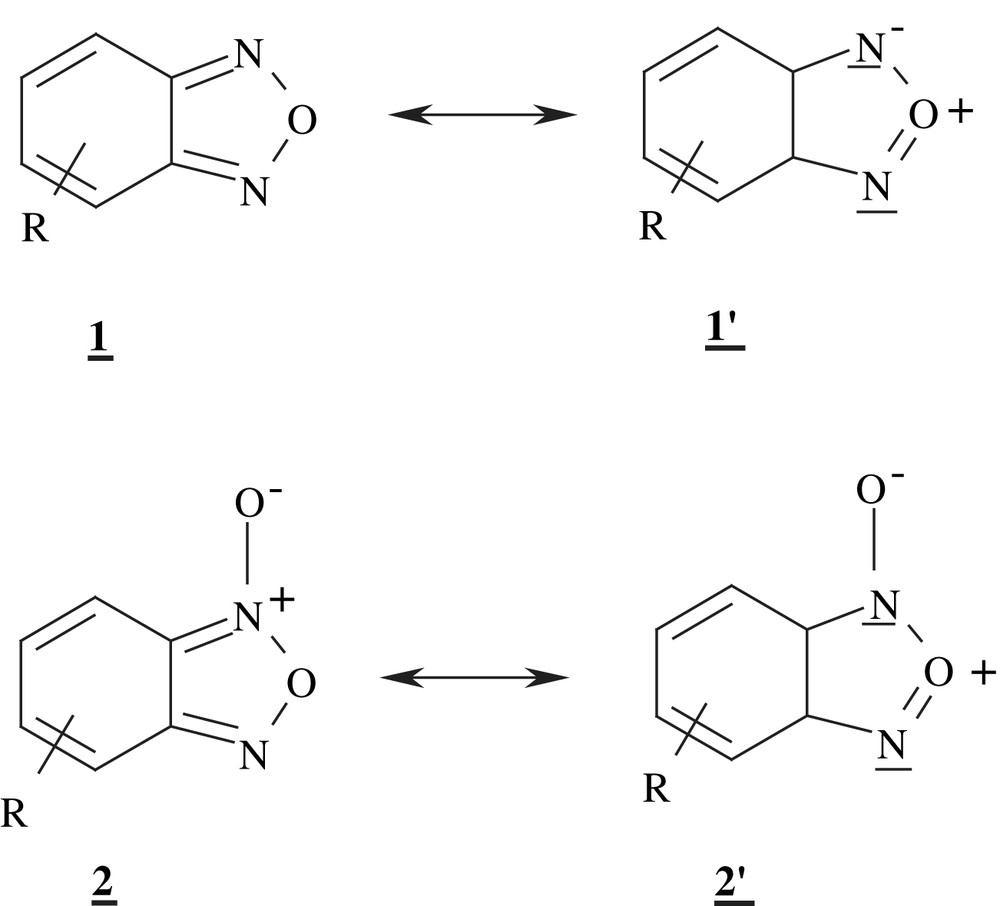
Les 2,1,3-benzoxadiazoles 1 et les dérivés N-oxydés correspondants 2, plus communément désignés sous les noms respectifs de benzofurazanes et benzofuroxanes, constituent une famille d'hétérocycles dont les premiers éléments ont été synthétisés à la fin du 19e siècle par P. Drost [1–3]. Considérés comme des hétéroaromatiques à dix électrons π par suite de l'existence des formes mésomères 1′ et 2′, ces composés se caractérisent par un carbocycle assez déficient en électrons en raison du caractère fortement électroattracteur des motifs annelés furazane et furoxane [2–5]. Cette propriété est toutefois restée peu exploitée jusqu'à la fin des années 1960 en raison des ambiguïtés qui ont longtemps persisté quant à la structure des benzofuroxanes substitués [4–7] et donc des benzofurazanes puisque ces derniers ne sont généralement accessibles que par désoxygénation de leurs homologues N-oxydés [8–16].
Compte tenu de la forte susceptibilité des motifs benzofuroxane et benzofurazane non substitués aux attaques nucléophiles [2,17,18], on pouvait raisonnablement imaginer que leur caractère électrophile serait encore plus accentué après introduction d'un ou deux groupes électroattracteurs additionnels sur le carbocycle. La découverte par M.W. Whitehouse d'une part et A.J. Boulton d'autre part que le 4-nitrobenzofurazane 3 (NBZ) et les 7-halogéno-4-nitrobenzofurazane 4 réagissent dans des conditions très douces avec des fonctions amine pour donner respectivement les complexes-σ anioniques stables 5 et les dérivés de substitution 6, a conforté cette idée [2,3,13,15,17,19].

Nous nous proposons d'étudier la cinétique des réactions de substitution nucléophile aromatique (SNAr) de nitrobenzofurazanes avec des phénols para substitués (Éq. (1)).
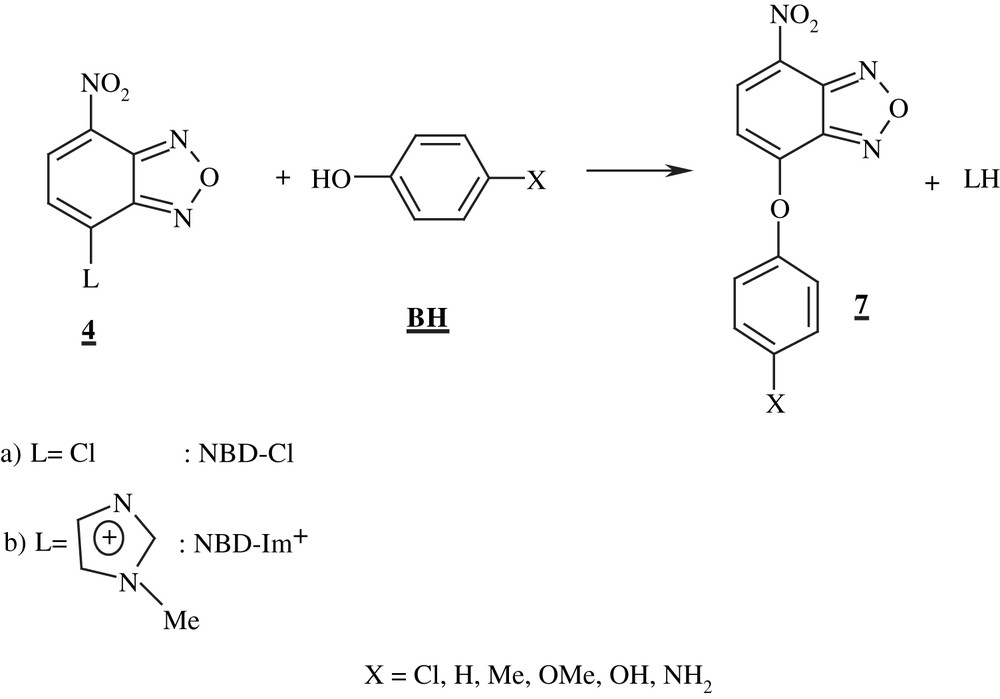
Le 7-chloro-4-nitrobenzofurazane 4a a été retenu pour cette étude qui a été élargie au 7-(N-méthylimidazolium)-4-nitrobenzofurazane 4b, dans le souci d'analyser l'influence de la nature du groupe neutre ou cationique du substrat sur la vitesse de la condensation.
2 Résultats
Les cinétiques ont été conduites, à T = 25 °C, dans des conditions de pseudo-premier ordre vis-à-vis de 4a,b ([4a,b] ≈ 6×10−5 mol L−1), dans un milieu mixte eau–Me2SO (70–30, v/v), tamponnés par les couples phénol/phénate, noté BH/B. L'ajout de chlorure de potassium a permis d'élever la force ionique du milieu à 0,2 mol L−1 permettant ainsi d'étendre la gamme des concentrations en tampon utilisable, [BH] variant de 6×10−3 à 7×10−2 mol L−1. L'avancement des réactions a été réalisé par spectrophotométrie UV–vis en suivant l'augmentation de l'absorbance au maximum d'absorption de 7.
Les tracés linéaires passant par l'origine obtenus entre les constantes du pseudo-premier-ordre kobs et les concentrations en phénols (Éq. (2)), dont deux exemples sont donnés (Figs. 1 et 2), conduisent aux déterminations des constantes de vitesse bimoléculaires k, regroupées dans le Tableau 1.
| (2) |
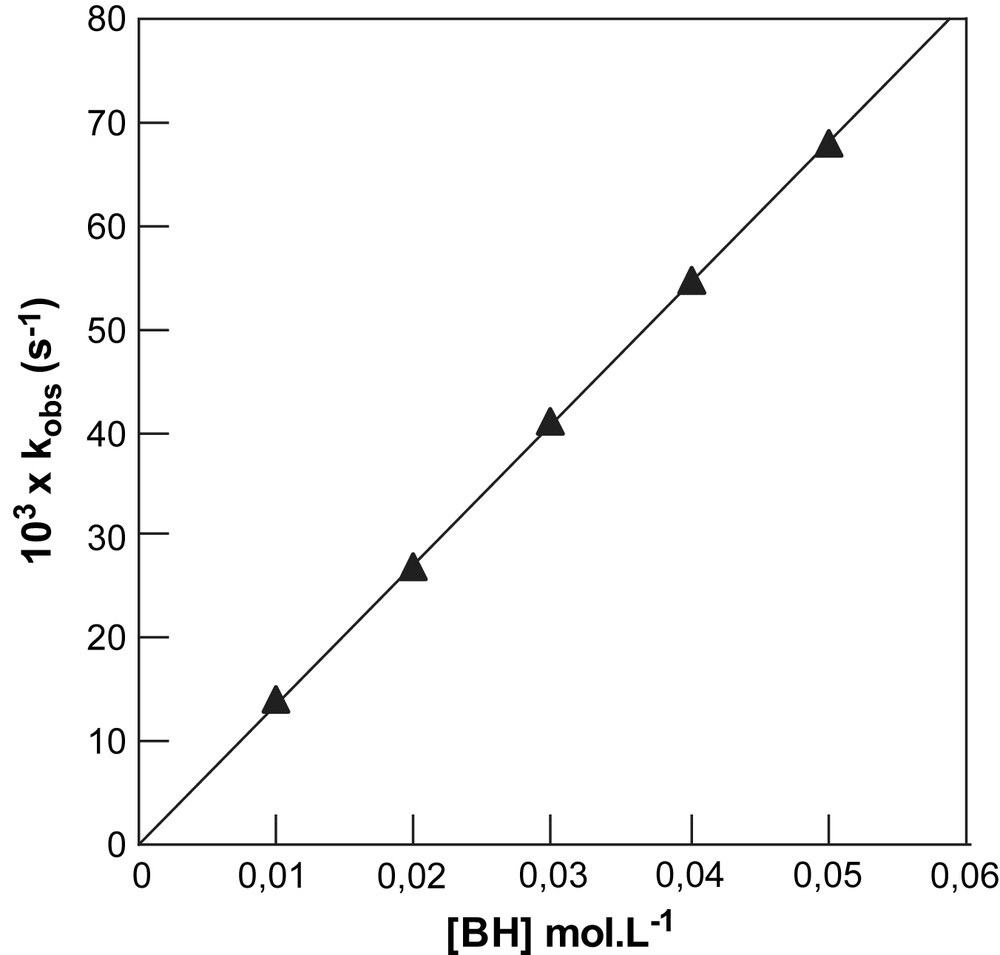
Tracé de kobs en fonction de la concentration [BH] en para hydroxy phénol ; substrat NBD-Cl, dans le milieu mixte eau–DMSO–KCl (0,2 mol L−1) contenant 30% de DMSO en volume ; pH = 11,90 ; [B−]/[BH] = 1/1 ; T = 25 °C.
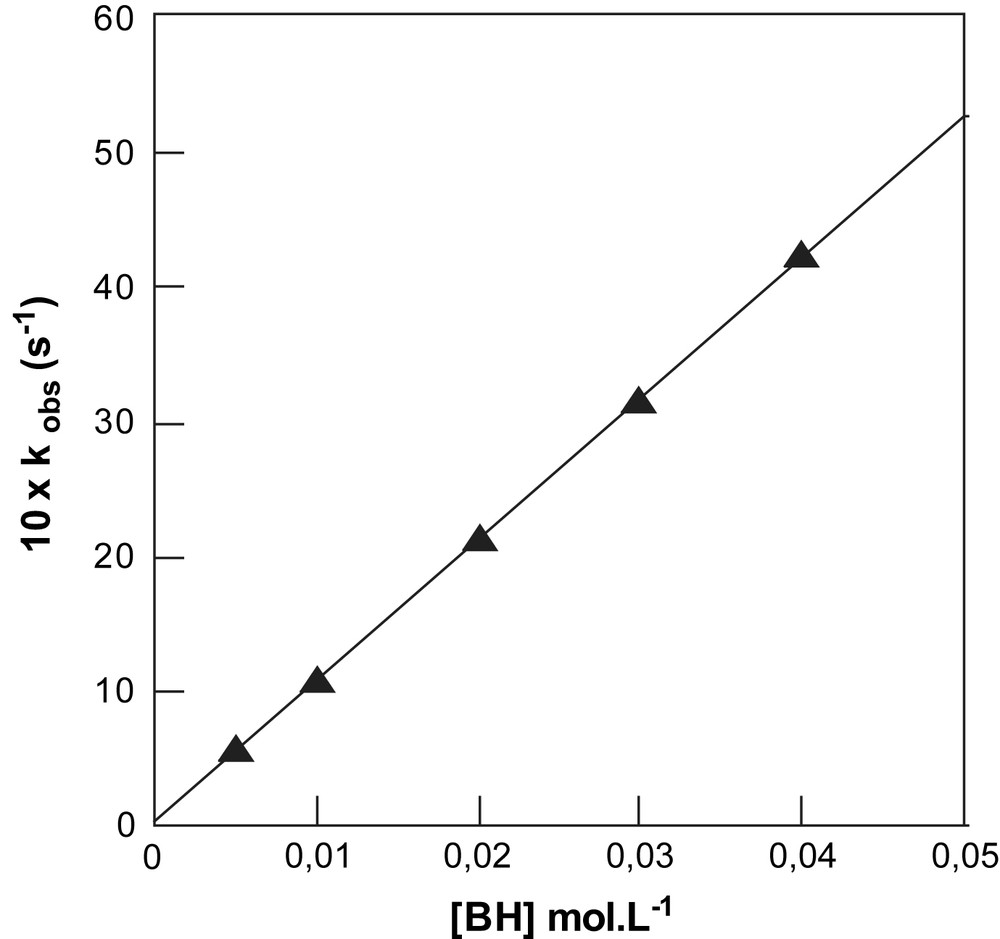
Tracé de kobs en fonction de la concentration [BH] en para hydroxy phénol ; substrat NBD-Im+, dans le milieu mixte eau–DMSO–KCl (0,2 mol L−1) contenant 30% de DMSO en volume, pH = 11,90 ; [B−]/[BH] = 1/1 ; T = 25 °C.
Valeurs des constantes de vitesse du second ordre k, relatives aux réactions de substitution de NBD-L par les phénols para X-substituées dans le milieu eau–DMSO–KCl (0,2 mol L−1) contenant 30% de DMSO en volume, T = 25 °C.
| X | pKab | 102 × k (mol−1 L s−1) | ||
| L = Cl | L = Im+ | |||
| Cl | 0,23 | 9,95 | 0,58 | 0,488 |
| H | 0,00 | 10,68 | 9,12 | 4,050 |
| Me | −0,14 | 10,99 | 16,57 | 8,242 |
| MeO | −0,12 | 11,09 | 11,02 | 8,893 |
| OH | −0,37 | 11,90 | 136,04 | 106,120 |
| NH2 | −0,57 | 12,30 | 409,20 | 368,410 |
a Ref. [20].
b Les pKa des phénols ont été déterminés par potentiométrie, à 25 °C et dans le milieu ternaire eau–DMSO–KCl (0,2 mol l−1), contenant 30% de DMSO en volume.
3 Discussion
C'est à Bunnett que revient le mérite d'avoir postulé qu'une réaction de substitution nucléophile aromatique procède en deux étapes (Éq. (3)) [21,22] La première étape correspond à l'addition du nucléophile, rendue possible par la présence d'un ou plusieurs groupement(s) électroattracteur(s) (noté(s) EWG) susceptible(s) de stabiliser l'intermédiaire de type cyclohexadiénylique dont la réaromatisation, par expulsion du groupe partant L, constitue la seconde étape [23].

Dans le cas du motif 4-nitrobenzofurazanyle, la stabilisation de l'adduit intermédiaire σH (équation (4)) est générée par les effets électroattracteurs (inductif et mésomère) du nitro substituant en position para du centre carboné électrophile ainsi que par l'influence électroattractrice de la partie hétérocyclique furazanyle annelée.
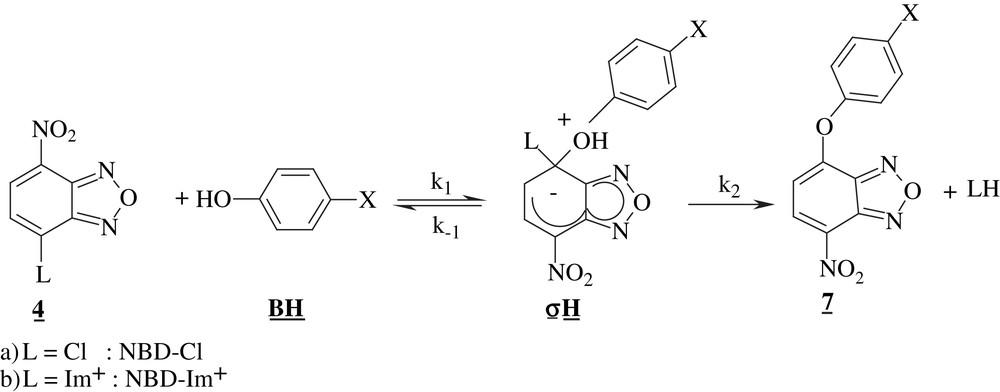
A noter que la conversion en produit final 7 de l'aduit intermédiaire qui est soit zwittérionique (L = Cl), soit bis-cationique monoanionique (L = Im+), peut être spontanée, catalysée par le solvant, ou catalysée par le nucléophile jouant le rôle de base. Dans nos conditions expérimentales, seule la contribution du nucléophile s'est révélée importante.
Il convient également de préciser que le groupe partant se retrouve sous forme de chlorure dans le cas de NBD-Cl et le nucléofuge N-méthylimidazole (dont le pKa vaut 6,65 dans le milieu contenant 30% de Me2SO en volume [24]) se retrouve sous sa forme non protonée car les pKa de tous les tampons phénol/phénate sont supérieurs au pKa du cation méthylimidazolium (5,52) [24].
Dans notre cas il ne fait aucun doute que les deux réactions de substitution que nous avons étudiées révèlent que la 1ère étape est déterminante. En effet, dans la gamme des concentrations en base utilisées, aucune catalyse basique de la substitution du chlore et du N-méthylimidazolium n'a été observée, comme en témoignent les variations linéaires des constantes de pseudo-premier ordre kobs mesurées avec les concentrations en base (cf. Figs. 1 et 2). Les constantes bimoléculaires k, que nous noterons kx afin de faciliter notre analyse des effets de substituant, rassemblées dans le Tableau 1 s'identifient donc aux constantes de vitesse k1 correspondant à la formation des adduits σH intermédiaires.
3.1 Corrélations de Hammett
Comme on peut le constater, les constantes de vitesse kx afférentes à un système donné, augmentent comme prévu avec la nucléophilie du phénol utilisé. A cet égard, il est significatif que cette augmentation s'inscrive dans le cadre des corrélations de Hammett satisfaisantes (Éq. (5)).
| (5) |
Les Figs. 3 et 4 montrent que l'on obtient de bonnes droites (R = 0,99) en considérant les variations du logarithme de la constante de vittesse kx en fonction des constantes
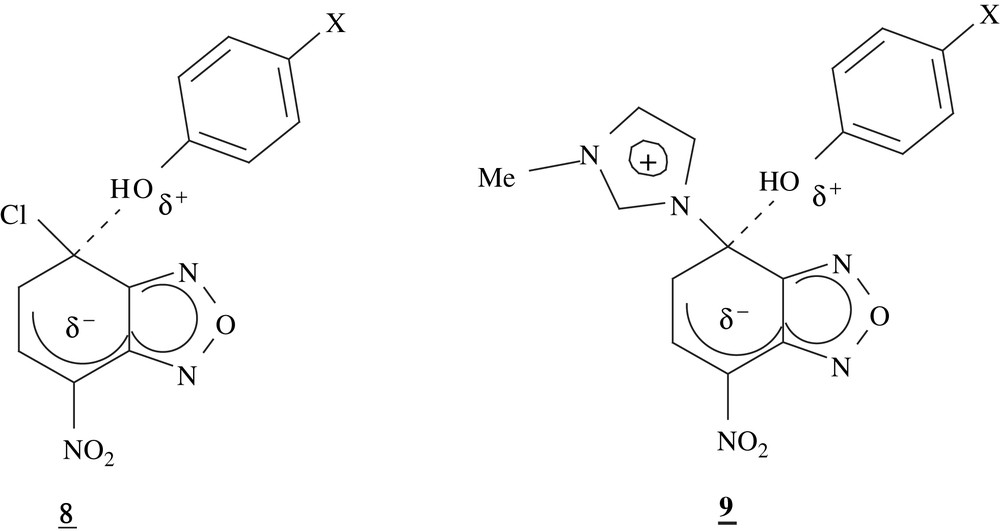
Corrélation de Hammett dans le cas de NBD-Cl dans le milieu H2O–Me2SO 70–30%, I = 0,2 mol L−1 et T = 25 °C.

Corrélation de Hammett dans le cas de NBD-Im+ dans le milieu H2O–Me2SO 70–30%, I = 0,2 mol L−1 et T = 25 °C.
Un résultat intéressant est que la valeur négative de ρ est moins élevée pour le dérivé chloré que pour le dérivé imidazolium : ρCl = −3,36 ; ρIm+ = −3,50 (Tableau 2). Cette plus grande sensibilité du système imidazolium aux changements de substituants est explicable en termes d'effets de répulsion électrostatique entre la charge positive du groupe Im+ et la charge positive qui se développe sur le motif OH dans l'état de transition 9. Si la déstabilisation de l'état de transition qui en résulte est évidemment très atténuée lorsque le substituant en para du groupe OH est fortement donneur, tel X = NH2, la compensation diminue très vite lorsqu'on passe à X = OMe ou Me et elle devient inexistante avec X = H ou Cl ; d'où l'amplification de la réduction de vitesse lorsque
Valeurs des constantes de réaction (ρ) et des constantes de Brönsted (βnuc) obtenues pour les réactions de NBD-Cl et NBD-Im+ avec les phénols para substitués, dans le milieu mixte H2O–Me2SO 70–30%, I = 0,2 mol L−1 et T = 25 °C.
| Substrat | ρ | βnuc |
| NBD-Cl | −3,36 | 1,18 |
| NBD-Im+ | −3,50 | 1,23 |
3.2 Corrélations de Brönsted
Une autre façon d'analyser l'effet de la nature du substituant X sur la réactivité des phénols avec nos deux électrophiles hétéroaromatiques est de considérer les graphes de Brönsted.
Le fait que nous ayons déterminé les pKa de nos phénols dans les mêmes conditions expérimentales que celles choisies pour nos études cinétiques (même milieu mixte et même force ionique, Tableau 1) nous autorise cette analyse avec au final l'obtention de valeurs significatives de βnuc. Dans le cas présent, βnuc sera une mesure du degré d'avancement de la création de la charge positive sur le motif OH dans l'état de transition. En fonction de cette définition même de βnuc, on attend donc que les valeurs de ce coefficient de Brönsted qui correspond aux pentes des droites d'Éq. (6) soient comprises entre 0 et 1.
| (6) |
Comme le montrent les Figs. 5 et 6, nous obtenons de bonnes droites (R = 0,99) en procédant à la construction des graphes de Brönsted afférents à nos deux substrats.
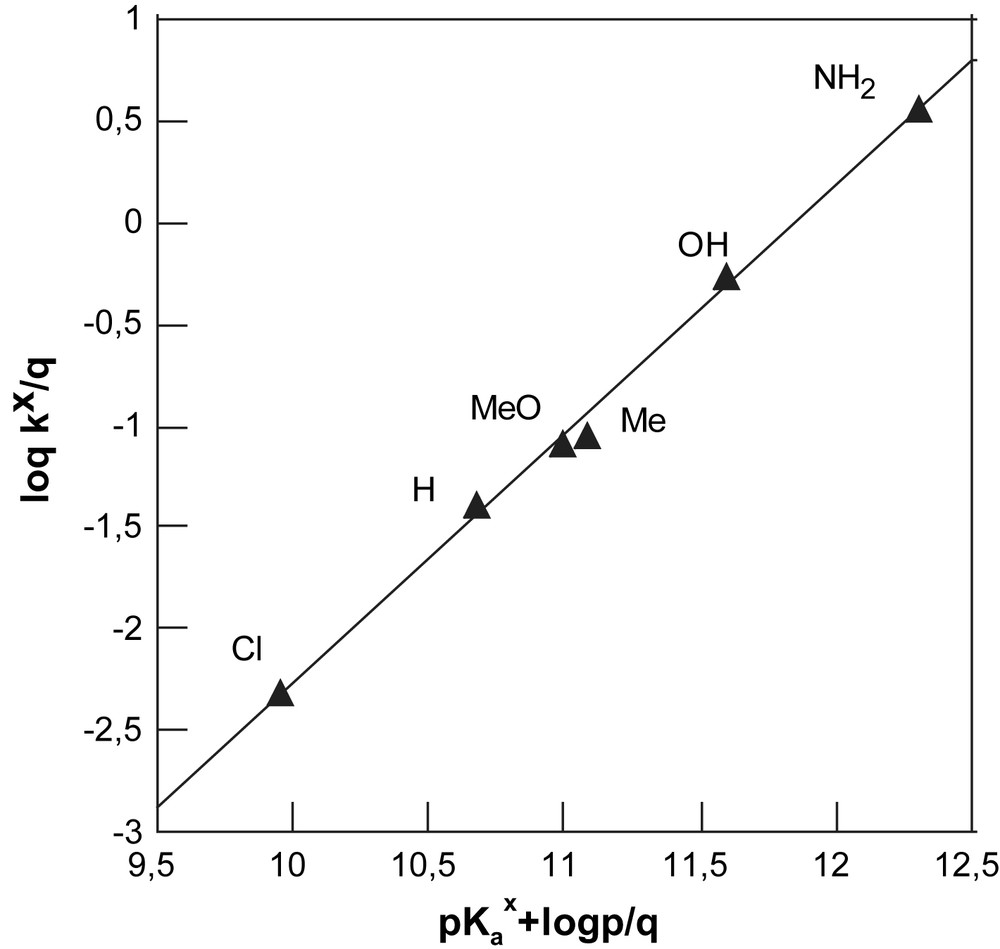
Graphe de Brönsted dans le cas de NBD-Cl dans le milieu H2O–Me2SO 70–30%, I = 0,2 mol L−1 (KCl) et T = 25 °C.
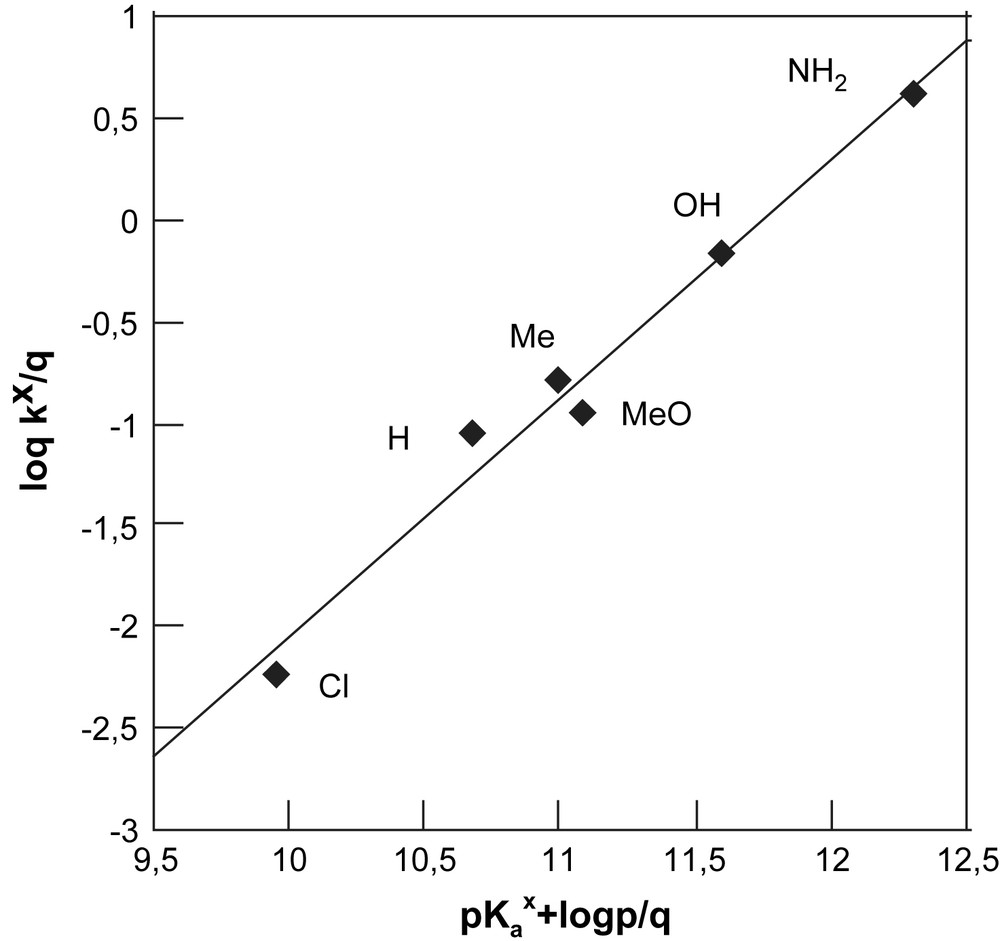
Graphe de Brönsted dans le cas de NBD-Im+ dans le milieu H2O–Me2SO 70–30%, I = 0,2 mol L−1 (KCl) et T = 25 °C.
Les valeurs de βnuc sont égales pour le dérivé chloré à 1,18 et 1,23 pour le dérivé imidazolium (Tableau 2).
Remarquons que les valeurs de βnuc sont très surprenantes. Comme l'ont discuté divers auteurs, notamment Bordwell [25] et Terrier [26], les réactions de substitution nucléophile aromatique se caractérisent par des valeurs de βnuc comprises entre 0,5 et 0,7. Cette plage relativement étroite est considérée comme spécifique de ces réactions, ce qui correspond à un transfert de charge réalisé à environ 50–70% dans l'état de transition. Par exemple, une valeur de βnuc de 0,72 a été trouvée par Buncel [27] pour la réaction du p-nitrophenyl acétate avec divers phénols dans un milieu eau–DMSO (30–70).
Dans ce contexte, le fait que nous trouvions des valeurs de βnuc supérieures à l'unité est réellement surprenant. Il en résulte que nous ne soyons pas réellement en présence de substitutions se déroulant suivant le mécanisme simple d'addition–élimination SNAr (Schéma 1) mais plutôt dans le cas de substitutions initiées par un transfert monoélectronique selon le mécanisme SET (Single Electronic Transfer) du Schéma 1 :
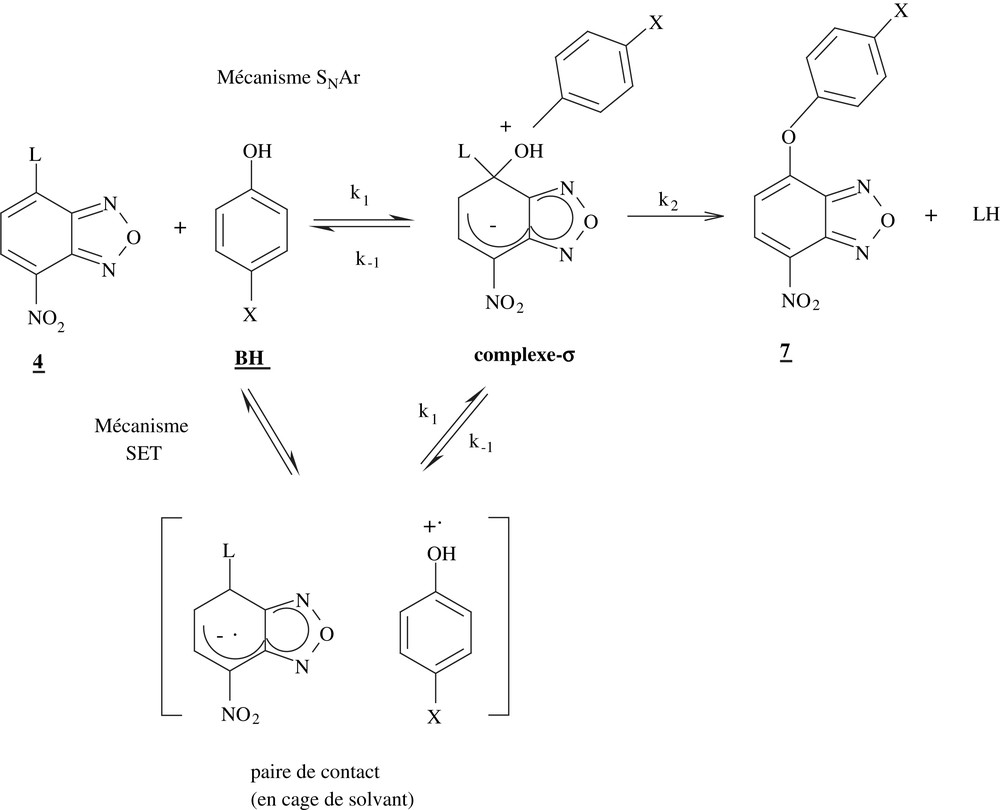
Le fait que le motif nitrobenzofurazane soit très avide d'électrons alors même que le motif hydroxyle des phénols est très oxydable serait un facteur favorable à un tel transfert. La structure du cation radical phénolique formé se traduirait obligatoirement par la présence d'une charge positive dans l'état de transition de la réaction de couplage des deux radicaux, avec formation d'un complexe-σ intermédiaire identique à celui mis en jeu dans la réaction SNAr. Ce dernier se décomposerait ensuite pour donner le produit de réaction.
Comme nous l'avons également mentionné, les réactions de nos dérivés nitrobenzofurazanes avec les phénols étudiés conduisent quantitativement aux composés attendus. Il en résulte que le couplage des deux radicaux anionique et cationique doit se faire au sein même de la cage de solvant pour former le complexe-σ si le mécanisme SET est correct. Un couplage hors cage aurait pour effet de permettre à ces radicaux de réagir de manière différente, avec le solvant par exemple, et d'empêcher la formation quantitative des produits de substitution.
Un mécanisme SET du type décrit dans le schéma a précédemment été proposé pour des substitutions nucléophiles SN2 par Bordwell [25] et des substitutions nucléophiles aromatiques par Grossi [28] et Bunton [29,30]. Dans certaines de ces réactions, des valeurs de βnuc proches ou égales à l'unité ont été déterminées. Notons toutefois que Grossi [28] a identifié par RPE les radicaux anions issus de nombreux nitroarènes et notamment celui formé par réaction du 2,4-dinitrochlorobenzène, électrophile aromatique beaucoup plus faible que nos nitrobenzofurazanes, avec des ions thiolate dont la forte polarisabilité facilite la donation électronique.
Ce même mécanisme a été proposé par Terrier [31] lors de l'étude de la réactivité de ces mêmes substrats vis-à-vis d'anilines para substituées dans les mêmes conditions (I = 0,2 mol L−1 et dans le milieu eau–DMSO, 70–30 et T = 25 °C). Les βnuc obtenues sont égales à 0,96 dans le cas de NBD-Cl et 1,43 dans le cas de NBD-Im+.
4 Conclusion
Le présent travail raporte les constantes de vitesse relatives aux réactions de condensation de divers phénols para substitués sur NBD-Cl et les compare à celles obtenues en remplaçant le chlore de NBD-Cl par le groupe partant cationique N-méthylimidazolium (Im+). Les excellentes corrélations de Hammett obtenues, révèlent une plus grande sensibilité du nucléofuge imidazolium à la force du nucléophile phénol. Cette sensibilité peut-être expliquée par une répulsion électrostatique entre la charge positive du groupe Im+ et la charge positive qui se développe sur le motif OH du phénol dans l'état de transition et donc le stabilise. Bien qu'à priori surprenant, le résultat le plus intéressant de ce travail concerne les valeurs des coefficients de Brönsted obtenues. Pour expliquer ce résultat, nous avons avancé l'hypothèse d'un mécanisme de substitution initié par un transfert monoélectronique entre le nucléophile et l'électrophile (mécanisme SET).
5 Partie expérimentale
- - Le 7-chloro-4-nitrobenzofurazane, produit Fluka très pur, a été utilisé tel quel.
- - Le 7-(N-méthylimidazolium)-4-nitrobenzofurzane a été synthétisé selon le protocole suivant : 2 g (10 mmol) de NBD-Cl et 0,8 mL (10 mmol) de N-méthylimidazole, dissout dans 50 mL d'acétate de butyle sont chauffés à 40 °C. Au bout de 10 min, un précipité jaune se forme. Les cristaux obtenus après 30 min de chauffage sont filtrés, lavés au pentane et séchés sous vide. Rendement : 70%, F = 190 °C.
- - Le phénols sont des produits Fluka.
5.1 Standardisation des solutions tampons
Les tampons phénol/phénate ont été standardisés, à 25 °C, dans le milieu eau–DMSO–KCl (I = 0,2 mol L−1), par potentiométrie en utilisant un pHmètre pH 300 HANNA et une électrode de verre Combinée HI 1131 B.
5.2 Mesures cinétiques
La détermination des constantes de vitesses afférentes aux réactions de NBD-Cl et NBD-Im+ avec les phénols étudiés a été réalisée sur un spectrophotomètre UV–vis Perkin–Elmer Lambda 800.


