1 Introduction
Différents modes de stockage de l’hydrogène sont actuellement étudiés, en particulier celui utilisant des milieux carbonés, comme les nanotubes de carbone à paroi simple [1]. Ce dernier matériau semble être très favorable pour la résolution de ce problème de stockage, entrepris habituellement sur la base du processus d’adsorption du gaz comprimé à des hautes pressions. Toutefois, sa capacité d’adsorption ne devient importante qu’à basse température, alors qu’à l’ambiante, elle ne dépasse pas 1 % en poids [2,3], conformément aux simulations théoriques, développées sur la base du seul processus de physisorption et pour des nanotubes de diamètres compris entre 1 et 1,4 nm [4–10].
Par ailleurs, rappelons que les expériences d’adsorption de l’hydrogène se font en général avec des matériaux purifiés, contenant des faisceaux de nanotubes ouverts par voie chimique, mis en présence du gaz comprimé dans une cellule haute pression, pendant un temps suffisamment long pour obtenir un niveau d’adsorption maximal. Toutefois, on pourrait se poser la question de savoir si les sites d’adsorption sur les surfaces externes et internes des faisceaux de nanotubes sont saturés, car certains modèles théoriques aboutissent à des capacités d’adsorption de l’hydrogène variant entre 3 et 10 % [5,8,10]. En effet, il nous semble intéressant de rapprocher ces dernières considérations des résultats obtenus au cours de nos travaux expérimentaux sur le fullerène C60, excité par laser en présence d’un gaz comprimé et montrant l’existence de complexes endohédriques atome ou molécule-C60 dans une proportion importante, de l’ordre de 20 % [11,12] ; de plus, dans le cas de l’hydrogène, nous avons mis en évidence la formation de groupements C-Hn, correspondant à un processus de chimisorption [12].
Nous présentons dans cette note une étude expérimentale qui pourrait être utile pour le stockage de l’hydrogène et basée sur la même méthode que celle citée précédemment ; par ailleurs, la discussion concernant les données obtenues semble montrer que le processus d’adsorption sur les surfaces externes et internes des nanotubes semble se révéler efficace dans les conditions de notre expérience.
2 Mode opératoire
Nous avons utilisé un matériau carboné, brut de synthèse et contenant dans la proportion de 58 %, des nanotubes à paroi unique, produit fourni par le Groupe de dynamique des phases condensées, de l’université de Montpellier II. Un échantillon de ce matériau était disposé dans un réacteur, lui-même placé dans une cellule optique pour hautes pressions. Cette dernière était ensuite mise sous pression d’hydrogène de grande pureté (N55), comprimé à 40 MPa. L’excitation du matériau s’obtenait avec un laser Yag délivrant des impulsions d’énergie 100 mJ et de durée 15 ns, à la longueur d’onde de 532 nm ; le faisceau lumineux était légèrement focalisé afin d’éviter toute possibilité de destruction pour les nanotubes mais son intensité était suffisante pour bien les disperser par ablation au sein du gaz comprimé. Dans ces conditions, les liaisons entre atomes de carbone sont agrandies pendant un temps très court, toutefois suffisamment long pour laisser passer les molécules d’hydrogène, qui restent piégées à l’intérieur des nanotubes grâce à l’influence des forces d’adsorption existant entre elles et les atomes de carbone.
L’expérience a été poursuivie pendant cinq heures, ce qui nous a permis de récupérer tout le produit dispersé dans le réacteur et la cellule optique. Ensuite, nous avons analysé ce dernier matériau au moyen de différents procédés, tels que la microscopie électronique à balayage, la diffraction X, la diffusion Raman et l’absorption infrarouge ; les résultats de ces analyses ont été comparés à ceux obtenus pour la référence du matériau non traité.
3 Résultats et discussion
La Fig. 1A montre l’image obtenue en microscopie électronique à balayage, du produit de référence, sur laquelle l’on distingue des fibres de diamètre 2 μm, composées de nombreux filaments entrelacés contenant les nanotubes et dont les diamètres varient entre 41 et 28 nm. En revanche, l’image de la Fig. 1B, concernant un échantillon du produit récupéré après traitement avec l’hydrogène, présente une structure beaucoup plus fine que celle trouvée pour la référence sur la Fig. 1A : par exemple, le nombre de fibres est beaucoup moins grand et leur diamètre est deux fois plus petit que celui cité précédemment, tandis que les filaments sont davantage individualisés et leurs diamètres varient entre 40 et 23 nm.

Images obtenues par microscopie électronique à balayage, de matériaux contenant des nanotubes de carbone à paroi unique : [A]–matériau de la référence ; [B]–matériau de l’échantillon traité avec l’hydrogène comprimé à 40 MPa.
Les spectres de diffraction X donnés sur la Fig. 2 pour la référence et l’échantillon montrent d’importantes modifications :
- • les raies les plus intenses, notées (hkl)a, correspondent à une structure de type graphite, tandis qu’elles sont accompagnées dans ces spectres de nouvelles raies apparaissant à des angles de diffraction plus petits. Nous proposons d’attribuer ces raies notées (hkl)b et (hkl)c à des structures de type graphite avec des distances entre couches plus faibles que celles correspondant aux raies (hkl)a ; notons en outre que les raies (hkl)b sont aussi accompagnées de nouvelles raies dans le spectre de l’échantillon, tout en apparaissant avec des profils très élargis par rapport à la référence ;
- • la raie notée (11), correspondant à la distance d11 entre les plans d’indice [11], formés de nanotubes contenus dans les filaments [13,14], est déplacée vers les faibles angles de diffraction dans le spectre de l’échantillon et son intensité est beaucoup plus petite que celle de la même raie (11) dans le spectre de la référence.
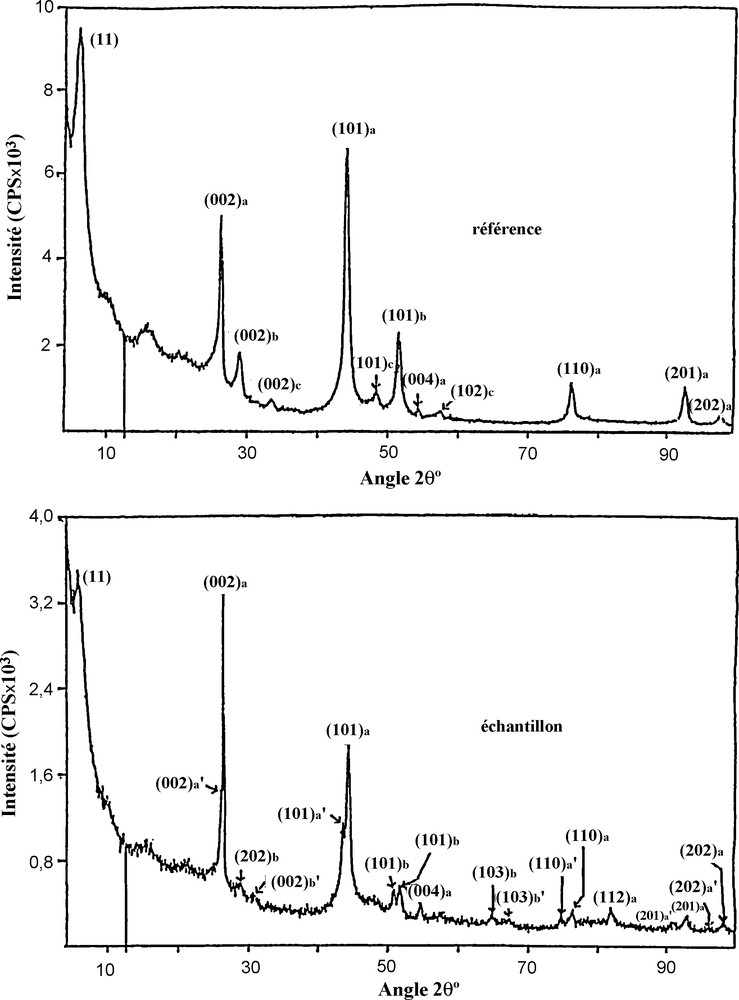
Spectres de diffraction X (source Kα du Cu), pour les matériaux de la référence et de l’échantillon.
Nous présentons maintenant des spectres de diffusion Raman obtenus avec les nanotubes de la référence ou d’un échantillon traité avec l’hydrogène, en utilisant un appareil équipé pour le micro-Raman, et une excitation provenant d’un laser à argon réglé sur la raie de longueur d’onde 488 nm ; le domaine spectral étudié s’étendait depuis 150 à 5000 cm−1.
La Fig. 3 décrit les spectres Raman obtenus dans tout le domaine de fréquence cité précédemment, où l’on voit que les principales bandes sont déplacées vers les grandes fréquences, tout en restant très fines, lorsque l’on passe de la référence à l’échantillon. Par ailleurs, nous avons observé, entre 450 et 1100 cm−1, plusieurs bandes dont les intensités étaient très faibles et qui étaient déplacées vers les basses fréquences, comme le montre la Fig. 4 ; ce dernier effet pourrait être dû à la modification de la ligne de base, quand on passe de la référence à l’échantillon. En outre, on peut noter sur le spectre de l’échantillon l’apparition d’une bande très large, centrée vers 773 cm−1, qui n’existe pas dans le spectre de la référence et dont l’origine pourrait être reliée à la présence de nombreuses molécules d’hydrogène à l’intérieur des nanotubes. Enfin, l’on a présenté sur la Fig. 5 les spectres Raman de la référence et de l’échantillon, entre 150 et 500 cm−1. Ces deux spectres comportent chacun trois bandes, dont deux ont une intensité relativement forte, celle de la troisième étant très faible ; notons, par ailleurs, que toutes ces bandes sont déplacées vers les grandes fréquences, quand on passe de la référence à l’échantillon.
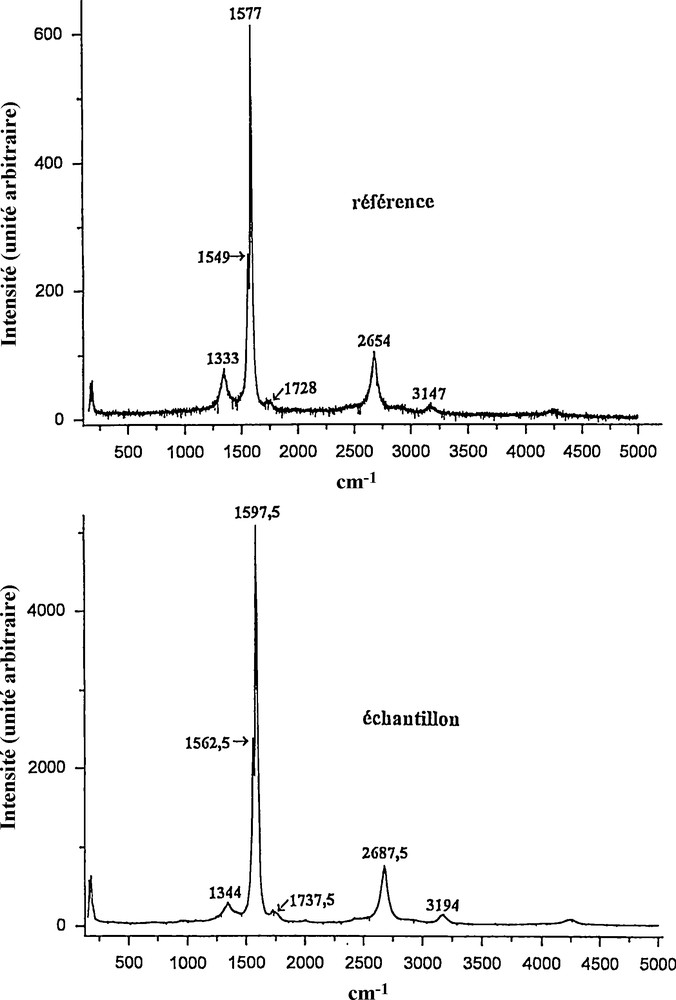
Spectres de diffusion Raman (longueur d’onde 488 nm), pour les matériaux de la référence et de l’échantillon, dans le domaine de fréquence 500–5000 cm−1.
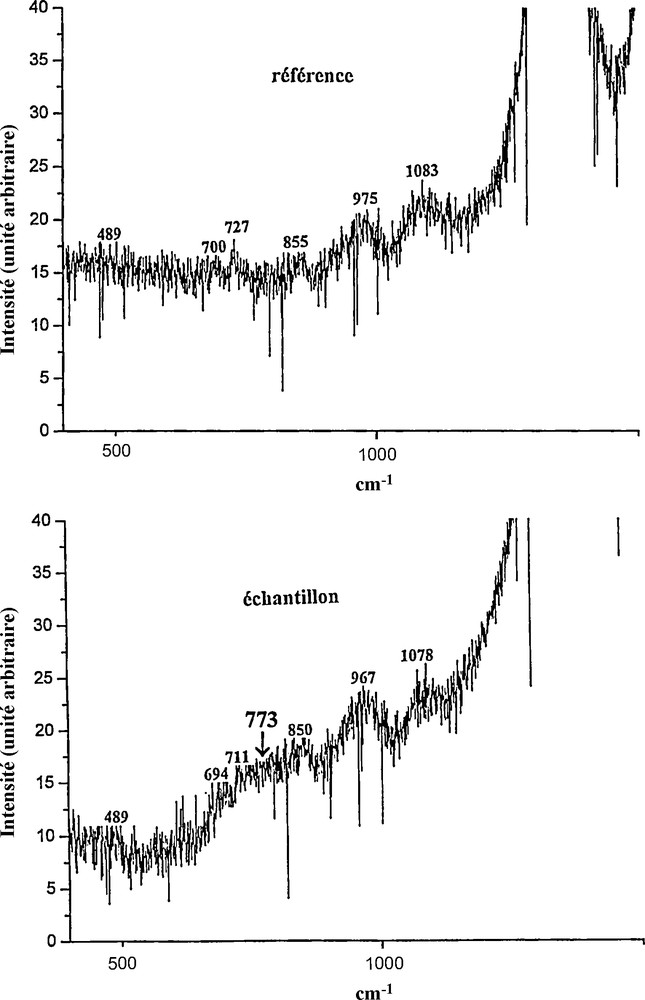
Spectres de diffusion Raman (longueur d’onde 488 nm), pour les matériaux de la référence et de l’échantillon, dans le domaine de fréquence 500–1500 cm−1.

Spectres de diffusion Raman (longueur d’onde 488 nm), pour les matériaux de la référence et de l’échantillon, dans le domaine de fréquence 100–500 cm−1.
En ce qui concerne l’état de la molécule d’hydrogène, quand elle est adsorbée sur un matériau contenant des nanotubes de carbone, l’on sait que le processus d’adsorption peut se produire sur les surfaces extérieures ou dans les espaces interstitiels, ainsi que dans l’intérieur des nanotubes. Pour ce dernier cas d’adsorption, nous pensons que notre méthode de préparation par excitation laser est efficace afin d’introduire beaucoup de molécules d’hydrogène dans le matériau, ainsi que semble le montrer la Fig. 6, où nous avons observé une nette augmentation de l’intensité Raman de l’ordre de 60 %, pour la bande de vibration–rotation de la molécule, entre celle de la référence due à la présence d’hydrogène au cours de la synthèse des nanotubes et celle de l’échantillon de ce matériau traité avec l’hydrogène dans nos expériences. Notons, par ailleurs, que ces deux bandes sont fortement élargies et déplacées vers les grandes fréquences, par rapport à la bande de vibration–rotation de la molécule isolée, dont la rotation pure déplacée vers le bleu pourrait correspondre à la bande trouvée à 773 cm−1 sur la Fig. 4.

Spectres de diffusion Raman (longueur d’onde 488 nm), pour les matériaux de la référence et de l’échantillon, dans le domaine de fréquence 4000–5000 cm−1, montrant la présence des molécules d’hydrogène à l’intérieur des nanotubes.
Pour l’obtention de la quantité d’hydrogène piégé dans l’échantillon de nanotubes de carbone, nous avons essayé d’utiliser la méthode de spectroscopie déjà employée pour les complexes C60-atome ou molécule, portés à la température de 800 °C pendant deux heures [11,12]. Toutefois, la méthode s’est révélée inefficace dans le cas considéré ici, à cause de cette température beaucoup trop faible des nanotubes de carbone pour obtenir leur ouverture, ainsi que la désorption de H2.
Pour terminer la description de nos études de spectroscopie, nous avons entrepris par ailleurs un examen de nos matériaux dans la région de l’infrarouge avec un appareil à transformée de Fourier, entre 2800 et 3000 cm−1. La Fig. 7 montre le spectre d’absorption de l’échantillon, normalisé par rapport à celui de la référence ; on y voit l’apparition de trois bandes correspondant à des groupements C-Hn, ce qui indique la présence d’un processus de chimisorption, concomitant avec celui de physisorption. Notons que les fréquences de ces bandes sont très proches de celles observées dans le cas de la préparation de complexes endohédriques C60-hydrogène [12] : 2852 cm−1 = CH2(sym.), 2919 cm−1 = CH et CH2(asym.), 2961 cm−1 = CH3(asym.) ; la structure électronique de ces groupements C-Hn est de type sp3.
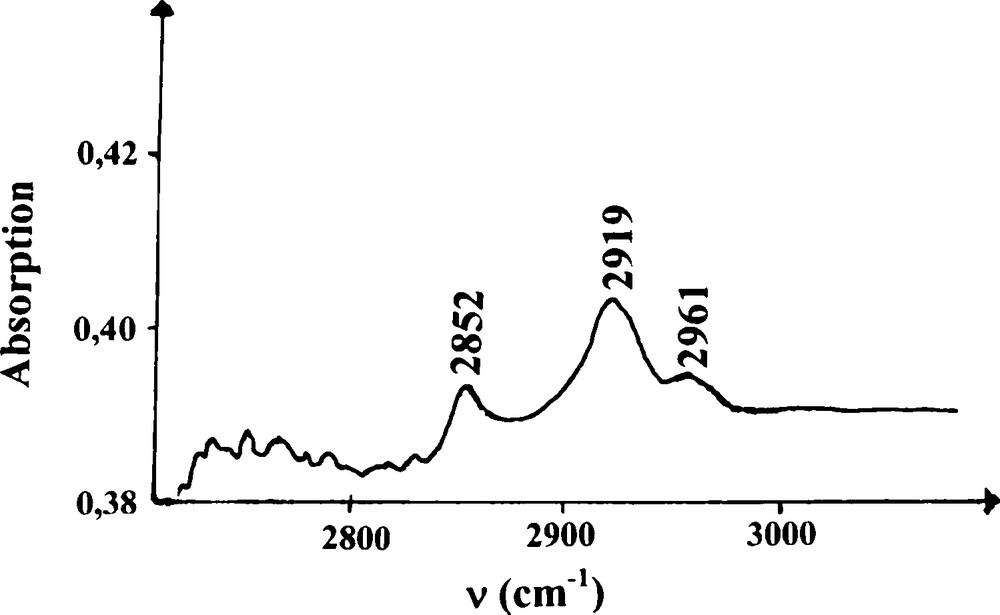
Spectre d’absorption infrarouge pour le matériau de l’échantillon, normalisé par rapport au spectre d’absorption infrarouge de la référence.
Pour terminer, l’on sait que les diamètres des nanotubes de carbone à paroi simple peuvent être déterminés à partir de la raie X d’indice (11), ainsi que par la relation simple existant entre ces paramètres et les basses fréquences des vibrations de type A1g actives en diffusion Raman [14–15]. Ainsi, dans le cas de la référence, nous avons obtenu une valeur moyenne des diamètres de 1,286 nm, à partir de la raie (11) de la Fig. 2, tandis qu’avec les fréquences des bandes Raman mesurées sur la Fig. 5, nous avons trouvé une valeur moyenne de 1,312 nm. Sur la base de l’accord relativement bon entre les résultats donnés par ces deux expériences, nous estimons que la référence contient essentiellement des nanotubes de type « fauteuil », caractérisés par les indices de chiralité (10,10) et d’angle de chiralité 30°. Par ailleurs, en ce qui concerne l’échantillon traité avec l’hydrogène, la raie (11) nous a permis d’obtenir la valeur moyenne de 1,281 nm pour les diamètres, si nous admettons que l’angle de chiralité présente une dispersion égale à environ 10° ; cette dernière valeur de diamètres est en très bon accord avec celle obtenue en Raman, égale à 1,287 nm. En conséquence, nous en déduisons que l’échantillon traité avec l’hydrogène est composé de trois parties égales en nanotubes de configurations (10,10), (11,9) et (12,8) [16].
Enfin, les bandes Raman de l’hydrogène montrées sur la Fig. 6 présentent des déplacements bleus dus aux interactions répulsives, entre la molécule d’hydrogène et les atomes de carbone formant les nanotubes. Nous avons pu calculer, sur la base de la théorie décrivant le potentiel d’interaction pour l’adsorption d’un gaz dans des nanotubes [17], un ordre de grandeur de l’intensité des interactions répulsives, responsables des déplacements, égal au dixième de l’intensité maximale de l’interaction attractive entre une molécule d’hydrogène et un atome de carbone.
Par ailleurs, nous pouvons rapprocher nos travaux de ceux entrepris sur l’adsorption et le stockage de l’hydrogène, qui utilisent sur le plan expérimental une méthode électrochimique et présentent sur le plan théorique des calcules numériques décrivant l’interaction totale entre le carbone et l’hydrogène [18]. Ainsi, ces derniers travaux ont confirmé la présence de l’hydrogène dans l’intérieur des nanotubes par la détection de la bande Raman de la molécule d’hydrogène, déplacée vers le bleu, ainsi que par les calculs numériques qui donnent le bon ordre de grandeur des déplacements ; en outre, ces calcules montrent que dans la région de 1000 cm−1 existe une faible contribution d’intensité en diffusion Raman, qui pourrait correspondre à la bande apparaissant sur la Fig. 4 à 773 cm−1, que nous avions attribuée à la rotation pure des molécules d’hydrogène adsorbées à l’intérieur des nanotubes.
Remerciements
Nous voulons remercier très chaleureusement pour leur aide technique, M.-C. Château du LPMTM dans l’acquisition des spectres de R. X, M.-P. Marteau du LIMHP pour l’obtention des spectres en infrarouge et M.-O. Brinza du LIMHP pour les travaux en spectroscopie Raman.


