1 Introduction
La chimie de l’acide déhydracétique a été largement étudiée comme modèle de polyketides 〚1–3〛 et aussi comme matière première pour la synthèse des produits naturels 〚4–8〛.
Ce composé isolé à partir de sources naturelles 〚9, 10〛 joue un rôle important dans la synthèse organique et est utilisé dans la préparation de nouveaux dérivés fonctionnels à large spectre d’application 〚11〛.
Il est à noter que les travaux relatifs à l’action des réactifs nucléophiles sur l’acide déhydracétique se sont multipliés au cours de ces dernières années 〚12–15〛. Les résultats obtenus dépendent des conditions opératoires et de la nature des réactifs utilisés.
Pour notre part, dans le cadre de nos recherches sur l’utilisation de l’acide déhydracétique 1 et de ses dérivés en synthèse hétérocyclique 〚16–21〛, nous rapportons dans ce travail la synthèse de nouvelles molécules susceptibles de présenter des propriétés pharmacologiques intéressantes : une pyridopyrimidine, une thiazolopyrimidine et une pyridone.
Les méthodes de synthèse que nous avons adoptées mettent en jeu l’ouverture du cycle pyranique par des réactifs binucléophiles tels que la 2-amino-3-hydroxypyridine, le 2-aminothiazole et le 2-aminophénol.
2 Résultats et discussions
Dans un premier temps, nous nous sommes intéressés à la synthèse de nouveaux dérivés pyrimidiniques condensés, qui constituent une classe hétérocyclique ayant des propriétés pharmacologiques intéressantes 〚22, 23〛.
Ils sont généralement préparés en condensant les amidines hétérocycliques avec les composés 1,3-difonctionnels aliphatiques 〚24–27〛. La littérature rapporte peu d’études concernant l’utilisation de l’acide déhydracétique comme agent de cyclisation 〚28〛.
Pour notre part, nous avons fait réagir la 2-amino-3-hydroxypyridine sur l’acide déhydracétique au reflux du butanol. La réaction conduit à la pyridopyrimidine 2, qui existe, en solution, sous deux formes tautomères 2a et 2b, dans des proportions relatives de 33/67 dans CDCl3 (Fig. 1).

Réaction de la 2-amino-3-hydroxypyridine sur l'acide déhydracétique au reflux du butanol, conduisant à la pyridopyrimidine 2, qui existe, en solution, sous deux formes tautomères 2a et 2b.
L’existence des deux formes tautomères est attestée par le dédoublement des signaux dans leur spectre RMN 1H et 13C.
Il est à noter que le déblindage du signal du proton pyridinique à 8,9 ppm permet de montrer que ce proton est en position péri par rapport au carbonyle du noyau pyrimidinique 〚24, 29〛.
La formation du produit 2 peut s’expliquer selon le mécanisme suivant (Fig. 2) : le groupement amino exocyclique NH2 de la pyridine attaque le carbonyle du groupe acétyle de l’acide déhydracétique. L’intermédiaire réactionnel 〚A〛 résultant se réarrange par perte d’une molécule d’eau, conduisant ainsi à un deuxième intermédiaire non isolable 〚B〛, qui se réarrange à son tour par attaque du groupement endocyclique NH du cycle pyridinique sur le carbonyle en position 2 pyranique, donnant ainsi naissance au composé 2.
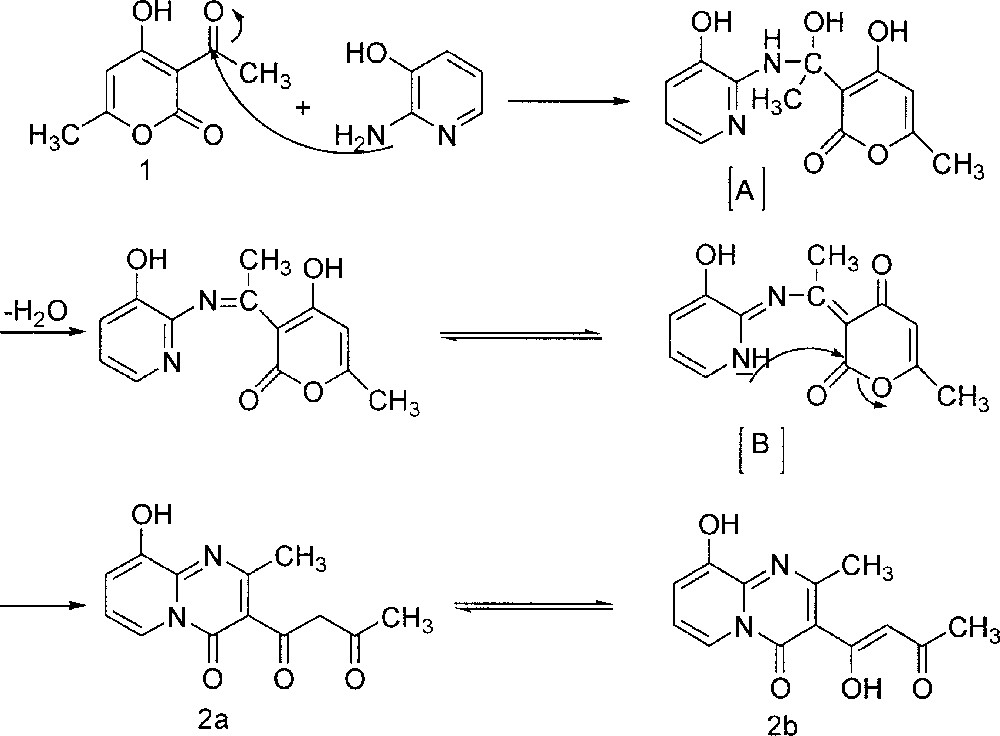
Formation du produit 2 par attaque du carbonyle du groupe acétyle de l'acide déhydracétique par le groupement amino exocyclique NH2 de la pyridine.
Par ailleurs, la condensation du 2-aminothiazole avec 1, effectuée à fusion pendant 3 h, conduit aux composés 3 et 4, séparés par chromatographie sur colonne de silice et dont les structures ont été identifiées grâce aux données spectrales RMN 1H, 13C et masse. (Fig. 3).
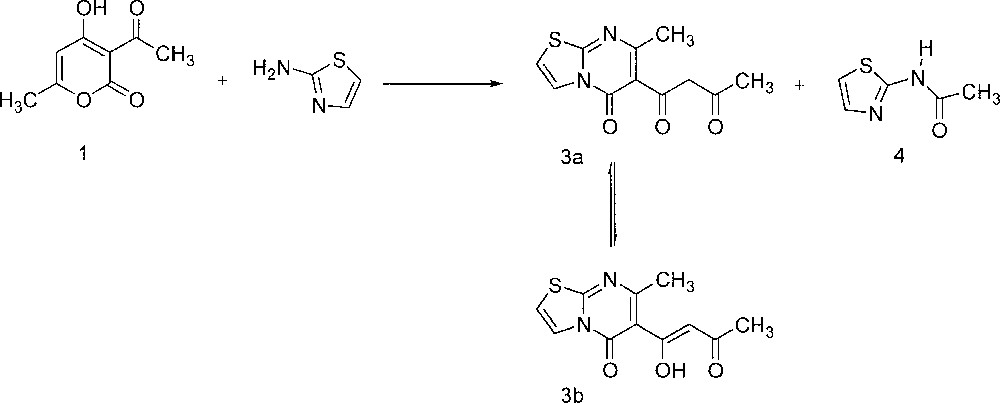
Condensation du 2-aminothiazole avec 1 effectuée à fusion pendant 3 h, conduisant aux composés 3 et 4.
Le spectre RMN 1H du composé 4 montre, en particulier, à côté du signal à 2,27 ppm attribué au méthyle, celui relatif au groupement NH à 12,27 ppm.
Le spectre RMN 13C, d’aspect simple, révèle, en particulier, le signal attribué au carbonyle à 170,52 ppm.
Par ailleurs, le spectre RMN 1H de la thiazolopyrimidine 3 montre que le composé existe aussi sous deux formes tautomères 3a et 3b attestées particulièrement par la présence de deux singulets à 4,18 et 6,18 ppm, dus respectivement aux protons méthylénique et vinylique des deux formes.
La structure du composé 3 est confirmée par son spectre RMN 13C, qui met en évidence, en particulier, les signaux attribués aux carbones méthylénique et vinylique des deux formes, respectivement à 24,53 et 59,13 ppm.
Le résultat obtenu à partir de la réaction de 1 avec le 2-aminothiazole permet de proposer un mécanisme expliquant la formation de 3 et 4 (Fig. 4).
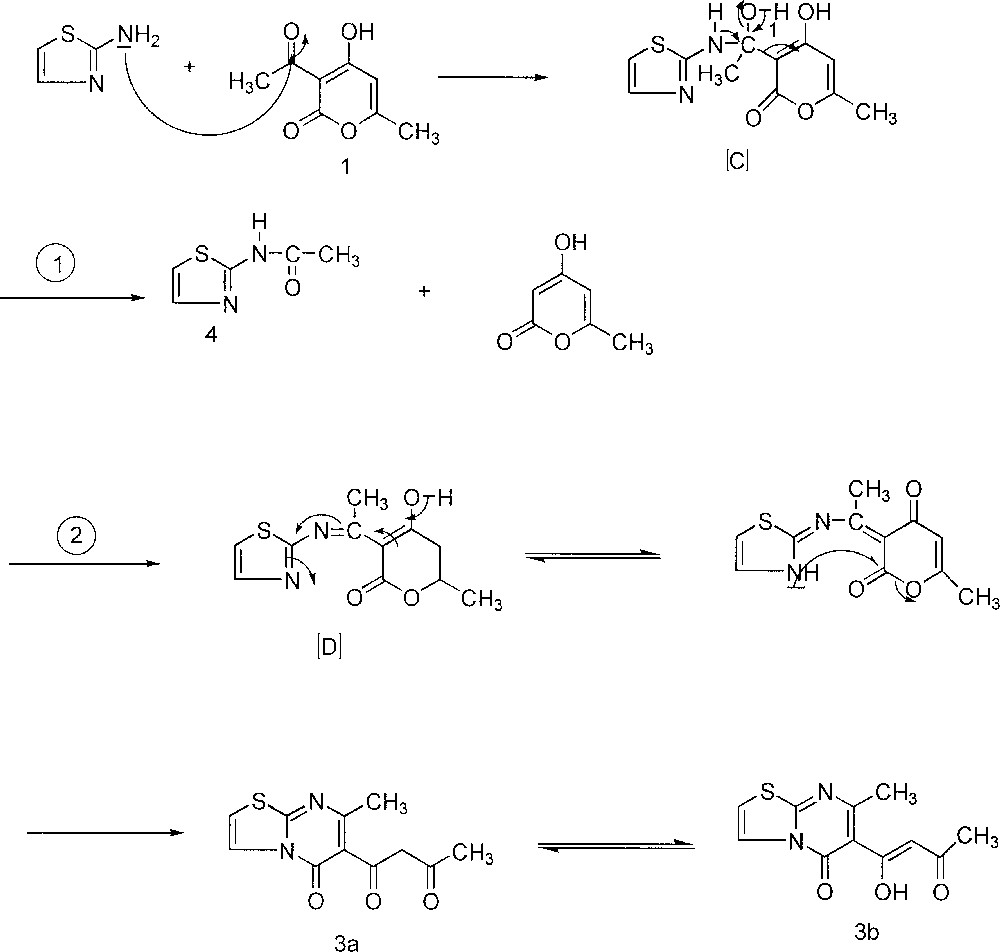
Le résultat obtenu à partir de la réaction de 1 avec le 2-aminothiazole permet de proposer un mécanisme expliquant la formation de 3 et 4.
Le groupement amino exocyclique NH2 du 2-aminothiazole attaque le carbonyle de l’acétyle de 1. L’intermédiaire réactionnel 〚C〛 peut perdre la 4-hydroxy-6-méthylpyran-2-one pour conduire au 2-acétylaminothiazole 4, ou se réarranger, par perte d’une molécule d’eau, en intermédiaire non isolable 〚D〛. Ce dernier, subissant l’attaque du NH endocyclique du thiazole sur le carbonyle en position 2 du cycle pyranique, conduit au composé 3, fonctionnalisé en position 2 du cycle pyrimidique.
La chaîne latérale α,β dicarbonylée du composé 3 ainsi préparé est un synthon approprié pour la synthèse de nouveaux composés hétérocycliques.
En effet, l’action de l’hydrazine hydratée sur 3, à reflux de l’éthanol pendant 3 h, a permis l’obtention de la pyrazol-3-ylthiazolopyrimidine 5 (Fig. 5).

Obtention de la pyrazol-3-ylthiazolopyrimidine 5 par action de l'hydrazine hydratée sur 3.
La structure du composé 5 a été élucidée grâce aux données spectrales RMN 1H, 13C et masse.
Sur le spectre RMN 1H, on note, en particulier, un singulet à 6,29 ppm, correspondant au proton pyrazolique.
Ainsi donc, l’utilisation de l’acide déhydracétique comme agent de cyclisation a permis l’obtention de nouveaux dérivés pyrimidiniques condensés, qui peuvent être exploités dans la synthèse de nouvelles pyrimidines associant le pyrazole.
Ensuite, nous avons étudié l’action du 2-aminophénol sur l’acide déhydracétique.
Dans des travaux précédents 〚11〛, nous avons montré que la condensation de l’o-phénylènediamine avec l’acide déhydracétique permet l’obtention de composés de structure 1,5-benzodiazépine et de dérivés benzimidazoliques. En aucun cas, il ne nous a été possible d’isoler des pyridones.
En revanche, ces dernières sont obtenues aisément à partir de la condensation de l’o-phénylènediamine avec la 2,6-diméthylpyrone 〚18〛.
L’intérêt du présent travail est de décrire une nouvelle voie d’accès aux pyridones directement à partir de l’acide déhydracétique et l’o-aminophénol et de préciser le mécanisme qui permet de transformer le cycle pyrone en cycle pyridone.
Ainsi, le chauffage de 1 avec le 2-aminophénol dans l’éthanol nous a permis d’isoler la N-(hydroxyphényl)-3-acétimidoyl-4-hydroxy-6-méthylpyran-2-one 6. Lorsque la même réaction est réalisée dans le xylène en présence de quelques gouttes d’acide chlorhydrique, celle-ci conduit au chlorhydrate de la pyridone 7 (Fig. 6).

Chauffage de 1 avec le 2-aminophénol dans l'éthanol nous a permis d'isoler la N-(hydroxyphényl)-3-acétimidoyl-4-hydroxy-6-méthylpyran-2-one 6. Lorsque la même réaction est réalisée dans le xylène en présence de quelques gouttes d'acide chlorhydrique, celle-ci conduit au chlorhydrate de la pyridone 7.
La structure du composé 6 a été établie par voie spectroscopique et par comparaison avec le produit de référence 〚30〛.
Par ailleurs, la structure du produit 7 a été identifiée également sur la base des données spectrales RMN 1H, 13C et masse, puis confirmée de surcroît par la diffraction X, qui montre que le composé 7 existe sous forme de sel et cristallise avec deux molécules d’eau.
Ainsi, la diffraction des rayons X nous a permis de déterminer les structures cristalline et moléculaire du composé 7 (Fig. 7). Ce dernier cristallise dans le système monoclinique ; les longueurs de liaisons et les angles correspondant au composé 7 sont rassemblés dans le Tableau 1.
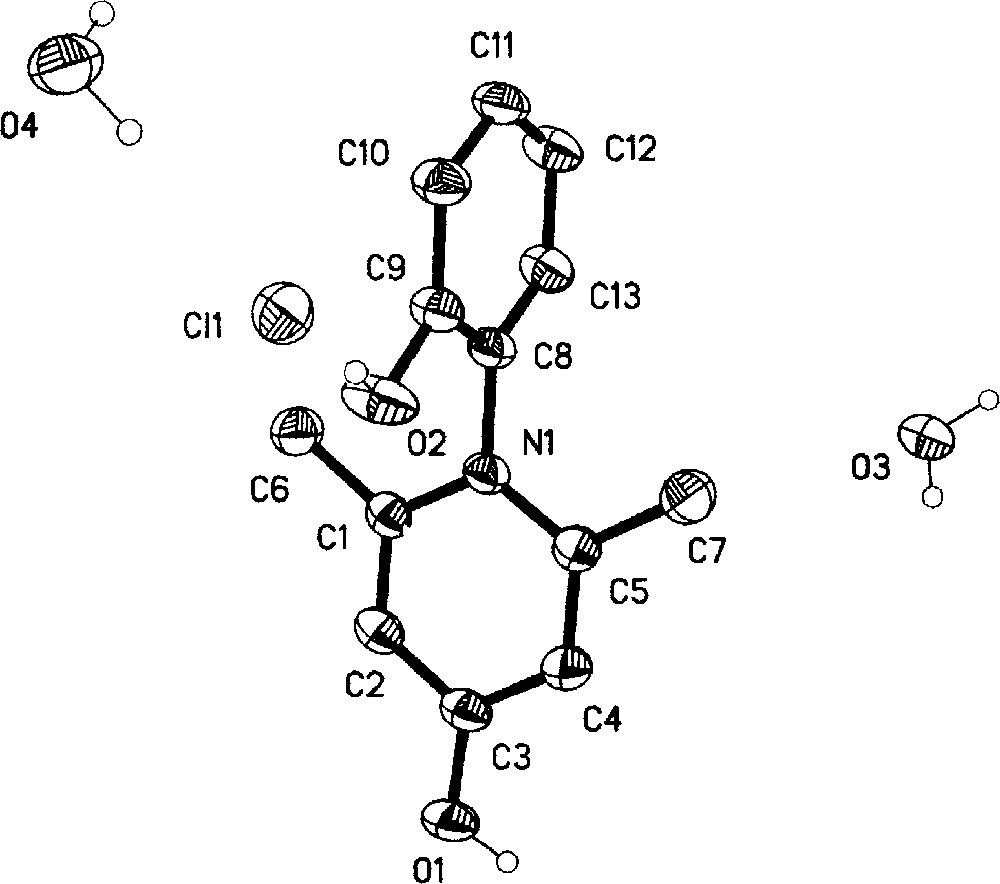
Représentation Ortep du composé 7.
Principales longueurs de liaisons (Å) et angles(°) du composé 7.
| N(1)–C(5) | 1,3719(17) |
| N(1)–C(1) | 1,3720(16) |
| N(1)–C(8) | 1,4567(15) |
| O(1)–C(3) | 1,3282(15) |
| O(2)–C(9) | 1,3606(16) |
| C(1)–C(2) | 1,3729(17) |
| C(1)–C(6) | 1,5009(19) |
| C(2)–C(3) | 1,4016(19) |
| C(8)–C(13) | 1,3889(18) |
| C(8)–C(9) | 1,3950(18) |
| C(10)–C(11) | 1,3918(19) |
| C(10)–C(9) | 1,3996(18) |
| C(11)–C(12) | 1,389(2) |
| C(13)–C(12) | 1,3947(19) |
| C(3)–C(4) | 1,4006(19) |
| C(4)–C(5) | 1,3761(18) |
| C(5)–C(7) | 1,502(2) |
| C(5)–N(1)–C(1) | 121,32(11) |
| C(5)–N(1)–C(8) | 119,29(10) |
| C(1)–N(1)–C(8) | 119,10(11) |
| N(1)–C(1)–C(2) | 119,52(12) |
| N(1)–C(1)–C(6) | 118,58(11) |
| C(2)–C(1)–C(6) | 121,89(12) |
| C(1)–C(2)–C(3) | 120,64(12) |
| C(13)–C(8)–C(9) | 121,71(11) |
| C(13)–C(8)–N(1) | 121,22(11) |
| C(9)–C(8)–N(1) | 117,07(11) |
| C(11)–C(10)–C(9) | 119,52(13) |
| C(12)–C(11)–C(10) | 121,16(12) |
| O(2)–C(9)–C(8) | 116,64(11) |
| O(2)–C(9)–C(10) | 124,53(12) |
| C(8)–C(9)–C(10) | 118,83(12) |
| C(8)–C(13)–C(12) | 119,09(13) |
| O(1)–C(3)–C(4) | 123,53(13) |
Toutes ces observations nous permettent de proposer un mécanisme d’obtention de la pyridone 7.
En effet , la formation du composé 7 peut être expliquée par l’hydrolyse en milieu acide de l’acide déhydracétique. L’acide β-cétonique ainsi formé, après élimination d’une molécule de dioxyde de carbone, conduit à la diacétylacétone, qui se cyclise en diméthylpyrone 10 〚18〛. Cette dernière subit l’attaque du groupement amino de l’o-aminophénol sur le carbone en position 2 ou 6 de la pyrone 10. L’intermédiaire 〚E〛 ainsi formé se cyclise et donne, après perte d’une molécule d’eau, le composé 11, qui est acidifié par lˈacide chlorhydrique, présent en solution, pour donner le composé 7 (Fig. 8).
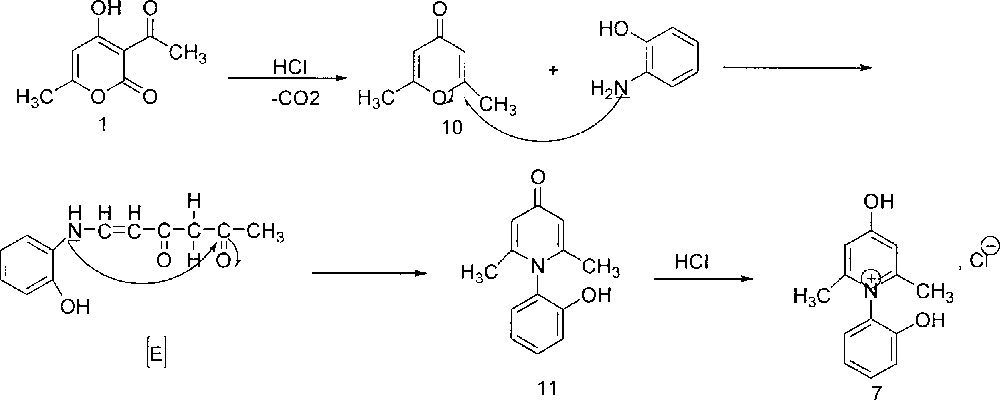
Formation du composé 7 par hydrolyse en milieu acide de l'acide déhydracétique.
Les mêmes résultats ont été obtenus par Katritzky et al. 〚31〛 lors de l’action des amines aromatiques sur l’acide déhydracétique et sur la 2,6-dimétylpyrone.
Ainsi donc, à l’issue de ce travail, nous avons pu mettre au point une méthode de préparation directe des pyridones mettant en œuvre l’acide déhydracétique et l’o-aminophénol.
3 Conclusion
Les résultats obtenus permettent de confirmer l’intérêt de l’acide déhydracétique pour la synthèse de composés hétérocycliques dérivés de la pyridopyrimidine, la thiazolopyrimidine et la pyridone.
4 Partie expérimentale
4.1 Généralités
Les points de fusion ne sont pas corrigés. Les spectres de RMN 1H et 13C ont été enregistrés sur un appareil Bruker (AC 250). Les spectres de masse ont été réalisés avec un Varian MAT 311 A.
4.2 Synthèse de la pyridopyrimidine 2
On porte à reflux dans le butanol 0,02 mol de 2-amino-3-hydroxypyridine et 0,01 mol d’acide déhydracétique 1 pendant 24 h. Après évaporation du solvant de la réaction, sous pression réduite, le produit 2 est obtenu après purification par chromatographie sur colonne de silice (éluant : dichlorométhane/éthanol 99:1).
Rdt = 65%. PF = 157–159 °C (dichlorométhane).
RMN 1H (CDCl3) δ (ppm) : 8,55 (s, 1 H, OH) ; 7,66–7,16 (m, 3 H, arom.) ; 6,24 (s, 0,36 H, =CH b) ; 4,18 (s, 0,72 H, CH2 a) ; 2,72 (s, 1,08 H , CH3 a) ; 2,64 (s, 1,92 H, CH3 b) ; 2,30 (s, 0,72 H, CH3 a) ; 2,15 (s, 1,92 H, CH3 b).
RMN 13C (CDCl3) δ (ppm) : 195,6 (Cq) ; 190,7 (Cq) ; 185,0 (Cq) ; 167,2 (Cq) ; 164,0 (Cq) ; 155,1 (Cq) ; 148,7 (Cq) ; 148,5 (Cq) ; 118,5 (=CH) ; 117 (=CH) ; 116,5 (=CH) ; 116,4 (=CH) ; 115,1 (=CH) ; 103,3 (=CH) ; 58,7 (CH2) ; 25,4 (CH3) ; 24,9 (CH3) ; 24 ,4 (CH3).
Masse (IE) m/z (%) : 260 (8) ; 245 (6) ; 217 (16) ; 203 (15) ; 176 (5) ; 148 (10) ; 135 (76) ; 94 (72) ; 85 (40) ; 69 (100).
4.3 Synthèse de la thiazolopyrimidine 3 et de la 2-acétylaminothiazole 4
Le mélange de 0,005 mol d’acide déhydracétique 1 et 0,005 mol de 2-aminothiazole est porté à fusion des réactifs à 120 °C (bain d’huile) pendant 3 h. Le produit 3 est obtenu en premier suivi du composé 4 par chromatographie du résidu sur colonne de gel de silice (éluant : hexane/chloroforme 50:50).
4.3.1 Caractéristiques de 3
Rdt = 60%. PF = 117–118 °C (éthanol).
RMN 1H (CDCl3) δ (ppm) : 8,05 (d, J = 1,95 Hz, 1H, CH) ; 7,08 (d, J = 1,95 Hz, 1H, CH) ; 6,18 (s, 0,85 H, =CH a) ; 4,18 (s, 0,3 H, CH2 b) ; 2,67 (s, 0,45H, CH3 b) ; 2,59 (s, 2,5 H, CH3 a) ; 2,28 (s, 0,45 H, CH3 b) ; 2,18 (s, 2,5 H, CH3 a).
RMN 13C (CDCl3) δ (ppm) : 203,69 (C=O) ; 195,51 (C=O) ; 191,23 (C=O) ; 169,29 (Cq) ; 165,63 (C=O) ; 162,78 (Cq) ; 158,10 (Cq) ; 156,81 (Cq) ; 122,94 (=CH) ; 114 ,11 (Cq) ; 113,26 (Cq) ; 113 ,05 (Cq) ; 112,51 (=CH) ; 103,80 (=CH) ; 59,13 (CH2 b) ; 31,06 (CH3 b) ; 25,66 (CH3 b) ; 25,36 (CH3 a) ; 24,53 (CH3 a).
Masse (IE) m/z (%) : 250 (37) ; 235 (64) ; 207 (58) ; 193 (100) ; 166 (15) ;149 (15) ; 125 (77) ;67 (30) ; 43 (91).
4.3.2 Caractéristiques de 4
Rdt =30%. PF = 208–210 °C (éthanol).
RMN1H (CDCl3) δ (ppm) : 12,27 (s, 1H, NH) ; 7,37 (d, 3J = 0,8 Hz, 1H, CH) ; 6,93 (d, 3J = 0,8 Hz, 1H, CH) ; 2,27 (s, 3 H, CH3).
RMN 13C (CDCl3) δ (ppm) : 170,52 (Cq) ; 162,59 (Cq) ; 138,67 (=CH) ; 116,03 (=CH) ; 25,62 (CH3).
4.4 Synthèse du pyrazol-3-yl-thiazolopyrimidine 5
À 1,6 × 10–3 mol de 3 on ajoute 2,1 × 10–3 mole de l’hydrazine hydratée dans 20 cm3 d’éthanol. La solution est portée à reflux pendant 3 h. Après diminution du volume d’éthanol, un solide jaune précipite ; il est filtré et recristallisé dans l’acétate d’éthyle.
Rdt = 95%. PF = 151–152 °C (acétate d’éthyle).
RMN 1H (CDCl3) δ (ppm): 8,03 (d, 1 H, 3J = 4,8 Hz, =CH) ; 7,02 (d, 1 H, 3J = 4,8 Hz, =CH) ; 6,29 (s, 1 H, =CH) ; 2,61 (s, 3 H, CH3) ; 2,34 (s, 3 H, CH3).
RMN 13C (CDCl3) δ (ppm) : 160,9 (Cq) ; 159,2 (Cq) ; 157,9 (Cq) ; 147 (Cq) ; 138,3 (Cq) ; 122,2 (=CH) ; 112,1 (=CH) ; 108,9 (Cq) ; 105,9 (=CH) ; 25,4 (CH3) ; 13,2 (CH3).
Masse (IE) m/z (%) : 246 (100) ; 218 (17) ; 217 (26) ; 204 (11) ; 203 (10) ; 177 (11) ; 125 (51) ; 119 (16) ; 91 (14) ; 85 (15) ; 81 (20).
4.5 Synthèse des produits 6 et 7
4.5.1 Mode opératoire général
On chauffe à reflux pendant 24 h 0,005 mol d’acide déhydracétique 1 et 0,005 mol de 2-aminophénol dans 40 cm3 de xylène en présence de quelques gouttes d’acide chlorhydrique. Le solvant est évaporé à sec sous pression réduite et le résidu est chromatographié sur colonne de silice (éluant : chloroforme/éther 90:10).
4.5.2 N-(hydroxyphényl)3-acétimidoyl-4-hydroxy-6-méthylpyran-2-one 6
Rdt = 40%. PF = 188–189 °C (éthanol).
RMNH 1H (DMSO-d6) δ (ppm): 10,21 (s, 2 H, OH) ; 7,16 (m, 4 H, arom.) ; 5,80 (s, 1 H) ; 2,46 (s, 3 H, CH3) ; 2,12 (s, 3 H, CH3).
RMNH 13C (DMSO-d6) δ (ppm): 183,7 (Cq) ; 175,1 (Cq) ; 163 (Cq) ; 151,3 (Cq) ; 129,2 (=CH) ; 126,7 (=CH) ; 123,1 (Cq) ; 119,2 (=CH) ; 117,3 (Cq) ; 116,3 (=CH) ; 106,6 (=CH) ; 96,4 (Cq) ; 19,8 (CH3) ; 19,1 (CH3).
Masse (IE) m/z (%) : 244 (100) ; 216 (51) ; 202 (5) ; 174 (10) ; 160 (40) ; 158 (15) ; 146 (12) ; 134 (37) ; 109 (12) ; 85 (12).
4.5.3 Pyridone 7
Rdt = 50%. PF = 296–298 °C (éthanol).
RMN 1H (DMSO-d6) δ (ppm) : 2,18 (s, 6 H, 2 CH3) ; 7,10 (s, 2 H, 2 CH) ; 7,26–7,50 (m, 4 H, CH arom.) ; 10,99 (s, 1H, OH).
RMN 13C (DMSO-d6) δ (ppm) : 170,92 (Cq) ; 156,32 (Cq) ; 151,23 (Cq) ; 125 (Cq) ; 127,39 (=CH) ; 120,20 (=CH) ; 117,41 (=CH) ; 113,08 (=CH) ; 20,64 (CH3).
Masse (IE) m/z (%) : 215 (100) ; 187 (64) ; 172 (39) ; 170 (10).


